 |
|
| Appunti universita |
|
 |
|
| Appunti universita |
|
| Visite: 3173 | Gradito: |
Leggi anche appunti:Le cellule staminaliLe cellule staminali Cosa sono le cellule staminali Le cellule Dermatosi eritematoseDERMATOSI ERITEMATOSE Le dermatosi eritematose possono avere Da difetto di cheratinizzazioneDA DIFETTO DI CHERATINIZZAZIONE Psoriasi È un disordine maturativo, non |
 |
 |
INFEZIONI RESPIRATORIE IN ETA' PEDIATRICA
Le principali affezioni a carico delle vie respiratorie nel bambino sono:
Faringo-tonsillite acuta;
Otite media;
Sinusite;
Laringite;
Bronchiolite;
Bronco-polmoniti.
Circa l'80% delle patologie che interessano il bambino al di sotto dei 5 anni è di natura infettiva e circa il 60% di queste ultime interessa il tratto respiratorio.
Alcuni agenti eziologici causano lesioni caratteristiche della mucosa oro-faringea e sono quindi facilmente riconoscibili; ricordiamo a titolo di esempio:
Le macchie di Köplik che compaiono nel morbillo due o tre giorni prima dell'esantema. Queste sono piccolissime macchie fugaci di colore bianco, simili a capocchie di spillo (a spruzzatura di calce), visibili sulla mucosa geniena a livello dei molari inferiori (scompaiono dopo 12-18 ore);
Le vescicole a grappolo dell'Herpes oro-labiale causate dall'Herpes simplex di tipo 1;
Le chiazze"grigio-bluastre" della difterite, velate e tendenti alla confluenza, chiamate anche "pseudomembrane difteriche", maleodoranti, frastagliate e tenacemente ancorate ai tessuti; una volta asportate lasciano una base di impianto sanguinante e abrasa;
La patina biancastra delle infezioni micotiche da candida albicans.
Faringo-tonsillite
Eziologia: La faringo-tonsillite può essere di origine sia virale che batterica, in particolare i virus in grado di causarla solo: rinovirus, adenovirus, virus influenzali e parainfluenzali, virus respiratorio sinciziale, Epstein Barr, enterovirus (coxachie A), herpes simplex.
L'eziologia batterica può essere sostenuta tra gli altri da Mycoplasma pneumoniae ma soprattutto dallo SBEGA (streptococco beta emolitico di gruppo A); altri microrganismi che possono talvolta associarsi alla faringite sono gli streptococchi di gruppo C, Arcanobacterium haemolyticum, Francisella tularensis, Neisseria gonorrhoeae e Corynebacterium diftheriae.
Le infezioni da SBEGA rappresentano oggi circa il 12-15% di tutte le faringo-tonsilliti.
Epidemiologia: Le infezioni virali delle vie aeree superiori si diffondono per contato ravvicinato e si verificano più comunemente in autunno, inverno e primavera. La faringite streptococcica è rara prima dei 2-3 anni di età, ha un picco di incidenza nei primi anni di scuola e declina nella tarda adolescenza e età adulta.
![]()
 Patogenesi: La colonizzazione della faringe da parte degli SBEGA può
risultare sia nello stato di portatore cronico, sia nell'infezione acuta. La
proteina M è il principale fattore di virulenza dello SBEGA efacilita la
resistenza alla fagocitosi da parte dei neutrofili polimorfonucleati. Durante
l'infezione si sviluppa un'immunità tipo-specifica, che fornisce un'immunità
protettiva verso successive infezioni con quel particolare sierotipo M.
Patogenesi: La colonizzazione della faringe da parte degli SBEGA può
risultare sia nello stato di portatore cronico, sia nell'infezione acuta. La
proteina M è il principale fattore di virulenza dello SBEGA efacilita la
resistenza alla fagocitosi da parte dei neutrofili polimorfonucleati. Durante
l'infezione si sviluppa un'immunità tipo-specifica, che fornisce un'immunità
protettiva verso successive infezioni con quel particolare sierotipo M.
La scarlattina è causata da SBEGA che produce da 1 a 3 esotossine eritrogeniche streptococciche (A, B e C) che possono indurre un fine rush papulare. L'esotossina A sembra essere quella più strettamente associata alla scarlattina. L'esposizione a ogni esotossina conferisce immunità specifica solo verso quella tossina e pertanto uno stesso soggetto può ammalarsi di scarlattina fino a 3 volte.
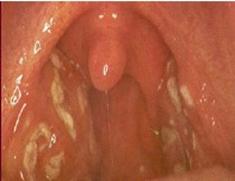
Manifestazioni cliniche: L'esordio della faringite streptococcica è spesso rapido, con importante mal di gola, assenza di tosse e febbre; la cefalea e i sintomi gastrointestinali (dolore addominale e vomito) sono frequenti.
La faringe è arrossata, le tonsille aumentano di volume e classicamente si rivestono di un essudato giallo, tinto di sangue. Possono formarsi petecchie o lesioni "a ciambella" sul palato molle e sulla faringe posteriore, e l'uvula può essere rossa, puntinata ed edematosa. I linfonodo cervicali anteriori sono aumentai di volume e dolenti ala palpazione.
Il periodo di incubazione è di 2-5 giorni. Alcuni pazienti presentano anche i segni della scarlattina: pallore periorale, lingua a fragola e un rush finemente papulare che alla palpazione ha una consistenza simile alla carta vetrata e nell'aspetto ricorda un'ustione solare associata a pelle d'oca.
L'esordio della faringite virale può essere più graduale; i sintomi più frequenti comprendono rinorrea, tosse e diarrea. Un'eziologia virale è suggerita dalla presenza di congiuntivite, coriza, raucedine e tosse. La faringite da Adenovirus può manifestarsi con congiuntivite e febbre (febbre faringo-congiuntivale). La faringite da virus Coxackie può causare la comparsa di piccole (1-2 mm) vescicole giallastre e ulcere nella faringe posteriore (herpangina) o noduletti (3-6 mm) bianco giallastri nella faringe posteriore (faringite acuta linfonodulare). Nella faringite da EBV si può riscontrare notevole aumento di volume delle tonsille, con presenza di essudato, linfadenite cervicale, epatosplenomegalia, rush e astenia generalizzata, che configurano una sindrome mononucleosica infettiva. L'infezione primaria da HIV nei bambini più piccoli si presenta spesso con febbre elevata e gengivostomatite, ma può anche essere presente faringite.
Diagnosi: La diagnosi differenziale tra una faringo-tonsillite di natura virale e una di natura streptococcica è molto importante, soprattutto per le problematiche legate alle complicanze di quest'ultima,ed in particolare per la prevenzione della malattia reumatica, della glomerulonefrite e dell'eritema nodoso.
Sebbene molte volte i quadri ad eziologia virale o batterica si sovrappongono, in linea generale possiamo dire che:
Le forme virali danno più spesso raffreddore, herpangina e febbre faringo-congiuntivale;
Le forme batteriche danno un'intensa faringite con essudato.
I criteri di BREEZE considerati insieme permettono di formulare un punteggio utile per "tentare" di distinguere una faringite streptococcica da una faringite di altra natura.
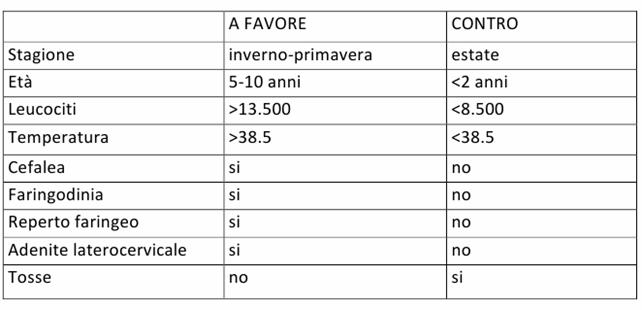
Figura : Criteri di Breeze.
La diagnosi di certezza viene comunque effettuata attraverso il tampone faringeo e il test rapido. Il test rapido (permette di fare diagnosi in pochi minuti) consiste nel prelevare, mediante semplice bastoncino, una certa quantità di muco presente in fondo alla gola toccando anche le tonsille; è importante non toccare le guance o altre parti della bocca perché in questo caso potrebbe contaminarsi e dare falsi risultati.
Accanto alla voce 'crescita batterica', viene indicato:
il termine 'presente' se sono stati rilevati germi nel campione prelevato;
il termine 'assente' se non è stato individuato alcun germe.
Per sapere se è positivo o negativo, si deve osservare la scritta 'si isola' accanto alla quale possono essere riportate le frasi: flora non patogena se non ci sono germi patogeni, Streptococco beta-emolitico del gruppo A se invece è stato isolato lo streptococco, in questo caso il test è positivo.
Il test rapido grazie a studi scientifici (categoria A, grado II) ha dimostrato avere una specificità del 95%, e una sensibilità del 80-90%. Se positivo il test viene considerato affidabile, mentre se negativo è necessario per la conferma della negatività eseguire un tampone faringeo con successivo esame colturale.
Terapia: La terapia antibiotica dovrebbe essere iniziata immediatamente, senza esami colturali, nei bambini con faringite sintomatica e un test rapido antigenico per lo streptococco positivo, diagnosi clinica di scarlattina, un familiare con faringite streptococcica documentata, anamnesi di pregressa febbre reumatica acuta o un familiare con un episodio recente di febbre reumatica acuta.
L'uso degli antibiotici nelle infezioni da SBEGA si è mostrato utile nel:
ridurre il decorso;
ridurre il rischio di trasmissione interumana;
prevenire la malattia reumatica (se la terapia è iniziata entro 9 giorni dalla definizione diagnostica).
I farmaci utilizzati sono:
Benzatin-penicillina (mono-somministrazione di 600 000 U al di sotto dei 6 anni o di 1200000 U al di sopra dei 6 anni);
Penicilline orali, ad esempio l'amoxicillina (25-50000 Ul/kg 2 volte al giorno per 10 giorni);
Macrolidi (eritromicina) o cefalosporine (cefalo) in caso di allergia alle penicilline che sono i farmaci di scelta.
Il tampone di controllo non deve essere effettuato dopo la terapia in quanto è possibile che si istauri uno stato di portatore senza che vi sia malattia. La coltura di follow-up è invece utile in caso di recidiva dei sintomi.
Se persiste lo stato di portatore, caratterizzato dalla persistenza dello SBEGA nella faringe, non è necessario ripetere la terapia antibiotica. Per eradicare lo stato di portatore viene utilizzata la clindamicina.
In caso di contatti non è necessario effettuare il test tranne che in condizioni particolari (individui con pregressa malattia reumatica, epidemia di malattia reumatica o glomerulonefrite in ambiente scolastico).
La terapia chirurgica, che consiste nell'asportazione delle tonsille palatine (tonsillectomia) e/o della tonsilla faringea (adenoidectomia) e indicata in caso di:
OSA (ostruttive sleep apnea): le crisi di apnea notturna possono in seguito all'ipossia causare problemi epatici (steatosi epatica) oltre che problemi di natura neurologica;
Ipertrofia con ostruzione;
Infezioni ricorrenti( più di 4 all'anno);
PTLD ovvero "Post-transplant lympho proliferative disorder": questo accade in bambini trapiantati che a causa della terapia immunosoppressiva a cui vanno incontro risultano poco protetti nei confronti di infezioni virali che possono virare verso una neoplasia (ad esempio linfoma di Burkitt dopo infezioni da Epstein Barr);
Tonsillite emorragica;
Portatore cronico sintomatico.
Indicazioni relative alla rimozione chirurgica sono:
L'alitosi;
L'ascesso peritonsillare;
L'otite media come complicanza;
le anomalie del linguaggio;
i disturbi della crescita e del peso (failure to thrive);
i disturbi della deglutizione;
la mal occlusione dentaria;
le anomalie del massiccio facciale (facies adenoidea).
Le indicazioni all'intervento restano tuttavia incerte. Un criterio è rappresentato dalla ricorrenza di 7 o più episodi di infezione della gola trattati con antibiotici nell'anno precedente, 5 o più episodi di infezione della gola trattati con antibiotici in ognuno dei 2 anni precedenti o 3 o più infezioni della gola trattati in ognuno dei 3 anni precedenti. La tonsillectomia si è dimostrata efficace nel ridurre il numero di infezioni e i sintomi della tonsillite cronica, come l'alitosi, il mal di gola persistente o ricorrente e l'adenite cervicale ricorrente.
Laringiti o Croup
Il termine "croup" indica un evento infiammatorio acuto del laringe caratterizzato da disfonia, tosse e stridore (suono aspro, metallico inspiratorio dovuto all'ostruzione delle alte vie). Si suddivide in:
laringite epiglottica o epiglottidite;
laringite ipoglottica.
Laringite ipoglottica (pseudocroup)
Colpisce perlopiù il bambino sotto i 3 anni per via del ridotto diametro delle vie e della maggior vascolarizzazione; è quasi esclusivamente virale (parainfluenza tipo 1), raramente dovuta a Mycoplasma pneumoniae.
Clinica: disfonia, tosse abbaiante, stridore e dispnea inspiratoria dovuti all'edema infiammatorio con stenosi laringea e spasmo delle corde vocali. Nelle forme gravi si ha cianosi. L'assenza o quasi di febbre e la mancanza di scialorrea consentono DD con l'epiglottidite.
Terapia: solo il 10% dei pz richiede l'ospedalizzazione; la tp si basa su idratazione, umidificazione dell'aria circostante fino a aerosol con cortisonici e adrenalina per i casi più gravi. In caso di desaturazione O2-tp riscaldata e umidificata.
Complicanze: tracheite batterica da sovrainfezione di S.aureus o H.influenzae tipo B; il bambino presenta uno stato tossico con ostruzione progressiva, secrezioni purulente e pseudomembrane.
Laringite acuta catarrale
Sintomatologia analoga alla precedente ma è dovuta ad uno spasmo riflesso del laringe che avviene perlopiù di notte, durante il sonno, causato da infezione delle alte vie respiratorie.
Epiglottidite
Rara ma molto più grave; dovuta a H.influenzae tipo B.
Clinica: improvvisa con febbre elevata, dispnea inspiratoria, disfonia, disfagia, scialorrea, prostrazione e assenza di tosse. Il bambino si presenta con il capo teso in avanti per facilitare la respirazione e può essere cianotico.
Diagnosi: esame laringoscopico da effettuarsi in sala operatoria con assistenza anestesiologica per il forte rischio di spasmo laringeo; l'epiglottide è rosso ciliegia.
Terapia: immediata ospedalizzazione con intubazione naso-tracheale, somministrazione e.v di ampicillina o meglio ceftriaxone.
Complicanze: polmonite e artrite settica; molto rara la meningite.
Otite media acuta
Epidemiologia: L'otite media acuta colpisce a seconda degli studi eseguiti in diverse aree geografiche dal 17% al 32% dei bambini per anno; nel primo anno di vita l'incidenza va dal 21% al 62%, questa percentuale sale al 50% circa se si considerano i primi tre anni di vita, ed addirittura al 75% se si considerano i primi 10 anni di vita.
I maschi sono più colpiti delle femmine e la ricorrenza è molto frequente (il 17-30% dei bambini ha avuto almeno 2 episodi).
Si nota comunemente che l'OM tende a ricorrere nella stessa famiglia; è stata suggerita una componente ereditaria.
L'allattamento al seno ha un ruolo protettivo nei confronti dell'OM.
L'OM, oltre a essere ubiquitaria tra i bambini con palatoschisi non corretta, presenta una notevole incidenza tra i bambini con palatoschisi sottomucosa, altre anomalie cranio facciali e sindrome di Down. La caratteristica comune a queste patologie è un deficit funzionale della tuba di Eustachio.
Eziologia: I batteri responsabili delle più comuni forme di otiti acute sono:
streptococcus pneumoniae (20%-40%);
haemophilus influenzae (10%-30%);
Maraxella catarrhalis (5%-15%);
Altro (10%)
In alcuni casi può anche succedere di non isolare nessun germe; inoltre queste percentuali possono subire variazioni geografiche, per esempio in Italia il 10% delle otiti è sostenuta da streptococcus pyogenes. In alcuni casi è possibile riscontrare la presenza di virus respiratori, da soli o in associazione a batteri. I più frequenti sono rhinovirus e il virus respiratorio sinciziale.
Patogenesi: In circostanze normali, la tuba di Eustachio è passivamente chiusa e si apre per la contrazione del muscolo tensore del velo palatino. In relazione all'orecchio medio, essa ha tre funzioni principali: ventilazione, protezione e clearance. La più importante è la ventilazione. La mucosa dell'orecchio medio necessita di un continuo flusso d'aria dal rinofaringe attraverso la tuba di Eustachio. L'interruzione di questo processo di ventilazione a causa di un'ostruzione della tuba scatena una complessa risposta infiammatoria, che comprende metaplasia secretoria, compromissione del sistema di trasporto muco ciliare ed effusione di liquido dalla cavità timpanica. L'alterazione della ventilazione dell'orecchio medio è un fattore importante che contribuisce all'OM.
L'ostruzione della tuba può dipendere da fenomeni extraluminali, da edema infiammatorio della mucosa della tuba, o da entrambi i fattori.
Nella patogenesi dell'OM può essere coinvolta ance la funzione di protezione e clearance della tuba. Pertanto se le tube sono pervie o eccessivamente complianti, viene a mancare la funzione di protezione dell'orecchio medio da reflusso di secrezioni infette rinofaringee, mentre un'alterazione della funzione di clearance mucociliare può contribuire all'infezione e alla sua persistenza.
Complicanze: L'otite media acuta non va sottovalutata per la gravità di alcune complicanze che possono svilupparsi, in particolare vi può essere:
la perforazione della membrana timpanica che oltre ad alterazioni uditive (ipoacusia permanente) predispone verso la cronicizzazione dell'otite (i batteri oltre che dal faringe giungono al timpano anche dall'orecchio esterno);
La mastoidite (posizione anatomica);
La meningite (posizione anatomica).
Diagnosi: Sintomi e Segni:
dolore auricolare e ipoacusia;
febbre e malessere generale;
infiammazione e versamento essudativo della cavità timpanica;
alterazione della membrana timpanica;
otorrea (secrezione di liquido dal condotto uditivo esterno).
Tra i vari sintomi e segni dell'otite media acuta sicuramente il dolore auricolare è quello più frequente (83%) e specifico, quindi se presente è fortemente indicativo. Gli altri sintomi e segni (irritabilità, tosse, rinite, febbre, vomito, diarrea, ecc..) sono poco specifici in quanto comuni all'otite media acuta e alle altre infezioni delle vie aeree superiori.
Per fare diagnosi risulta molto utile l'otoscopia, esame realizzato al fine di visualizzare la membrana timpanica e il canale uditivo esterno attraverso uno strumento ottico specifico chiamato otoscopio.
I quadri che si possono osservare sono:
membrana timpanica arrossata (bassa specificità e sensibilità);
membrana timpanica opaca (specificità e sensibilità media, in quanto può essere presente anche come esito di precedenti otiti e quindi non essere correlata al quadro clinico del momento);
membrana timpanica estroflessa.
In caso di sintomatologia lieve e/o poco chiara è utile un atteggiamento di tipo attendista in collaborazione con la madre del bambino.
Terapia: L'indicazione alla terapia è stato ed è ancora argomento di discussione data la frequente eziologia virale dell'OMA e dato che anche le forme batteriche si istaurano spesso su una mucosa precedentemente alterata dalla colonizzazione virale.
Secondo alcuni studi circa l'80% delle otiti medie acute si risolvono in 3 giorni senza la terapia, e l'uso di antibiotici non solo determina l'insorgenza di effetti collaterali ma aumenta anche il rischio di antibiotico resistenza. Uno studio recente ha però dimostrato che il trattamento antibiotico riduce ad 1/17 la persistenza del dolore dopo la fase acuta, rapporto che sale a 16/17 nei bambini non trattati. Altro beneficio della terapia antibiotica è la riduzione dell'incidenza di OMA controlaterale.
Considerato tutto ciò le linee guida consigliano il trattamento, che consiste in:
Amoxicillina (50 ng/kg/die per 5-10 giorni);
Amoxicillina + acido clavulanico (microrganismi che posseggono β lattamasi, quali H. influenzae non tipizzabile e la maggior parte dei ceppi di M. catarrhalis);
Ceftriaxone (50 mg/Kg monodose).
La terapia topica non si è dimostrata utile mentre l'uso di analgesici, in particolare il paracetamolo è utile per ridurre l'otalgia.
Quando il dolore persiste e il versamento essudativo non accenna a diminuire nonostante la terapia antibiotica è indicato il trattamento chirurgico che consiste nell'effettuare una piccola incisura della membrana timpanica (miringotomia) e nell'istallare un tubo di drenaggio.
La durata del trattamento è stata determinata in 10 giorni, apparentemente estrapolato sulla durata ottimale del trattamento pennicillinico della faringotonsillite streptococcica. Tuttavia, 10 giorni possono essere troppi per alcuni bambini e pochi per altri. Alcuni studi suggeriscono che le terapie di breve durata sono inadeguate in bambini di età inferiore a 6 anni, in particolare se hanno meno di 2 anni. Il trattamento per periodi più brevi (3-5 giorni) può essere indicato per bambini più grandi.
Bronchiolite
La bronchiolite è una malattia infettiva acuta clinicamente molto impegnativa ad eziologia prevalentemente virale caratterizzata da un ostruzione infiammatoria generalizzata delle ultime diramazioni bronchiali, i bronchioli.
La patologia colpisce in particolare nel periodo invernale i bambini sotto il primo anno di età, i neonati più a rischio sono i prematuri e i denutriti per la debolezza del sistema immunitario; è più comune nei maschi, nei bambini non allattati e in quelli che vivono in condizioni di affollamento; i bambini più grandi e gli adulti della famiglia sono una comune fonte di infezione e possono accusare solo lievi sintomi respiratori.
Eziopatogenesi: I lattanti sono particolarmente inclini a sviluppare sibili a causa dei meccanismi di tipo diverso, rispetto ai bambini più grandi e agli adulti. L'ostruzione al flusso è influenzata dal calibro delle vie aeree e dalla compliance del polmone. La resistenza al flusso aereo attraverso un tubo è inversamente proporzionale al raggio del tubo alla quarta potenza. Nei bambini di età inferiore ai 5 anni il piccolo calibro delle vie aeree periferiche può contribuire fino al 50% della resistenza totale al flusso aereo. Un restringimento ulteriore anche lieve, può limitare ancora di più il flusso determinando l'insorgenza di sibili. Tale condizione si verifica nella bronchiolite acuta per la presenza di edema, muco e detriti cellulari, che causano ispessimento della parete bronchiolare.
La resistenza nei piccoli passaggi aerei aumenta sia durante l'inspirazione sia durante l'espirazione ma, dal momento che il raggio delle vie aeree è minore durante l'espirazione, la risultante ostruzione respiratoria porta a intrappolamento d'aria e iperinflazione. Se l'ostruzione diviene completa vi è il riassorbimento dell'aria intrappolata distalmente e il bambino sviluppa atelettasia.
L'ipossiemia è una conseguenza dell'alterazione del rapporto ventilazione-perfusione che avviene precocemente nel decorso clinico. Con la malattia ostruttiva più grave e l'esaurimento dello sforzo respiratorio, si può sviluppare ipercapnia.
Non tutti i lattanti colpiti dall'infezione sviluppano la malattia conclamata. Sembra che fattori anatomici e immunologici legati all'ospite giochino un ruolo significativo nella gravità della sindrome clinica. I lattanti che di base presentano vie aeree più piccole e una ridotta funzione polmonare hanno un decorso più severo. Inoltre, l'infezione da RSV stimola una risposta immunitaria complessa. Gli eosinofili degranulano e rilasciano la proteina cationica eosinofila, che svolge un'azione citotossica sull'epitelio delle vie aeree. Anche il rilascio di IgE può essere correlato al'insorgenza di sibili. Altri mediatori coinvolti nella patogenesi dell'infiammazione delle vie aeree comprendono chemochine come l'IL-8, la proteina infiammatoria dei macrofagi (MIP1α), e il RANTES (Regulated on Activation, Normal T cell Expressed and Secreted), regolato all'attivazione, espresso e secreto dai linfociti T normali.
Eziologia
Virus respiratorio sinciziale (più del 50% dei casi);
Virus parainfluenzali tipo 1-3;
Adenovirus;
Altri virus.
Diagnosi: Sintomi e segni:
febbre e malessere generale;
anoressia e vomito;
tosse stizzosa;
problemi respiratori (tachipnea, dispnea espiratoria, sibili);
aumento della Fc.
Si distinguono forme lievi, che hanno decorso benigno e si risolvono entro 7 giorni, e forme gravi, il quadro clinico peggiora in pochi giorni e si può anche avere l'exitus per insufficienza respiratoria, scompenso cardiaco o sovrainfezioni.
Il lattante sviluppa dapprima un'infezione lieve delle vie respiratorie superiori, con starnuti e rinorrea limpida. Questi sintomi possono accompagnarsi a diminuzione dell'appetito e febbre di 38,5-39°, sebbene la temperatura possa essere da più bassa del normale a molto elevata. Gradualmente si sviluppa distress respiratorio con tosse sibilante parossistica, dispnea e irritabilità. Il paziente è spesso tachipnoico e in genere non presenta altri sintomi sistemici, come diarrea o vomito.
Il reperto più evidente all'esame obiettivo è il sibilo. Un sibilo (wheezing) è un suono musicale e continuo che origina da oscillazioni in vie aeree ristrette. I sibili sono udibili prevalentemente in espirazione per effetto di un'ostruzione critica delle vie aeree. Essi sono polifonici quando vi è un restringimento diffuso delle vie aeree (es. asma), che causa vari toni o livelli di ostruzione al flusso aereo. Sono invece definiti monofonici quando hanno un solo tono e si producono nelle vie aeree di calibro maggiore durante l'espirazione (tracheomalacia distale o bronco malacia). Quando l'ostruzione si verifica a livello delle vie aeree extratoracica durante l'inspirazione il suono è detto "stridore".
La diagnosi è quasi esclusivamente clinica e radiologica visto la poca utilità della diagnostica di laboratorio, infatti il test colturale dell'espettorato profondo è difficilmente ottenibile e il tempo necessario per eseguirlo è troppo lungo vista la gravità della malattia e il rapido peggioramento delle condizioni generali.
Esistono dei test rapidi, disponibili però in USA e non in Italia.
L'RX nei casi di bronchiolite mostra:
Aree di iperdiafania alternate ad aree di addensamento;
Atelettasie;
Ingrandimento degli ili, rinforzo della trama bronchiale basale con aspetto reticolare o reticolo-nodulare.
La valutazione del livello di gravita del distress respiratorio viene fatta tenendo in considerazione il numero e l'ampiezza dei rientramenti respiratori a livello sopraclaveare, intercostale e sub-costali che vengono tramutati in un punteggio complessivo.
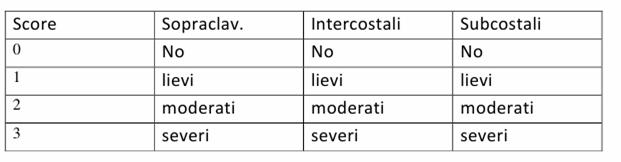
Figura : score di valutazione dei rientramenti respiratori.
Terapia farmacologica
Broncodilatatori: β2 adrenergici (salbutamolo), α e β Adrenergici (adrenalina);
Anticolinergici (ipatroprio bromuro): riducono il numero di rientramenti ma non vi sono evidenze a favore di una riduzione della durata del ricovero e di un miglioramento della saturazione dell'ossigeno. Effetti collaterali: tosse, aumento parametri cardiaci, tachicardia, aumento PA, tremori, ipereccitabilità;
Corticosteroidi: per uso sistemico migliorano la saturazione dell'ossigeno e i sintomi respiratori; Per aerosol: non vi sono evidenze di miglioramenti ma si continua a darli. Effetti collaterali: riassorbimento osseo, immunosoppressione e iperglicemia;
Antibiotici: nella bronchiolite non sono utili essendo l'eziologia virale, tuttavia in ambiente ospedaliero vengono somministrati per vari motivi, ad esempio per evitare una possibile sovrainfezione batterica o anche perché spesso è difficile distinguere tra una bronchiolite ed una vera e propria bronco-polmonite;
Antivirali (Ribavirina per aerosol): non c'è nessuna evidenza di efficacia;
Anticorpi monoclonali PALIVIZUMAB (anti-RSV): In lattanti ad alto rischio (prematuri, patologia cronica respiratoria, cardiopatici). Somministrazione mensile per 4-5 mesi nel periodo invernale 4.9% di riduzione del rischio assoluto di BV, cioè 1:20 lattanti beneficia del trattamento. Il costo è però elevato.
Prevenzione: Usare la mascherina facciale e lavarsi le mani.
Raccomandazioni nella bronchiolite (linee guida):
Ossigeno terapia se saturazione <91% (cannula o maschera);
Idratazione: la febbre e l'elevato utilizzo dei muscoli respiratori disidratano il bambino;
Aspirazione frequente per assicurare pervietà delle vie aeree;
Detersione delle vie respiratorie superiori: soluzioni saline nasali;
Monitoraggio della saturazione O2, della frequenza respiratoria e dei parametri infiammatori.
Le polmoniti di comunità (CAP)
La polmonite è un'infiammazione del parenchima polmonare. Sebbene la maggior parte dei casi sia imputabile a microrganismi, le causa non infettive comprendono l'aspirazione di cibo o acido gastrico, di corpi estranei, idrocarburi e sostanze lipidiche, le reazioni da ipersensibilità, l'assunzione di determinati farmaci o l'esposizione alle radiazioni.
Eziologia ed epidemiologia: Nel 20-60% dei casi l'agente non è identificabile. S. pneumoniae è l'agente batterico più comune delle CAP (1/3). I virus sono responsabili del 14-35% delle polmoniti. Nell'8-40% dei casi l'infezione è di tipo misto.
La coltura diretta di tessuto polmonare è una tecnica invasiva, praticata raramente. Le colture effettuate sull'escreato, ossia sui campioni ottenuti dalle vie aeree superiori, generalmente non riflettono accuratamente la causa dell'infezione delle vie respiratorie inferiori.
![]()
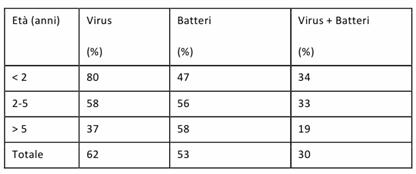 L'età è il migliore predittore dell'agente eziologico:
L'età è il migliore predittore dell'agente eziologico:
I virus sono una causa molto comune nei bambini piccoli (lattanti ed età <5 anni): i patogeni maggiormente coinvolti sono il virus respiratorio sinciziale e il virus dell'influenza, a cui seguono i virus parainfluenzali, gli adenovirus e i rinovirus;
Nei bambini grandi, quando è presente una eziologia batterica, l'agente più comune è lo S. pneumoniae seguito da Mycoplasma e Clamydia.
Patogenesi: Di norma il tratto respiratorio inferiore è mantenuto sterile dai meccanismi di difesa fisiologici, che comprendono la clearance muco ciliare, le proprietà delle secrezioni normale come le IgA e la pulizia delle vie aeree da parte della tosse. I meccanismi di difesa immunologici del polmone che limitano l'invasione da parte di microrganismi patogeni comprendono i macrofagi, presenti negli alveoli e nei bronchioli, le IgA secretorie e altre immunoglobuline.
La polmonite virale di solito fa seguito alla diffusione dell'infezione lungo le vie aeree, accompagnata dal danno diretto dell'epitelio respiratorio, che porta all'ostruzione delle vie aeree da edema, secrezioni anomale e detriti cellulari. Il piccolo calibro delle vie aeree rende i bambini particolarmente suscettibili alle infezioni gravi nei primi mesi di vita. Spesso l'ostruzione delle vie aeree si associa ad atelettasia, edema interstiziale e alterazione del rapporto ventilazione-perfusione, con ipossiemia severa. L'infezione virale delle vie respiratorie può inoltre predisporre a un'infezione batterica secondaria, alterando i normali meccanismi di difesa dell'organismo, le secrezioni e la flora batterica.
Manifestazioni cliniche: L'esordio della polmonite batterica, negli adulti e nei bambini più grandi, è tipicamente improvviso, con brividi scuotenti seguiti da febbre elevata, tosse e dolore toracico. Nei bambini più grandi e negli adolescenti, un'affezione delle vie aeree superiori di breve durata è seguita dall'esordio improvviso di brividi scuotenti e febbre accompagnata da sonnolenza, con periodi intermittenti di irrequietezza, respiro rapido, tosse secca, stizzosa, non produttiva, ansia e, occasionalmente, delirio.
I reperti dell'esame obiettivo dipendono dallo stadio della polmonite, nelle fasi precoci della malattia, sono comunemente udibili sul campo polmonare affetto una riduzione del murmure vescicolare, crepitii sparsi e ronchi. Con il progressivo consolidamento o l'insorgenza di complicanze della polmonite, come versamenti, empiema o piopneumotorace, si percepisce ottusità alla percussione, e il murmure vescicolare può essere diminuito.
Nei lattanti vi possono essere un'infezione prodromica delle vie aeree superiori e una riduzione dell'appetito, cui fa seguito la comparsa improvvisa di febbre, irrequietezza, ansia e distress respiratorio. I risultati dell'esame obiettivo possono essere fuorvianti, in particolare nei lattanti di pochi mesi, con reperti minimi rispetto alla tachipnea. Alcuni lattanti possono presentare sintomi gastrointestinali associati.
![]()
 Diagnosi: La presenza di più di uno dei principali segni e sintomi
di distress respiratorio suggerisce una diagnosi di polmonite:
Diagnosi: La presenza di più di uno dei principali segni e sintomi
di distress respiratorio suggerisce una diagnosi di polmonite:
Tachipnea (fondamentale indicatore di polmonite);
Tosse, dispnea con retrazioni toraciche ed al giugulo;
alitamento delle pinne nasali.
Il valore predittivo è maggiore se il bambino è febbrile e cianotico.
Diagnosi di laboratorio: L'emocoltura viene eseguita se si sospetta un infezione ad eziologia batterica, se invece è presente versamento pleurico si può eseguire la toracentesi.
La ricerca di anticorpi o antigeni per lo pneumococco non è sensibile, mentre in caso di infezione da patogeni respiratori atipici IgM ed IgG per Mycoplasma e Clamydia sono spesso più utili per una diagnosi retrospettiva. Le Agglutinine a freddo presentano un valore predittivo positivo del 70%.
Rx torace: È uno scarso indicatore eziologico. Non deve essere eseguita routinariamente in bambini con lieve e non complicata infezione del tratto respiratorio inferiore. Deve essere eseguito in follow-up soltanto in caso di collasso lobare, focolaio "tondeggiante", se persiste la sintomatologia.
La conta leucocitaria periferica può essere utile per distinguere la polmonite batterica da quella virale. Nella forma virale i leucociti possono essere normali o elevati (di solito non superiori a 20000/mm3), con una predominanza linfocitaria. La forma batterica (occasionalmente la polmonite da Adenovirus) si associa spesso a leucocitosi nel range di 15000-40000/mm3 con predominanza dei granulociti.
Necessità di ricovero
Bambini piccoli;
SaO2< 92%;
FR >70/min nei piccoli, > 50/min nei grandi;
Severo distress respiratorio/apnea;
Intake calorico ridotto;
Segni di disidratazione;
Familiari non idonei ad apportare le cure appropriate.
Terapia: Le decisioni terapeutiche sono basate per lo più sull'età del bambino e sui dati clinici ed epidemiologici. La terapia antibiotica dovrebbe essere immediatamente instaurata nel sospetto di infezione batterica. Poiché l'informazione esatta circa il microrganismo causale è spesso sconosciuta la scelta dell'antibiotico è generalmente empirica.

Figura : Schemi terapeutici.
Se si sospetta una polmonite batterica vanno somministrati cefuroxima, cefotaxima o ceftriaxone. Se si ipotizza una forma stafilococcica, la terapia iniziale deve comprendere anche la vancomicina o la clindamicina. Nel caso di manifestazioni cliniche che facciano protendere verso un'eziologia virale, è ragionevole evitare la terapia antibiotica.
Complicanze: Le complicanze della polmonite in genere sono la conseguenza della diffusione diretta dell'infezione batterica nella cavità toracica (versamento pleurico, empiema, pericardite) o di una batteriemia con diffusione ematogena. La meningite, l'artrite suppurativa e l'osteomielite sono complicanze rare della diffusione ematogena dell'infezione da pneumococco e da H. influenzae di tipo b.
Pleurite
Processo infiammatorio della pleura che può essere primitivo (raro) o secondario a processi infiammatori contigui. Si può associare o meno a versamento; si ricordi però che non solo le affezioni primarie della pleura possono portare ad accumulo di liquido nel cavo: le principali cause non infettive di versamento nell'infanzia sono tumori e leucemie, sd nefrosica, scompenso cardiaco congestizio, uremia, traumi, chilotorace, malattie del collagene.
Si ricordi che i versamenti da affezioni infiammatorie locali sono essudati, quindi hanno un alto contenuto in proteine e spesso anche in leucociti, mentre i versamenti da alterazioni dell'equilibrio idrostatico od oncotico sono trasudati.
Pleurite secca
Quasi sempre secondaria a broncopolmonite (da pneumococco, micoplasma), malattia reumatica, tbc o flogosi delle alte vie.
Clinica: dolore toracico accentuato dalla respirazione profonda che può essere riferito all'addome o al collo. La clinica è comunque predominata dal processo di base. All'ascoltazione sono presenti sfregamenti che non si modificano con la tosse. Il pz decombe sul lato sano.
Pleurite essudativa
Versamento siero-fibrinoso; fa pensare alla tbc, anche se può avere le stesse cause della precedente o anche essere neoplastica.
Clinica: inizia come la precedente ma all'aumentare del versamento il dolore si attenua e la dispnea si fa più evidente. Il pz decombe sul lato malato; FVT ridotto o abolito, ipofonesi, MV abolito.
Diagnosi: all'Rx opacità che segue nel limite superiore la linea di Damoiseau-Ellis (rachide angolo della scapola sterno).
Terapia: della malattia primitiva, eventualmente toracentesi evacuativa.
Pleurite purulenta o empiema
Sovrinfezione di un versamento siero-fibrinoso, per diffusione dei germi dal processo infettivo polmonare. I batteri più frequentemente causa del quadro sono streptococchi, stafilococchi e HIB.
Clinica: aumenta la febbre, aggravamento dei sintomi e dispnea, cianosi e tosse.
Terapia: antibiotici sulla base dell'antibiogramma, drenaggio pleurico, lisi delle aderenze.
Sinusite
La sinusite è una malattia comune nell'infanzia e nell'adolescenza, caratterizzata da una significativa morbilità acuta e cronica oltre che da complicanze potenzialmente gravi. Esistono due tipi di sinusite acuta: virale e batterica. Il raffreddore comune provoca una rinosinusite virale autolimitante. Circa lo 0.5-2% delle infezioni virali delle vie superiori, nei bambini e negli adolescenti, si complica con una sinusite acuta batterica.
Eziologia: I batteri patogeni che causano sinusite acuta comprendono Streptococcus Pneumoniae (circa 30%), Haemophilus influenzae non tipizzabile (circa 20%) e Maraxella catarrhalis (circa 20%).
Epidemiologia: La sinusite batterica acuta può insorgere a qualunque età. Le condizioni predisponenti comprendono le infezioni virali delle vie respiratorie superiori, la rinite allergica o l'esposizione al fumo di sigaretta. I bambini con carenza del sistema immunitario, relative in particolare alla produzione di anticorpi (IgG, sottoclassi di IgG e IgA), fibrosi cistica e disfunzione ciliare, anomalie della funzione fagocitiga, reflusso gastroesofageo, difetti anatomici (palatoschisi), polipi nasali e corpi estranei nasali (compresi i sondini naso gastrici) possono sviluppare una malattia cronica dei seni.
Patogenesi: La sinusite batterica acuta tipicamente insorge in seguito a un'infezione virale delle vie respiratorie superiori, che inizialmente provoca una rinosinusite virale.
Di norma i batteri del rinofaringe che entrano nei seni vengono eliminati rapidamente ma durante una rinosinusite virale l'infiammazione e l'edema possono bloccare il drenaggio dei seni e alterare la clearance muco ciliare dei batteri: si vengono così a creare condizioni favorevoli alla proliferazione batterica.
Manifestazioni cliniche: I bambini e gli adolescenti con sinusite possono presentare disturbi aspecifici tra cui congestione nasale, secrezioni nasali purulente (mono o bilaterali), febbre e tosse. L'esame obiettivo può rivelare eritema ed edema della mucosa nasale, con secrezione purulente.
Diagnosi: La diagnosi clinica della sinusite batterica acuta si basa unicamente sull'anamnesi. Sintomi persistenti di infezione delle vie aeree superiori, tra cui la presenza di secrezioni nasali e tosse per più di 10-14 giorni senza miglioramento, o sintomi respiratori severi, tra cui una temperatura di almeno 39° e secrezioni nasali purulente per più di 3-4 giorni consecutivi, sono suggestivi della sinusite batterica acuta, insorta come complicanza.
La coltura dell'aspirato è l'unico metodo accurato per la diagnosi; non è di uso comune nei pazienti immunocompetenti, in quanto poco pratico, ma può rendersi necessario nei pazienti immunosoppressi con sospetta sinusite fungina. Negli adulti l'endoscopia nasale con strumento rigido è una metodica meno invasiva che permette di prelevare dai seni materiale per l'esame colturale, ma che rispetto all'aspirato rileva un eccesso di colture positive. Con la trans illuminazione delle cavità sinusali è possibile rilevare la presenza di liquido, ma non stabilire se sia di origine batterica o virale. Nei bambini è difficile da effettuare e inaffidabile.
Trattamento: Da uno studio randomizzato è emerso che la terapia antimicrobica non incideva sulla risoluzione dei sintomi, sulla durata o sul numero di giorni di assenza scolastica. Viene tuttavia prescritta una terapia antibiotica. La terapia iniziale con amoxicillina è adeguata per la maggior parte dei bambini con sinusite batterica acuta non complicata. I trattamenti alternativi, per i pazienti allergici alle pennecilline, comprendono il trimetoprim-sulfametoxazolo, la cefuroxima, la claritromicina e l'azitromicina.
Complicanze: A causa della stretta prossimità dei seni paranasali col cervello e con gli occhi, da una sinusite acuta batterica possono svilupparsi e progredire rapidamente gravi complicanze a livello orbitario o endocranico.
Le complicanze a carico dell'orbita sono per lo più secondarie all'etmoidite batterica acuta e sono rappresentata dalla cellulite periorbitaria e la cellulite orbitaria.
Le complicanze intracraniche possono comprendere ascessi epidurali, meningiti, trombosi del seno cavernoso, empiema subdurale e ascesso cerebrale.
Bronchite acuta
Manifestazioni cliniche: La bronchite acuta è spesso preceduta da un'infezione virale delle vie aeree superiori. È più comune in inverno, quando prevalgono le sindromi respiratorie virali. L'epitelio tracheobronchiale è invaso dall'agente infettivo che porta all'attivazione delle cellule infiammatorie e al rilascio di citochine. Insorgono quindi i sintomi sistemici, come febbre e malessere. L'epitelio tracheobronchiale può essere significativamente danneggiato o ipersensibilizzato, portando a una tosse protratta che dura 1-3 settimana. Il bambino si presenta la prima volta con sintomi aspecifici di infezione delle vie respiratorie superiori, come la rinite. Dopo 3 o 4 giorni, si sviluppa una tosse frequente, secca, stizzosa, che può essere o meno produttiva. Dopo qualche giorno l'escreato diviene purulento, reperto indicativo della migrazione dei leucociti ma non necessariamente di un'infezione batterica.
Trattamento: Non esiste una terapia specifica per la bronchite acuta. La malattia è autolimitante e gli antibiotici, sebbene siano prescritti frequentemente, non accelerano la guarigione.
Bronchite cronica
Non è chiaro fino a che punto la definizione applicata per gli adulti sia applicabile anche per i bambini. L'esistenza della bronchite cronica come entità distinta, nei pazienti pediatrici, è controversa. Come gli adulti, i bambini con malattie infiammatorie croniche, o quelli con esposizione a sostanze tossiche, possono sviluppare un danno all'epitelio polmonare. Pertanto la tosse cronica o ricorrente deve spingere il pediatra a ricercare una sottostante malattia polmonare o sistematica.
Tubercolosi
Malattia infettiva causata dal Mycobacterium Tuberculosis o dal Mycobacterium Bovis.
Epidemiologia: Il numero di casi di tubercolosi è diminuito stabilmente negli USA nella prima metà del XX secolo, molto prima dell'avvento dei farmaci antitubercolari, in seguito al miglioramento delle condizione di vita. Una ripresa della tubercolosi nei tardi anni 80 è stata associata primariamente all'epidemia di HIV. Allo stato attuale il 95% dei casi si verifica nei Paesi in via di sviluppo, in cui l'epidemia da HIV/AIDS ha avuto il maggiore impatto e spesso non sono disponibili risorse per una corretta identificazione ed un corretto trattamento di queste malattie. In molti Paesi industrializzati la maggior parte dei casi di tubercolosi si verifica in popolazioni di origine straniera.
Fattori responsabili dell'incremento dei casi di TBC sono:
Immigrazione:
HIV;
Smantellamento della rete di sorveglianza/multiresistenza;
Aumento della povertà;
Instabilità sociale;
Sovraffollamento dei Paesi in via di sviluppo;
Scarso accesso ai servizi sanitari.
La trasmissione del M. Tubercolosis avviene da persona a persona, di solito mediante goccioline aeree dimuco, particelle di 1-5 micron di diametro che contengono il micobatterio. Molti adulti non trasmettono più il microrganismo da diversi giorni a 2 settimane dopo l'inizio di una chemioterapia adeguata, ma alcuni pazienti rimangono infettivi per molte settimane. I bambini più piccoli con tubercolosi raramente infettano altri bambini o gli adulti. I bacilli tubercolari sono rari nelle secrezioni endobronchiali di bambini con tubercolosi polmonare e la tosse spesso è assente o manca dell'intensità necessaria per sospendere particelle infettive delle dimensioni corrette. Tuttavia i bambini e gli adolescenti con tubercolosi polmonare endobronchiale o cavitaria di tipo adulto possono trasmettere il microrganismo.
Il M. bovis può penetrare nella mucosa intestinale o invadere il tessuto linfatico dell'orofaringe quando viene ingerito un grande numero di microrganismi.
Eziologia: La maggior parte dei casi di tubercolosi è causata da M. tubercolosis, anche conosciuto come bacillo di Koch.
I bacilli tubercolari sono bacili debolmente ricurvi, gram +, pleomorfi, non mobili e non formanti spore. Nei campioni clinici o nei terreni di coltura sottoposti a colorazione, essi possono apparire raggruppati a "filo di perle" o in piccoli ammassi. Essi sono aerobi obbligati che crescono nei terreni sintetici contenenti glicerolo come fonte di carbonio e sali azotati come fonte di azoto. Questi micobatteri crescono meglio a 37-41°, producono niacina e mancano di pigmentazione. Una parete cellulare ricca di lipidi è responsabile della resistenza all'azione battericida di anticorpi e complemento. Una caratteristica dei micobatteri è l'acido-resistenza.
I micobatteri crescono lentamente, il tempo di generazione è 12-24 ore. L'isolamento da campioni clinici su terreni sintetici solidi richiede mediamente 3-6 settimane e l'esecuzione di un antibiogramma richiede altre 4 settimane. La crescita può essere identificata in 1-3 settimane in un terreno liquido selettivo per mezzo di sostanze nutritive radiomarcate (sistema radiometrico BACTEC) e la sensibilità agli antibiotici può essere determinata in altri 3-5 giorni.
![]()
 Una volta identificata la crescita batterica, le
specie di micobatteri presenti possono essere determinate entro alcune ore
utilizzando la cromatografia liquida ad alta pressione, in quanto ogni specie
possiede una configurazione unica di acidi micotici.
Una volta identificata la crescita batterica, le
specie di micobatteri presenti possono essere determinate entro alcune ore
utilizzando la cromatografia liquida ad alta pressione, in quanto ogni specie
possiede una configurazione unica di acidi micotici.
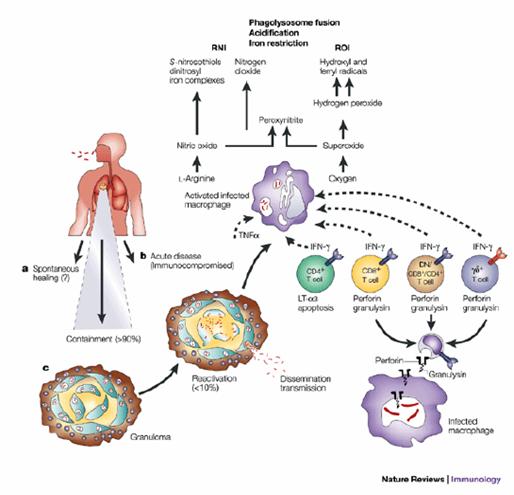
Patogenesi: Il bacillo di Koch viene inalato, entra nell'alveolo (più spesso nel segmento apicale anteriore del polmone di destra) e si moltiplica inizialmente all'interno degli alveoli e dei dotti alveolari. La maggior parte viene fagocitata e distrutta dai macrofagi alveolari, ma alcuni sopravvivono all'interno dei macrofagi non attivati, che non essendo quindi in grado di distruggerlo, subiscono l'infezione e la moltiplicazione del batterio al loro interno. Si ha quindi una disseminazione ematogena (responsabile a volte di una modesta sintomatologia clinica).
Durante questa fase si ha la formazione del compresso primario di Ghon, che rappresenta l'associazione di una lesione del parenchima polmonare e della sede linfonodale corrispondente. Il Micobatterio si localizza ai linfonodi ilari del polmone, ma a volte la diffusione per via ematogena, che si ha in questa fase, porta il M. a disseminarsi anche ad altri organi.
Entro due-tre settimane si organizza la risposta DTH per la presentazione del M ai TH1 da parte dei macrofagi, e quindi l'attivazione di essi. L'attività dei T porta a tre conseguenze, tutte convergenti verso la produzione di una reazione granulomatosa nei luoghi dove si è localizzato il bacillo di Koch:
Lisi dei macrofagi infetti da parte dei CD8+, con uccisione dei Micobatteri (necrosi caseosa);
Lisi dei macrofagi infetti da parte dei CD4- e dei CD8-, senza uccisione dei Micobatteri (necrosi caseosa);
Attivazione dei macrofagi da parte dei CD4+, con formazione del granuloma.
La formazione del granuloma quindi dipende:
Dalla componente immunitaria nella reazione di contorno (cellule epiteliodi e cellule giganti);
Per la formazione del nucleo di necrosi caseosa: Effetto citotossico sui macrofagi mediato da CD8+ e CD8- e CD4-; Effetto citotossico sui macrofagi mediato dallo stesso micobatterio; Effetto citotossico sui macrofagi mediato (forse) da sostanze prodotte dalle cellule epiteliodi.
Il granuloma rappresenta un ambiente acido, anaerobio, dove il Micobatterio non è in grado di crescere, e per questo motivo riesce a controllare l'infezione primaria. Inoltre la nuova capacità battericida acquisita dai macrofagi e dai CD8 permette spesso l'eradicazione dell'infezione completa.
La struttura del granuloma è un nucleo centrale di necrosi caseosa attorno al quale si organizza una reazione di cellule di Langhans giganti e di cellule epitelioidi. Fuori da granuloma ci sono scarsi linfociti T e B, e il tutto è circondato da una consistente reazione fibrosa.
Fase secondaria: Se il micobatterio si riattiva, o se si subisce una reinfezione, o in alcuni soggetti fin da subito, la malattia progredisce agli stadi successivi, con disseminazione del batterio ad altri organi ed evoluzione delle lesioni granulomatose in altre più gravi.
Classificazione TBC in età pediatrica
Esposto: bambino ad alto rischio di TBC: esposto ad adulti con TBC attiva e/o HIV; proveniente da aree a rischio; condizioni socio-economiche disagiate; immunodepressi o HIV positivi; malattie croniche;
Infetto: bambino con test alla tubercolina positivo senza segni o sintomi di malattia;
Malato: Bambino con test alla tubercolina positivo e segni radiologici e/o clinici di malattia.
Definizione di caso di TBC secondo l'OMS
CASO DEFINITO: Positività della coltura; Positività dello sputo;
CASO NON DEFINITO: Segni e/o sintomi clinico-radiologici compatibili; Trattamento anti-TBC.
Clinica: Storia Clinica e Sintomi Suggestivi:

Figura : Segni e sintomi della tubercolosi.
L'infezione primaria è rappresentata spesso da un complesso primario non sintomatico o sub-clinico. Durante gli episodi di tubercolosi primaria e tubercolosi post-primaria vi è la possibilità di un'estensione locale del complesso primario o di una diffusione per via emolinfatica di M. tuberculosis con nuove localizzazioni a livello polmonare ed extrapolmonare, epifenomeni per reazione immunomediata a livello della cute e delle mucose.
La tubercolosi post-primaria tardiva comprende i quadri clinici che si verificano per riaccensione di focolai polmonari ed extrapolmonari originatisi nelle fasi precedenti.
La tubercolosi disseminata e quella meningea sono manifestazioni precoci, che spesso si verificano entro 2-6 mesi dall'acquisizione. Una tubercolosi endobronchiale o linfonodale significativa di solito si manifesta entro 3-9 mesi. Le lesioni ossee e articolari necessitano di diversi anni per manifestarsi, mentre quelle renali possono divenire evidenti decenni dopo l'infezione. Dal 25 al 35% dei bambini con tubercolosi sviluppa manifestazioni extrapolmonari, rispetto al 10% circa degli adulti immunocompetenti.
Una tubercolosi polmonare e, in particolare, extrapolmonare, diversa dalla linfadenite, in una donna gravida è associata a un elevato rischio di parto prematuro, ritardo di crescita fetale, basso peso alla nascita e mortalità perinatale. La trasmissione congenita di solito si verifica a partire da una lesione placentare attraverso la vena ombelicale. I bacilli tubercolari raggiungono prima il fegato fetale, dove si può verificare un focolaio primario con interessamento dei linfonodi periportali. I microrganismi passano attraverso il fegato nella circolazione fetale principale e infettano diversi organi; nel polmone i bacili restano di solito quiescenti fino a dopo la nascita, quando l'ossigenazione e la circolazione polmonare aumentano in modo significativo.
Malattia polmonare primaria: I bambini possono presentare polmonite lobare senza marcata linfadenopatia ilare. Se l'infezione è progressivamente distruttiva, la liquefazione del parenchima polmonare conduce alla formazione di una cavità tubercolare primaria a pareti sottili. Raramente possono verificarsi nei polmoni lesioni tubercolari bollose e causare un pneumotorace in caso di rottura . L'erosione di un focolaio tubercolare parenchimale in un vaso sanguigno o linfatico può portare a disseminazione dei bacilli e a un pattern miliare con piccoli noduli distribuiti uniformemente alla radiografia toracica.
Più del 50% dei lattanti e dei bambini con aspetto radiografico di tubercolosi polmonare da moderato a severo non presenta segni clinici e viene individuato soltanto in seguito alla ricerca dei contatti. I lattanti hanno una maggiore probabilità di presentare segni e sintomi. Tosse non produttiva e lieve dispnea sono i sintomi più comuni; sono presenti meno spesso disturbi sistemici, come febbre, sudorazione notturne, anoressia e diminuzione dell'attività.
L'induzione dell'espettorato fornisce campioni sia per la coltura sia per la colorazione su striscio, mentre gli aspirati gastrici sono di solito messi in coltura.
Malattia polmonare progressiva: una complicanza rara ma seria della tubercolosi in un bambino si verifica quando il focolaio primario si ingrandisce stabilmente e sviluppa una grossa parte centrale caseosa; la liquefazione può causare la formazione di una cavità primaria associata a un grande numero di bacilli. Il focus in via di ingrandimento può rilasciare detriti necrotici nel bronco adiacente, portando a un'ulteriore disseminazione intrapolmonare. Segni o sintomi significativi sono frequenti nella malattia localmente progressiva del bambino; sono comuni febbre elevata, tosse severa con produzione di espettorato, calo ponderale e sudorazione notturna.
Versamento pleurico: i versamenti pleurici che possono essere localizzati o generalizzati, prendono origine dal passaggio di bacilli nello spazio pleurico da un focolaio polmonare sub pleurico o da un linfonodo caseoso.
Malattia pericardica: la forma più comune di tubercolosi cardiaca è la pericardite. È rara e si presenta nello 0.5-4% dei casi di tubercolosi nei bambini. La pericardite di solito prende origine dall'invasione diretta o dal drenaggio linfatico dai linfonodi sottosternali. I sintomi di presentazione sono non specifici e comprendono febbre di basso grado, malessere e calo ponderale. Il dolore toracico è insolito.
Malattia linfoematogena disseminata: i bacilli tubercolari si disseminano in sedi distanti, compreso fegato, milza, cute e apici polmonari, in tutti i casi di infezione tubercolare. Il quadro clinico prodotto dalla disseminazione linfoematogena dipende dalla quantità di microrganismi rilasciati dal focolaio primario e dall'adeguatezza della risposta immunitaria dell'ospite. La diffusione linfoematogena è di solito asintomatica.
E' comune l'interessamento di diversi organi con epatomegalia, splenomegalia, linfadenite dei linfonodi superficiali o profondi, e tuberculidi papulo-necrotiche a livello cutaneo. Possono essere interessati ossa e articolazioni, oppure i reni. Una meningite compare solo tardivamente nel corso della malattia.
La forma clinicamente più significativa di tubercolosi disseminata è la malattia miliare che si verifica quando grandi numeri di bacilli tubercolari vengono rilasciati in circolo causando la malattia in 2 o più organi. La tubercolosi miliare di solito complica l'infezione primaria, verificandosi entro 2-6 mesi dall'infezione iniziale.
Anche se questa forma di malattia è più comune nei lattanti e nei bambini più piccoli, si osserva anche negli adolescenti e negli adulti, derivando dal cedimento di una lesione tubercolare polmonare precedentemente guarita. Le manifestazioni cliniche sono proteiformi, a seconda del carico di microrganismi che disseminano e del sito in cui si arrestano. Le lesioni sono spesso più grandi e numerose nei polmoni, nella milza, nel fegato e nel midollo osseo. Dal momento che questa forma è più comune nei lattanti, nei malnutriti o immunosoppressi, l'incompetenza immunitaria dell'ospite probabilmente ha un ruolo nella patogenesi.
Malattia dei linfonodi: la tubercolosi dei linfonodi superficiali (scrofola) è la forma più comune di tubercolosi extrapolmonare nel bambino. Nelle prime fasi della malattia linfonodale i linfonodi di solito si ingrandiscono gradualmente; sono di consistenza aumentata ma non duri, separati e non dolenti. I linfonodi spesso sono aderenti ai tessuti sottostanti o sovrastanti. La malattia è più spesso unilaterale, ma si può avere un interessamento bilaterale a causa di pattern di drenaggio incrociati dei vasi linfatici a livello toracico e cervicale inferiore.
Qualora i linfonodi si ingrossino talmente tanto da causare ostruzione della trachea, ci troveremmo di fronte a quadri atelettasici per riassorbimento dell'aria intrappolata distalmente all'ostruzione.
Malattia del sistema nervoso centrale: la tubercolosi del sistema nervoso centrale è la complicanza più severa nel bambino ed è fatale senza un trattamento immediato ed appropriato; essa di solito prende origine dalla formazione di una lesione caseosa metastatica nella corteccia cerebrale o nelle meningi, che si sviluppa nel corso della disseminazione linfoematogena dell'infezione primaria. Tale lesione iniziale aumenta di volume ed elimina piccoli numeri di bacilli tubercolari nello spazio sub aracnoideo. Il risultante essudato gelatinoso infiltra i vasi sanguigni cortico-meningei, producendo infiammazione, ostruzione e successivo infarto della corteccia cerebrale. Il tronco dell'encefalo è spesso la sede del massimo interessamento. La meningite tubercolare complica lo 0.3% delle infezioni tubercolari non trattate nel bambino; è più comune tra i 6 mesi e i 4 anni di età. Occasionalmente si verifica molti anni dopo l'infezione, quando la rottura di uno o più tubercoli subependimali elimina i bacilli tubercolari nello spazio sub aracnoideo.
Malattia ossea e articolare: la malattia ossea e articolare interessa con maggiore probabilità le vertebre; la classica manifestazione della spondilite tubercolare è la progressione a morbo di Pott, in cui la distruzione dei corpi vertebrali causa deformità con gibbo e cifosi.
Malattia addominale e gastrointestinale: l'enterite tubercolare è causata dalla disseminazione ematogena o dalla deglutizione di bacilli provenienti dai polmoni stessi del paziente. Le sedi di interessamento più comuni sono digiuno e ileo, in prossimità delle placche di Peyer e dell'appendice. Gli aspetti tipici sono ulcere poco profonde che causano dolore, diarrea o stipsi e calo ponderale con febbre di basso grado.
Malattia genitourinaria: la tubercolosi renale è rara nei bambini in quanto il periodo di incubazione è di diversi anni o ancora più prolungato; i bacilli di solito raggiungono il rene durante la disseminazione ematogena. I microrganismi possono spesso essere ritrovati nelle urine in casi di tubercolosi miliare e in alcuni pazienti con tubercolosi polmonare, in assenza di interessamento del parenchima renale. Nella tubercolosi renale vera si sviluppano piccoli focolai caseosi nel parenchima renale che rilasciano il bacillo nei tubuli.
Diagnosi: Strategie per l'identificazione di soggetti infetti:
Intradermoreazione di Mantoux;
Tine test (sconsigliato; si associa ad una difficile interpretazione);
Case tracking;
Popolazioni a rischio o screening di massa;
T-SPOT.TB e Quanti-FERON-TB Gold: sono due test che identificano la formazione di interferone γ da parte delle cellule T del paziente in risposta ad antigeni specifici del M. tuberculosis.
Il Tine-test si effettua tramite l'inoculazione intradermica di una minima quantità di tubercolina al fine di saggiare la reattività dell'individuo alla tubercolosi. Il test viene effettuato mediante un dischetto di plastica con quattro punte ricoperte da tubercolina, che viene premuto per uno o due secondi sulla faccia palmare dell'avambraccio. Dopo 72 ore viene letta la reazione: questa viene considerata positiva quando si forma una papula rossa intorno ai puntini, indicando che il soggetto è già venuto in contatto con il micobatterio della tubercolosi, perché affetto o vaccinato o immunizzato per aver superato la malattia in maniera asintomatica.
Il tine-test non trova posto come test diagnostico perché:
la quantità di antigene non è precisa e la risposta non è standardizzata;
le risposte positive devono comunque essere seguite dalla Mantoux (per cui si perde tempo);
ha una maggior variabilità di sensibilità e specificità.
Indagini diagnostiche:
Mantoux;
Rx torace;
Colorazione e coltura per Micobatterio tubercolare su aspirato gastrico e/o faringeo e/o linfoadenectomia;
PCR per Micobatterio tubercolare (IS 6110).
Reazione di Mantoux: Indicazioni all'esecuzione IMMEDIATA della Mantoux:
Contatti con persone con infezione tubercolare sospetta o certa;
Bambini con segni radiografici e/o clinici suggestivi di TBC;
Bambini immigrati da paesi endemici;
Bambini con storia di viaggi in paesi endemici e/o contatti con persone provenienti da suddetti paesi.
Quando e a chi praticare la Mantoux:
Ogni anno in bambini con infezione da HIV o conviventi di pazienti con infezione da HIV;
Ogni 2-3 anni in bambini esposti alle seguenti categorie di persone: HIV positivi, vagabondi, soggetti istituzionalizzati, tossicodipendenti, detenuti;
All'età di 4-6 e 11-16 anni in bambini con parenti provenienti da aree ad alta prevalenza, bambini senza fattori di rischio specifico residenti in aree ad alta prevalenza.
Come si effettua:
Introduzione per via intradermica sulla superficie volare dell'avambraccio di 5UI di PPD;
Misurazione dell'infiltrato dopo 48-72 ore con il calibro di Vernier o mediante un semplice metro centimetrato.
Le cellule T sensibilizzate da una pregressa infezione sono reclutate nella cute dove rilasciano linfochine che inducono indurimento tramute vasodilatazione locale, edema, deposizione di fibrina e reclutamento di altre cellule infiammatorie nell'area.
Reazioni false negative si possono avere per fattori relativi all'ospite, quali un'età molto giovane, malnutrizione, immunosoppressione da parte di malattia o farmaci, infezioni virali (morbillo, parotite, varicella, influenza), la vaccinazione con virus vivi e una tubercolosi diffusa.
Reazioni false positive possono, invece, essere causate da una sensibilizzazione crociata ad antigeni di micobatteri non tubercolari che generalmente sono maggiormente prevalenti nell'ambiente man mano che ci si avvicina all'equatore; anche una pregressa vaccinazione con bacillo Calmette-Guerin (BCG) può causare una reazione al test cutaneo alla tubercolina.
BIOCINE TEST PPD 10UI: Per facilitare l'utilizzo di questa formulazione, garantendo una concentrazione di UI la più vicina a quella fino ad oggi utilizzata, si suggerisce di ricostituire il contenuto liofilo del flaconcino da 10 UI con l'intero contenuto (0.5 ml) della fiala solvente (soluzione salina tamponata). Così facendo da ogni flaconcino potranno essere ricavate 3 dosi: a scopo precauzionale le dosi non utilizzate nell'arco della giornata di preparazione dovranno essere eliminate.
BIOCINE TEST PPD 5UI: Si consiglia di ricostituire il contenuto liofilo del flaconcino da 5 UI con 0.3 ml della fiala solvente (soluzione salina tamponata), quindi non l'intero contenuto. Così facendo da ogni flaconcino potranno essere ricavate 2 dosi: a scopo precauzionale la dose non utilizzata nell'arco della giornata di preparazione dovrà essere eliminata.
La singola dose da utilizzare per l'esecuzione della intradermoreazione secondo Mantoux è costituita da 0.1 ml della soluzione così preparata, da prelevarsi mediante una siringa "senza spazio morto", specificatamente distribuita a questo scopo dalla farmacia.
La somministrazione va effettuata tramite iniezione intradermica sulla superficie volare dell'avambraccio (tra il terzo superiore e il terzo medio). Solo in situazioni particolari (ad es. chirurghi, strumentiste, ecc) è possibile usare come sede la superficie volare del braccio.
Effettuare antisepsi delle mani, come da procedura in uso. Indossare i DPI (guanti), previsti dalle precauzioni universali in uso. Informare il paziente della procedura e delle sue motivazioni.
Far assumere al paziente una posizione adeguata utilizzando, se necessario, una traversa o un telino per appoggiare l'arto. Praticare l'antisepsi della cute con un unico movimento procedendo dalla parte distale a quella prossimale (viceversa), utilizzando un batuffolo di garza o cotone (preferibilmente sterile) imbibito di antisettico, rispettando i tempi di contatto della soluzione utilizzata, come da procedure in uso. Non toccare la sede di inserzione dopo aver eseguito l'antisepsi. Eseguire l'intradermoreazione: tenere il becco di flauto dell'ago rivolto verso l'alto; tendere la cute ed inserire l'ago sotto la superficie epidermica; iniettare la soluzione; estrarre l'ago e tamponare leggermente. La presenza di un moderato e pallido sollevamento cutaneo (a buccia d'arancia) della dimensione di 6-10 mm di diametro conferma la corretta introduzione della soluzione nel derma.
Talora, in caso di sottocutaneo lasso, il pomfo può risultare molto evidente. Disegnare sulla cute un cerchio che circondi il sito di iniezione e che sia più largo del pomfo che potrebbe formarsi come reazione alla somministrazione.
Smaltire materiale usato negli appositi contenitori, attenzione a siringa e ago. Rimuovere i guanti. Eseguire lavaggio sociale delle mani. Registrare sul documento sanitario l'esecuzione della somministrazione, con data e ora.
Raccomandazioni:
Non detergere la sede del pomfo per almeno 1 ora;
L'area cutanea in cui è stata eseguita l'intradermoreazione non deve essere protetta con cerotto (eventuali reazioni allergiche possono interferire nella lettura del test; la rottura di un eventuale flittene può provocare sovrainfezione). In caso di modesta fuoriuscita di sangue tamponare delicatamente senza premere direttamente sul pomfo.
Il test deve essere letto 48-72 ore dopo l'iniezione. Trascorso tale periodo è possibile rilevare le reazioni positive fino ad una settimana dalla somministrazione del test. Nel caso in cui l'esito risulti negativo e siano trascorsi più di tre giorni dalla lettura, ripetere il test.
Deve essere misurato soltanto l'infiltrato, cioè la parte indurita percettibile al tatto ed evidenziabile con una penna a sfera. L'esito del test secondo Mantoux è rappresentato dal diametro del pomfo traverso alla direzione di inoculo.
Poiché al momento della lettura non si può essere sempre sicuri di tale direzione, si possono misurare due diametri traversi e fare la media. Dopo una breve e delicata palpazione della zona di inoculo la lettura va sempre eseguita con l'ausilio di una penna a sfera con cui si tracciano, con lieve pressione, dei segmenti di retta che partono molto esternamente verso i quattro poli della reazione (i quattro punti cardinali). La punta si arresta quando incontra l'infiltrato. Le distanze tra i quattro punti centrali dei segmenti così tracciati, misurabili con un pomfometro o con un normale righello, rappresentano i due diametri.
Le dimensioni dell'arrossamento non hanno alcuna rilevanza. Un test che presenta solo un eritema non è positivo. L'incrocio dei 2 segmenti tracciati, senza punti di arresto, indica l'assenza di infiltrato.
Il risultato di un test viene registrato in millimetri, e non deve essere valutato solo come positivo o negativo. Un test che non presenta una zona di indurimento viene registrato come 0 mm.

Figura : Interpretazione della Montoux in età pediatrica.
Reperti Radiografici
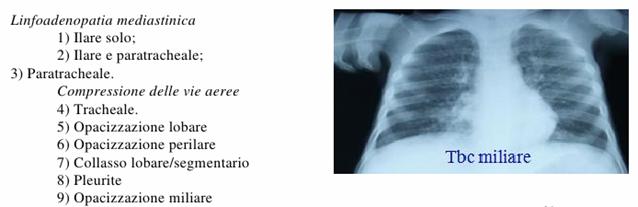
Figura : Reperti radiografici di TBC polmonare.
Su 109 reperti polmonari radiografici di bambini affetti da tubercolosi: circa la metà ha un'opacizzazione lobare, circa un terzo ha una linfoadenopatia ilare, un quinto ha linfadenopatia ilare e paratracheale, un quinto ha broncopolmonite, un sesto presenta compressione tracheale/bronchiale, un sesto collasso lobare e segmentario, circa il 10% ha air trapping, opacizzazione preilare, pleurite, Rx normale ed infine una minoranza: cavità, calcificazioni e opacizzazione miliare.
Nella maggior parte delle polmoniti tubercolotiche dei bambini, il lieve infiltrato parenchimale e la linfadenopatia si risolvono spontaneamente, la radiografia del torace rimane normale ed il bambino è asintomatico.
Il alcuni bambini, i linfonodi ilari e mediastinici rimangono di dimensioni ingrandite e sono visibili all'RX. Un'ostruzione parziale bronchiale causata dalla compressione esterna indotta dall'ingrandimento dei linfonodi, può causare intrappolamento d'aria, iperinflazione ed enfisema.
Non appena i linfonodi cominciano ad infiltrare la parete bronchiale, si ha un'ostruzione completa per l'interessamento del lume bronchiale. Ciò esita nell'atelettasia che solitamente interessa il segmento lobare distale alla porzione di lume ostruito. Le ombre radiografiche risultanti vengono denominale "consolidamenti da collasso" o "lesioni segmentali". Tali reperti sono simili a quelli che si ritrovano nell'aspirazione di un corpo estraneo (il linfonodo si comporta come se fosse il "corpo estraneo"). Lesioni segmentali multiple in lobi differenti possono essere presenti nel 25% dei bambini.
In alcuni pazienti è possibile rinvenire altri reperti. Occasionalmente, i bambini presentano un disegno di polmonite lobare senza un'imponente linfadenopatia. Se l'infezione è progressivamente distruttiva, la liquefazione del parenchima polmonare conduce alla formazione di una cavità tubercolare primaria a pareti sottili. Raramente possono verificarsi nei polmoni lesioni tubercolari bollose e causare un pneumotorace in caso di rottura.
L'erosione di un focolaio tubercolare parenchimale in un vaso sanguigno o linfatico può portare a disseminazione dei bacilli e ad un pattern miliare con piccoli noduli distribuiti uniformemente alla radiografia toracica. Un ingrossamento dei linfonodi sottocervicali può causare compressione dell'esofago e, raramente, una fistola bronco-esofagea. Un segno di tubercolosi sottocervicale è lo splaying orizzontale del bronco principale.
Aspirato Gastrico: Rappresenta il materiale biologico più appropriato per la diagnosi di TBC nel bambino (che non espettora).
Va effettuato, previo posizionamento di sondino nasogastrico: al mattino, a digiuno, prima che il paziente si alzi dal letto.

Figura : Valore diagnostico dell'aspirato gastrico.
Diagnosi Differenziale
Linfadenopatia;
infezione sistemica;
coxite;
infezioni asintomatiche;
asma bronchiale;
pneumopatia cronica;
linfadenite batterica;
linfoma.
Conclusioni: Il polimorfismo clinico in età pediatrica è maggiore rispetto a quello dell'adulto ed esistono peculiari problemi diagnostici. Il modello stocastico dell'approccio alla tubercolosi ha evidenti limiti nell'età pediatrica rispetto all'adulto.
L'applicazione diagnostica dell'indagine molecolare:
è utile per la conferma della diagnosi di TBC nel bambino immunocompetente;
è indispensabile per la diagnosi di TBC nel bambino immunodeficiente (Mantoux negativo);
consente di prendere rapidamente una decisione terapeutica.
Terapia
![]()
 Chemioprofilassi: Nei soggetti Mantoux-negativi
in stretto contatto con malati contagiosi somministriamo Isoniazide (10 mg/kg/die),
per 3 mesi dopo l'interruzione del contatto o dopo la negativizzazione del
soggetto con cui è avvenuto il contatto. A seguito di ciò andrà ripetuta la
reazione di Mantoux; se negativa si può sospendere la profilassi; se è positiva
la si continua per altri 6 mesi.
Chemioprofilassi: Nei soggetti Mantoux-negativi
in stretto contatto con malati contagiosi somministriamo Isoniazide (10 mg/kg/die),
per 3 mesi dopo l'interruzione del contatto o dopo la negativizzazione del
soggetto con cui è avvenuto il contatto. A seguito di ciò andrà ripetuta la
reazione di Mantoux; se negativa si può sospendere la profilassi; se è positiva
la si continua per altri 6 mesi.
Infezione latente nel bambino immunocompetente: Isoniazide (INI) per 9 mesi 1 volta/die oppure DOT (2 volte/settimana) e Rifampicina (RIF) (se resistenza all'INI) per mesi volta/die
Infezione latente nel bambino con infezione da HIV: INI o RIF per 12 mesi
Polmonare e/o linfonodale: Schema di 6 mesi: INI + RIF + Pirazinamide (PZA) ogni giorno per 2 mesi, cui seguono INI + RIF ogni giorno per 4 mesi oppure DOT;
Schema di 9 mesi (solo per linfoadenopatie ilari): INI + RIF ogni giorno per 9 mesi, oppure INI + RIF ogni giorno per 1 mese + INI e RIF 2 volte a settimana per 8 mesi.
In caso di resistenza, aggiungere etambutolo o streptomicina.
Tubercolosi extrapolmonare (meningite, miliare o ossea): INI + RIF + PZA + Streptomicina (STM) per 2 mesi, cui seguono INI + RIF per 7-10 mesi tutti i giorni oppure DOT (2 volte/settimana).
Criteri di isolamento: La maggior parte dei bambini con TBC non è contagiosa. L'isolamento per via aerea è indicato in caso di:
TBC polmonare cavitaria;
Positività della colorazione Ziehl-Neelsen sullo sputo;
Coinvolgimento laringeo;
Infezione polmonare estesa.
Esso dovrà persistere fino all'inizio di una terapia efficace o alla dimostrazione di una riduzione del numero dei microorganismi o alla diminuzione della tosse.
Vaccinazione Antitubercolare: Si usa il vaccino BCG (Calmette-Guerin). La vaccinazione è obbligatoria per :
Neonati e bambini di età< 5anni, con Mantoux negativa, conviventi o aventi contatti stretti con persone affette da TBC in fase contagiosa qualora persista il rischio di contagio;
Personale sanitario, studenti in medicina, allievi infermieri e chiunque, a qualunque titolo, con Mantoux negativa, operi in ambienti sanitari ad alto rischio di esposizione. L'esecuzione della vaccinazione è subordinata alla verifica della risposta negativa della Mantoux effettuata da non oltre 30 giorni. Il risultato della vaccinazione nei soggetti professionalmente esposti va controllato a distanza di 3 mesi dall'inoculazione del vaccino mediante nuova Mantoux.
Controindicazioni: bambini con immunodeficienza congenita e/o acquisita.
 |
|
| Appunti Bambini |  |
| Tesine Nutrizione |  |
| Lezioni Bellezza |  |