 |
|
| Appunti universita |
|
 |
|
| Appunti universita |
|
| Visite: 1989 | Gradito: |
Leggi anche appunti:CMF - chirurgia maxillo-faccialeCMF - chirurgia maxillo-facciale La chirurgia maxillo-facciale è una specialità Legionella PneumophilaLegionella Pneumophila La L. Pneumophila è un piccolo batterio di incerta Pediculosipediculosi Le pediculosi sono causate da pidocchi: sono insetti ematofagi |
 |
 |
IL NEONATO SANO
Fisiologia perinatale
Prima di iniziare, è opportuno chiarire alcuni concetti in merito alla terminologia adottata. In base all'età gestazionale (EG), il neonato può essere:
PRETERMINE: < 37 settimane di EG;
TERMINE: 37-41 settimane di EG;
POST-TERMINE: > 41 settimane di EG.
In base al peso, invece, avremo:
SGA (Small for gestational age): peso <10° percentile (può essere dovuto a cause materne quali infezioni, pre-eclampsia, fumo o cause fetali quali infezioni STORCH, anomalie cromosomiche e malformazioni);
AGA (Average): peso 10°- 90° percentile. La media del peso alla nascita, a termine, è 3.400 gr per i maschi e 3.200 gr per le femmine;
LGA (Large): peso > 90° percentile (può essere dovuto a cause materne quali il diabete o cause fetali quali gigantismo costituzionale o Sd di Beckwith-Wiedemann).
La classificazione in base all'EG è molto importante anche per analizzare quelli che sono i vari tassi di mortalità:
Mortalità perinatale: morti feto-neonatali che si verificano dalla 22° settimana di gestazione fino al 28° giorno dopo la nascita, ed è espressa come numero di decessi per 1000 nati vivi;
Mortalità neonatale: morti neonatali che si verificano tra il periodo della nascita e il 28° giorno;
Mortalità infantile: comprende i periodi neonatale e post-neonatale. Il periodo postnatale inizia a partire dal 28° giorno dalla nascita fino al compimento del 1° anno di età.
Ventilazione e funzione polmonare:Durante il periodo fetale, la placenta provvede agli scambi di O2 e CO2. Lo sviluppo dei polmoni fetali si realizza durante tutta la gestazione e, a partire dalla 25a sett., sono presenti alveoli quasi completamente maturi. I polmoni fetali producono continuamente un liquido, costituito in parte da trasudato dei capillari polmonari e in parte dal surfactante polmonare secreto dagli pneumociti di tipo II.
Il liquido polmonare si muove lungo l'albero tracheobronchiale e contribuisce a formare il liquido amniotico; per valutare la maturità del polmone fetale si può calcolare il rapporto lecitina/sfingomielina del liquido amniotico: se è >2 il polmone è maturo, tra 1 e 2 è immaturo e c'è la possibilità che si instauri una malattia a membrane ialine.
I movimenti respiratori fetali si verificano intermittentemente, di solito in circa 1/3 del tempo, durante la fase di sonno con movimenti oculari rapidi (REM). I movimenti respiratori fetali sembrano essere essenziali per lo sviluppo polmonare e per il controllo neuromuscolare del respiro di cui il neonato ha bisogno per sopravvivere.
Affinché alla nascita si verifichi un normale scambio gassoso, è necessaria una pronta rimozione del liquido interstiziale polmonare e del liquido alveolare. Ciò si può verificare attraverso due meccanismi. (1) Al momento del parto vaginale, la compressione del torace fetale provoca l'eliminazione di una parte di liquido polmonare. Nel momento in cui il torace viene espulso si verifica un rimbalzo elastico delle costole che richiama aria nell'albero respiratorio. Il primo forte sforzo inspiratorio riempie ulteriormente gli alveoli di aria. (2) I livelli fetali di adrenalina e noradrenalina aumentano durante il travaglio e incrementano l'assorbimento attivo di sodio e acqua, attraverso l'epitelio respiratorio, mediante i canali epiteliali del sodio. La sindrome del polmone umido neonatale (tachipnea transitoria del neonato) è probabilmente causata da un ritardato riassorbimento attivo di sodio e liquido polmonare fetali attraverso i canali epiteliali del sodio.
Poiché gli alveoli polmonari fetali sono ripieni di liquido, la tensione superficiale non rappresenta un problema per i movimenti respiratori fetali. A seguito del primo respiro, dopo la nascita, gli alveoli contengono aria e si formano allora interfacce aria/liquido, poiché uno strato di liquido riveste la superficie alveolare. Il surfactante polmonare (una complessa miscela costituita da fosfolipidi, inclusi fosfatidilcolina, fosfatidilglicerolo, fosfatidilinositolo, grassi neutri e tre proteine attive di superficie) è in gran parte contenuto in inclusioni lamellari negli pneumociti di tipo II ed è rilasciato in grandi quantità al momento del primo atto respiratorio.
Entro le 34-35 sett. di gestazione viene solitamente prodotta una sufficiente quantità di surfactante per prevenire diffuse atelettasie, che rappresentano il principale problema nella sindrome del distress respiratorio.
Circolazione: Durante la circolazione fetale le resistenze arteriolari polmonari sono così elevate che il flusso ematico polmonare è ridotto (soltanto il 5-10% della gittata cardiaca). Al contrario, nella circolazione sistemica la resistenza al flusso ematico è bassa, specialmente a causa della bassa resistenza al flusso ematico attraverso la placenta. La bassa PaO2 sistemica fetale (circa 25 mmHg) insieme con la produzione locale di prostaglandine mantiene pervio il dotto arterioso fetale. A causa delle elevate resistenze polmonari, il sangue proveniente dal ventricolo destro scorre da destra a sinistra, dall'arteria polmonare attraverso il dotto arterioso nell'aorta. Un altro shunt destro-sinistro si verifica attraverso il forame ovale pervio. Nel feto la pressione atriale sinistra è bassa a causa del ridotto ritorno ematico polmonare, mentre la pressione atriale destra è relativamente alta per il notevole ritorno ematico dalla placenta. La differenza di pressione esistente fra i due atri mantiene pervio il forame ovale e permette al sangue di passare dall'atrio destro al sinistro.
Dopo i primi atti respiratori, che determinano l'aumento del flusso ematico polmonare e la chiusura del forame ovale, si verifica una profonda modificazione a livello della circolazione. Le resistenze arteriolari polmonari cadono improvvisamente come risultato della vasodilatazione derivante dall'espansione polmonare, dall'aumentata PaO2 e dalla ridotta PaCO2. Inoltre l'introduzione di aria determina, a livello alveolare, un'interfaccia aria-liquido che favorisce il collasso alveolare; queste forze sono contrastate dalle forze elastiche delle costole e della parete toracica. Di conseguenza, cade la pressione interstiziale polmonare, determinando un ulteriore aumento del flusso ematico attraverso i capillari polmonari.
Quando il flusso ematico polmonare si stabilizza, il ritorno venoso polmonare aumenta e la pressione in atrio sinistro si innalza. L'introduzione d'aria fa aumentare la PaO2, determinando la costrizione delle arterie ombelicali. Il flusso ematico placentare si riduce o cessa del tutto e si riduce il ritorno ematico all'atrio destro. In questo modo, la pressione atriale destra diminuisce mentre la pressione atriale sinistra aumenta; il risultato è la chiusura del forame ovale.
Subito dopo la nascita le resistenze sistemiche superano quelle polmonari e si ha un'inversione dalla situazione fetale. Quindi, la direzione del flusso ematico attraverso il dotto arterioso pervio si inverte, creando uno shunt ematico sinistro-destro (denominato circolazione di transizione). Questa situazione persiste da subito dopo la nascita (quando aumenta il flusso ematico polmonare e si verifica la chiusura funzionale del forame ovale) fino a circa 24 h di vita, quando si ha la chiusura del dotto arterioso. Il sangue proveniente dall'aorta che entra nel dotto arterioso e nei suoi vasa vasorum ha un'alta PO2 che, insieme alle variazioni nel metabolismo delle prostaglandine, determina una vasocostrizione e la chiusura del dotto arterioso. Al momento della chiusura del dotto arterioso si instaura la circolazione di tipo adulto. I due ventricoli adesso pompano in serie e non esistono shunt maggiori tra le circolazioni polmonare e sistemica.
Durante i primi giorni di vita, in caso di distress neonatale, si può avere il ritorno a una circolazione di tipo fetale. L'asfissia, con ipossia e ipercapnia, causa la vasocostrizione delle arteriole polmonari e la dilatazione del dotto arterioso, con inversione dei processi sopra descritti e con la realizzazione di uno shunt destro-sinistro attraverso il dotto arterioso nuovamente pervio e/o il forame ovale riaperto. Di conseguenza, il neonato presenta una grave ipossiemia, condizione, questa, denominata ipertensione polmonare persistente o circolazione fetale persistente (naturalmente non c'è la circolazione placentare).
Il trattamento si propone di rimuovere le condizioni che determinano la vasocostrizione polmonare.
Escrezione della bilirubina: Questo processo inizia durante la vita fetale. Le emazie vecchie o danneggiate vengono rimosse dal circolo tramite le cellule reticoloendoteliali, che, in seguito, convertono l'eme in bilirubina (1 g di Hb produce 34 mg di bilirubina). Questa bilirubina non coniugata, che è legata all'albumina sierica, viene quindi trasportata mediante la circolazione al fegato. Gli epatociti fetali, contenenti proteine leganti, captano dal sangue la bilirubina libera nei sinusoidi epatici. In seguito l'enzima glicuronil-transferasi coniuga la bilirubina con l'acido uridindifosfoglicuronico (UDPGA), formando bilirubina diglicuronide (bilirubina coniugata) che è secreta attivamente nei canalicoli biliari. La bilirubina diglicuronide raggiunge il meconionel tratto GI, ma non può essere eliminata dall'organismo, perché il feto normalmente non elimina le feci. L'enzima b-glicuronidasi, presente nell'orletto a spazzola della mucosa dell'intestino tenue fetale, viene rilasciato nel lume intestinale, dove rimuove il legame bilirubina-glicuronide; la bilirubina libera (non coniugata) viene poi riassorbita a livello intestinale e rientra nella circolazione fetale. La bilirubina fetale viene allontanata dal circolo mediante il passaggio transplacentare nel plasma materno secondo gradiente di concentrazione. Il fegato materno poi coniuga ed elimina la bilirubina fetale.
Alla nascita viene a mancare la placenta per cui il fegato del neonato deve efficacemente captare, coniugare e secernere la bilirubina nella bile, in modo che possa essere eliminata con le feci. Tuttavia, nel neonato mancano i batteri intestinali in grado di ossidare nell'intestino la bilirubina in urobilinogeno; di conseguenza, la bilirubina, escreta come tale nelle feci, conferisce loro un caratteristico colore giallo vivo. L'apparato GI del neonato (come quello fetale) contiene b-glicuronidasi che deconiuga parte della bilirubina, che può così essere riassorbita e ritornare in circolo dal lume intestinale come bilirubina non coniugata (circolo enteroepatico della bilirubina), contribuendo alla determinazione dell'iperbilirubinemia fisiologica e dell'ittero fisiologico. L'alimentazione produce il riflesso gastro-colico e la bilirubina viene dunque eliminata con le feci prima che la gran parte di essa venga deconiugata e riassorbita.
Emoglobina fetale: A causa dell'elevata affinità dell'Hb fetale per l'O2, viene mantenuto attraverso la placenta un elevato gradiente di concentrazione dell'O2, determinando un abbondante passaggio di O2 dalla circolazione materna a quella fetale. Questa aumentata affinità per l'O2 è meno utile dopo la nascita, poiché l'Hb fetale rilascia meno facilmente O2 ai tessuti; ciò può essere molto dannoso se coesiste una grave affezione respiratoria o cardiaca. Il passaggio dall'Hb fetale a quella adulta inizia prima della nascita.
Il brusco aumento della PaO2, da circa 25-30 mm Hg nel feto a 90-95 mm Hg nel neonato normale, determina una caduta dei livelli sierici di eritropoietina, che spiega la ridotta produzione di GR che si verifica normalmente alla nascita e persiste per 6-8 sett. Questa ridotta attività del midollo osseo determina un'anemia fisiologica, soprattutto nei neonati prematuri in cui la massa corporea e il volume ematico sono in rapido aumento. Tuttavia, la diminuzione dell'Hb induce, alla fine, una ridotta tensione di O2 tissutale e quindi un'aumentata increzione di eritropoietina, che stimola il midollo osseo a produrre nuovi GR. L'eritropoietina può rivelarsi efficace nel trattamento dell'anemia del prematuro (da non confondere con l'anemia da carenza di ferro, che di solito non si verifica prima dei 4-6 mesi di vita).
Situazione immunologica del feto
Alla nascita la maggior parte dei meccanismi immunitari presenta una funzionalità direttamente proporzionale all'età gestazionale, ma anche nel nato a termine, essa è minore rispetto agli adulti. Ne deriva che, il neonato e il lattante (specialmente nel periodo di età compreso fra 3 e 12 mesi) presentano una immunodeficienza transitoria significativa, che coinvolge tutte le componenti del sistema immunitario, esponendo il neonato al rischio di gravi infezioni. Tale rischio può essere incrementato dalla prematurità, da un parto distocico, dalla presenza di malattie materne, da sofferenza neonatale e da farmaci (p. es., immunosoppressori e anticonvulsivanti). La ridotta risposta infiammatoria del neonato contribuisce all'aumento della suscettibilità alle infezioni e può spiegare la mancanza di segni clinici di localizzazione (p. es., febbre o meningismo), diversamente da ciò che succede nei bambini più grandi durante un processo infettivo.
Fagocitosi: nel feto, le cellule deputate alla fagocitosi, già presenti nello stadio di sviluppo del sacco vitellino, sono importanti per la risposta infiammatoria nei confronti di infezioni batteriche e micotiche. I granulociti e i monociti compaiono rispettivamente durante il 2° e 4° mese di gestazione.
La loro attività funzionale aumenta con l'aumentare dell'età gestazionale, ma è ancora bassa nel nato a termine.
Il monocita circolante è il precursore del macrofago fisso tissutale, che è in grado di effettuare la fagocitosi in utero e ha una bassa o normale attività microbicida nel nato a termine. I macrofagi degli alveoli polmonari raggiungono la loro sede al momento della nascita e aiutano a liberare gli alveoli dai detriti del liquido amniotico e dai microrganismi. Questi e altri macrofagi tissutali, come quelli della milza, hanno una ridotta attività fagocitica.
Alla nascita, l'ultrastruttura dei neutrofili è normale, ma sono ridotte la deformabilità di membrana e l'adesività, il che può condizionare funzioni cellulari quali la chemiotassi e la fagocitosi. L'attività fagocitica e microbicida dei neutrofili e dei monociti è di solito normale nel neonato sano dopo 12 h di vita; è ridotta, invece, nel neonato di basso peso alla nascita o nel nato a termine asfittico.
Nella maggior parte dei neonati, la chemiotassi dei neutrofili e dei monociti è ridotta a causa di un'anomalia intrinseca della locomozione cellulare e dell'adesività alle superfici. Quest'ultima può essere attribuita all'incapacità di aumentare l'espressione di superficie delle glicoproteine di adesione e alla riduzione della fibronectina. Il siero neonatale possiede inoltre una ridotta capacità di produrre fattori chemiotattici (sostanze che attraggono i fagociti nei luoghi di invasione microbica). La ridotta chemiotassi dei monociti neonatali può contribuire all'instaurarsi dell'anergia cutanea, tipica del neonato. La chemiotassi raggiunge i livelli dell'adulto dopo diversi anni dalla nascita.
L'opsonizzazione è necessaria per un'efficiente fagocitosi di molti microrganismi. I fattori opsonizzanti del siero comprendono gli anticorpi di classe IgG e IgM (termostabili) e il complemento (termolabile).
A differenza delle IgG, le IgM e le frazioni del complemento non attraversano la placenta. Le IgM opsonizzano i batteri gram - più efficacemente di quanto non facciano le IgG, ma, per un'attività opsonizzante sierica ottimale, è necessario il complemento. La sintesi dei fattori del complemento inizia fin dalle 5° sett. di gestazione, ma i livelli della maggior parte dei componenti della via classica e della via alternativa raggiunge, entro il termine della gestazione, solamente il 50-75% dei livelli dell'adulto. I leucociti del neonato hanno recettori Fc e C3 normali per entrambi i gruppi di opsonine, ma i recettori C3 subiscono lentamente, dopo stimolazione, un aumento di espressione sulla superficie cellulare.
L'attività opsonizzante del siero varia con l'età gestazionale, essendo ridotta nei lattanti di basso peso alla nascita nei confronti di tutti i microrganismi testati e nei neonati a termine è solitamente ridotta nei confronti di alcuni germi, in particolare i batteri gram -. La diminuita attività opsonizzante sierica è responsabile, almeno in parte, della ridotta efficienza alla nascita del sistema reticoloendoteliale.
Immunità cellulare (cellule T): alla 6a sett. circa di gestazione, il timo inizia a svilupparsi dall'epitelio della 3a e 4a tasca faringea. A 8 sett., il timo si sviluppa rapidamente; entro le 12 sett., si sono sviluppate le aree corticale e midollare. Entro le 14 sett., sono presenti nel timo le maggiori sottoclassi timocitiche (timociti a tripla marcatura: CD3-, CD4-, CD8-; timociti a doppia marcatura: CD4+, CD8+; timociti a marcatura singola: CD4+ o CD8+). Già a 14 sett., sono presenti nel fegato e nella milza fetali cellule T CD4+ e CD8+, il che indica che, a questa età gestazionale, sono presenti negli organi linfatici periferici cellule T mature.
Il timo è particolarmente attivo durante lo sviluppo fetale e nel primo periodo di vita postnatale. Esso cresce rapidamente in utero e si può facilmente evidenziare, nel neonato normale, in una radiografia del torace; raggiunge le massime dimensioni a 10 anni di vita e regredisce poi, gradualmente, nel corso di molti anni. Si ritiene che il timo, durante il periodo fetale e quello perinatale, sia il mediatore della tolleranza verso gli antigeni 'self' e che sia essenziale per lo sviluppo e la maturazione del tessuto linfoide periferico. Gli elementi epiteliali del timo producono sostanze, come le citochine, che sono importanti per la differenziazione e la maturazione delle cellule T.
Il numero di cellule T nella circolazione fetale aumenta gradualmente durante il secondo trimestre di gestazione e raggiunge valori quasi normali entro le 30-32a sett. di gestazione. Alla nascita, il neonato, rispetto all'adulto, presenta una linfocitosi relativa, con un aumentato rapporto CD4+/CD8+, che riflette una percentuale di cellule T CD8+ relativamente bassa. Dopo la nascita, nel compartimento T-cellulare periferico avvengono variazioni nelle sottoclassi linfocitiche. Tuttavia, a differenza di quanto accade negli adulti, il compartimento T-cellulare del neonato contiene soprattutto cellule T CD4+ immature, che esprimono il CD45RA e bassi livelli di CD29. Invece, i linfociti del sangue periferico dell'adulto sono soprattutto cellule T CD4+ di memoria che esprimono il CD45RO e livelli relativamente elevati di CD29. Il significato di tale differenza nei marker di membrana delle cellule T può essere correlato alle differenze nella capacità di rispondere ad antigeni e di produrre citochine delle diverse sottopopolazioni T-cellulari. Per esempio, le cellule T neonatali sono di scarso aiuto per le cellule B nella sintesi delle immunoglobuline. Mentre sembra essere adeguata la secrezione di interleuchina (IL)-2 da parte delle cellule T neonatali, la produzione di molte altre citochine, come, interferone-γ, IL-4, IL-5 e IL-3 è deficitaria, se comparata a quella delle cellule T dell'adulto in risposta a vari stimoli.
Alla nascita, l'attività citotossica, includendo la natural-killer, quella anticorpo-dipendente e quella delle cellule T killer è considerevolmente ridotta rispetto a quella dei linfociti degli adulti. Inoltre, l'attività delle cellule T suppressor è notevolmente aumentata, a seconda dello stimolo, il che può essere messo in relazione al fenotipo poco elaborato delle cellule T CD4+ del neonato. Il risultato finale è una parziale immunodeficienza T-cellulare che può determinare un'aumentata suscettibilità alle infezioni e, in rare circostanze, l'attecchimento di linfociti materni o trasfusi. Numerosi fattori, come infezioni virali, iperbilirubinemia e assunzione materna di farmaci verso la fine della gravidanza, possono deprimere la funzionalità dei linfociti T del neonato.
Le risposte ai test cutanei che valutano l'ipersensibilità ritardata, sono ridotte fino a circa 1 anno di vita.
La persistenza di linfociti materni e la malattia del trapianto contro l'ospite sono rare nei nati a termine e ciò indica che la funzionalità T-cellulare è adeguata nei neonati a termine.
Immunità anticorpale: i linfociti B sono presenti nel midollo osseo, nel sangue, nel fegato e nella milza del feto entro la 12a sett. di gestazione. Tracce di IgM e IgG sono sintetizzate entro la 20° sett. e tracce di IgA entro la 30a sett. Tuttavia, poiché il feto normalmente si trova in un ambiente privo di antigeni, vengono prodotte in utero soltanto piccole quantità di immunoglobuline (specialmente IgM). Livelli elevati di IgM nel sangue cordonale (> 20 mg/dl) indicano un'esposizione in utero ad antigeni, di solito per una infezione congenita. Quasi tutte le IgG sono di derivazione materna, per passaggio transplacentare. Dopo 22 settimane di gestazione, il passaggio transplacentare di IgG aumenta per raggiungere, al termine della gestazione, i valori materni o valori maggiori. Le IgG2 passano attraverso la placenta in minor quantità rispetto alle altre sottoclassi di IgG (IgG1 > IgG3 > IgG4 > IgG2). Nei prematuri i livelli di IgG alla nascita sono ridotti proporzionalmente all'età gestazionale.
Dopo la nascita, il catabolismo delle IgG di origine materna, che hanno un'emivita di circa 25 giorni, determina, nel periodo di vita tra i 2 e i 6 mesi, una ipogammaglobulinemia fisiologica, che inizia a migliorare dopo il 6° mese, quando il tasso di IgG prodotte dal bambino supera la quota di anticorpi di derivazione materna distrutti. Il prematuro, in particolare, può diventare profondamente ipogammaglobulinemico durante i primi 6 mesi di vita. Entro 1 anno di vita i livelli di IgG sono circa il 70% dei livelli medi dell'adulto. Le IgA, IgM, IgD e IgE non attraversano la placenta. I loro livelli aumentano lentamente; da valori molto bassi raggiungono circa il 30% di quelli dell'adulto entro 1 anno di vita. Le immunoglobuline raggiungono i livelli dell'adulto approssimativamente come segue: a 1 anno le IgM, a 8 anni le IgG e a 11 anni le IgA. Le IgA secretorie sono scarse o assenti nelle secrezioni salivari e gastrointestinali del neonato a termine fino a circa 1 mese dopo la nascita.
Il neonato presenta una risposta anticorpale insufficiente nei confronti di molti antigeni, inclusi quelli vaccinali. Le risposte anticorpali agli antigeni polisaccaridici come quelli dell'Haemophilus e dello pneumococco sono ridotte nei primi 2 anni di vita, a meno che non siano coniugate all'anatossina difterica. Quando si verifica una risposta nei confronti di questi batteri, durante un'infezione, di solito è caratterizzata da una risposta prolungata di tipo IgM e ridotta di tipo IgG. I nati a termine sono protetti, grazie agli anticorpi materni acquisiti passivamente, nei confronti della maggior parte dei potenziali patogeni. I neonati di peso molto basso alla nascita non sono così protetti poiché le più basse quantità di anticorpi materni scompaiono entro 2-4 mesi di vita. Tuttavia, nei prematuri si può avere una risposta ai vaccini, p. es., difterite-pertosse-tetano e polio, sebbene non efficace come nei neonati a termine.
Il trasferimento passivo dell'immunità materna, tramite anticorpi di tipo IgG transplacentari e fattori immunitari contenuti nel latte materno, aiuta a compensare l'immaturità del sistema immunitario del neonato e determina una immunocompetenza nei confronti di molte infezioni batteriche gravi (p. es., da pneumococco, Haemophilus, meningococco) e virali (p. es., morbillo, varicella). D'altra parte, le IgG acquisite passivamente possono, a volte, inibire la risposta del neonato nei confronti della vaccinazione contro virus come il morbillo o la rosolia. Il latte materno contiene molti fattori antibatterici (p. es., IgG, IgA secretorie, GB, frazioni del complemento, lisozima e lattoferrina) che vanno a rivestire il tubo digerente e le vie respiratorie superiori, prevenendo la colonizzazione delle mucose da parte di germi patogeni per il tratto respiratorio o enterico. L'allattamento al seno è particolarmente importante nei casi in cui l'acqua può essere inquinata.
Nonostante l'uso di antibiotici e i tentativi fatti per potenziare l'immaturo sistema immunitario del neonato, la morbilità e la mortalità legate alle infezioni neonatali rimangono significative. Studi recenti hanno suggerito il possibile impiego di gammaglobuline immuni o iperimmuni nel trattamento di alcune infezioni neonatali (p. es., infezioni da streptococco di gruppo B e da virus respiratorio sinciziale). Sebbene i dati sulla loro efficacia siano controversi, trasfusioni di leucociti a dosi adeguate possono essere utili nel trattamento della sepsi neonatale. Tuttavia, sono necessarie ulteriori ricerche per stabilire le indicazioni all'utilizzo di tali trasfusioni.
Assistenza alla nascita
Valutazione della vitalità del neonato: La Dr.ssa Virginia Apgar ideò nel 1953 una scala di valutazione basata sui seguenti parametri:
Activity: muscle tone;
Pulse rate;
Grimace: reflex;
Appearance: skin color;
Respiration.
![]()
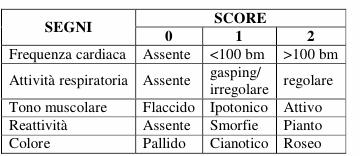 L'indice di Apgar viene assegnato al 1° ed al 5°
minuto di vita ed ancora ogni 5 minuti fino a quando non è maggiore o uguale a
7. Non serve per decidere se rianimare o meno, bensì per fornire una misura
obiettiva delle condizioni del neonato alla nascita e per dimostrare
l'efficacia degli interventi assistenziali. In base al punteggio APGAR,
possiamo ottenere i seguenti score:
L'indice di Apgar viene assegnato al 1° ed al 5°
minuto di vita ed ancora ogni 5 minuti fino a quando non è maggiore o uguale a
7. Non serve per decidere se rianimare o meno, bensì per fornire una misura
obiettiva delle condizioni del neonato alla nascita e per dimostrare
l'efficacia degli interventi assistenziali. In base al punteggio APGAR,
possiamo ottenere i seguenti score:
7-10 neonato sano;
4-6 neonato modicamente depresso;
1-3 neonato depresso;
0 neonato morto (assenza di segni vitali).
Il punteggio può essere alterato da varie condizioni morbose, quali infezioni, malattie neuromuscolari, del sistema nervoso, dell'apparato respiratorio, dall'età gestazionale e infine dalla somministrazione di farmaci alla madre, quali ad esempio anestetici ad alte dosi.
È fortemente operatore-dipendente.
Rianimazione: Nella maggior parte dei casi il parto avviene senza la necessità di un'assistenza specifica; in più i neonati che necessiteranno di rianimazione alla nascita nel 70% dei casi vengono individuati prima del
parto tramite le indagini canoniche.
Rimane però un 30% in cui la necessità di rianimazione non è prevedibile: bisogna perciò che il parto avvenga in presenza di un operatore in grado di iniziare le manovre rianimatorie:
A - Airway: posizionare correttamente il neonato e aspirare le prime vie aeree;
B - Breathing: stimolazione tattile, somministrazione di ossigeno tramite ventilazione con maschera e pallone o infine intubazione e ventilazione;
C - Circulation: valutazione dell'attività cardiaca e massaggio cardiaco esterno;
D - Drug: adrenalina, bicarbonato, espansori di volume e naloxone.
Il neonato inizia gli atti respiratori spontaneamente, a seguito dell'aumento dei CO2 dato dalla chiusura del cordone, della manipolazione e del trauma dato dal parto, con il cosiddetto "urlo neonatale". Se ciò non avviene entro il primo minuto si parla di apnea, o di asfissia se l'apnea persiste oltre un minuto.
Assistenza igienica alla nascita: Alla nascita il neonato viene lavato in acqua tiepida (37-38°C) per asportare la vernice caseosa, e viene immediatamente posto accanto alla madre se non sussistono controindicazioni.
Il cordone ombelicale viene clampato con una molletta monouso e si può applicare un po' di mercurocromo con uno zaffo di cotone sul cordone reciso di fresco e sull'area periombelicale per prevenire infezioni; è sufficiente una sola applicazione; entro 24 ore si rimuove la molletta e si procede alla medicazione con garza imbevuta di alcool 70% per favorire l'essiccamento del moncone.
Il neonato ha scarsi meccanismi di controllo della temperatura per la sottigliezza della sua cute, pertanto va coperto avendo cura di proteggere soprattutto il capo che essendo molto ampio è un'area di grande dispersione di calore.
Manovre profilattiche e di screening: Alla nascita si procede alla profilassi "alla Credé" che consiste nell'instillazione di 2 gocce di collirio antibiotico per occhio, allo scopo di prevenire la blenorragia.
Si esegue poi la profilassi antiemorragica con l'iniezione im di vitamina K: il neonato è carente dei fattori II, VII, IX e X, ovvero i K-dipendenti, per la carenza della vitamina sia a causa del ridotto contenuto nel latte materno, sia della mancanza dei batteri intestinali deputati alla sua sintesi.
La vitamina K infatti esiste nelle forme:
K1, fillochinone o fitomenadione: presente nelle piante superiori e nella carne;
K2, menachinone: sintetizzato dai batteri intestinali;
K3, vitamina sintetica o menadione.
La malattia emorragica del neonato si può presentare in diverse forme, riassunte nella tabella successiva.
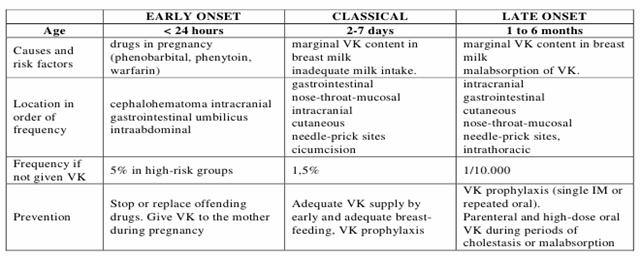
Figura : Le diverse forme di esordio della malattia emorragica del neonato.
Si effettuano poi gli screening per le malattie metaboliche:
Ipotiroidismo (TSH);
Sd adreno-genitale (17-OH progesterone);
Fibrosi cistica (tripsinogeno);
Fenilchetonuria (fenilalanina);
Galattosemia (galattosio).
Dimissione precoce della madre e del neonato
L'immagine che segue, riassume i fattori che vengono presi in considerazione per una precoce dimissione della madre e del neonato.

Figura : Fattori che determinano una precoce dimissione.
La mortalità infantile
Con questa espressione si intende il numero di morti fra il momento della nascita e il primo anno di vita, riferita a 1000 nati vivi. La mortalità neonatale invece include il tasso di morti nei primi 30 giorni di vita, e si suddivide in precoce (primi 7 giorni) e tardiva.
Con mortalità fetale si intende il numero di morti dal concepimento all'espulsione; in Italia si calcola che tale numero sia pari al 35% dei nati vivi.
Unendo la mortalità infantile e quella fetale si ottiene la mortalità feto-infantile, che secondo l'OMS è un valido indicatore socio-economico.
In Italia da una mortalità infantile del 200 per mille si è passati all'attuale 4,3 per mille (media nazionale). Le cause più comuni di mortalità del lattante sono:
cause perinatali (63%) quali traumi, prematurità, asfissia;
malformazioni (26%) soprattutto cardiache;
malattie infettive (2,4%);
altro (tumori).
 |
| Appunti su: relazione sul neonato sano, maschera emorragica neonato, |
|
| Appunti Nutrizione |  |
| Tesine Bellezza |  |
| Lezioni Bambini |  |