 |
|
| Appunti superiori |
|
 |
|
| Appunti superiori |
|
| Visite: 6977 | Gradito: |
Leggi anche appunti:Fattore di trascrizione NF-YFattore di trascrizione NF-Y 1 Morfologia delle proteine Il sistema endocrinoIl sistema endocrino Il sistema endocrino comprende organi,ghiandole e ormoni. Relazione di BiologiaRelazione di Biologia L' obbiettivo dell'esperienza fatta in laboratorio |
 |
 |
Le funzioni fisiologiche delle GGT
1 Il ruolo antiossidante: la sintesi del glutatione
Le funzioni fisiologiche della GGT sono in parte oscure; le conoscenze a proposito del suo ruolo riguardano le funzioni che essa svolge a livello della membrana plasmatica. Qua la GGT catalizza il primo passo della degradazione extracellulare del glutatione (GSH), cioè l'idrolisi del legame gamma-glutamilico tra acido glutammico e cisteina, due dei tre amminoacidi (il terzo è la glicina) che compongono il GSH. La porzione γ-glutammilica viene donata a accettori amminoacidici i quali, trasportati all'interno della cellula, sono il substrato dell'enzima γ-glutamil-ciclotransferasi che li scinde nei corrispettivi amminoacidi (Griffith et al, 1979; Tate e Meister, 1981), e in 5-oxoprolina, la quale può essere nuovamente convertita in acido glutammico dall'enzima 5-oxoprolinasi e usata quindi per la resintesi del GSH intracellulare (Meister e Anderson, 1983). Il dipeptide cisteinil-glicina è idrolizzato dalle dipeptidasi di membrana in cisteina e glicina, che sono riassorbite dalla cellula e possono essere riutilizzate nella sintesi de novo del GSH (Allison e Meister, 1981; Hanigan e Ricketts, 1993). La GGT inoltre favorisce il recupero del GSH uscito dalla cellula secondo gradiente di concentrazione. L'insieme delle reazioni collegate all'attività di GGT e quelle che portano alla sintesi ed all'efflusso del GSH costituiscono quello che viene definito il
"ciclo del γ-gutammile o ciclo di Meister" (Orlowski e Meister, 1970).
Il GSH è uno degli agenti riducenti più importanti ed è inoltre cofattore degli enzimi coinvolti nel metabolismo dell'acqua ossigenata, di perossidi organici e di radicali liberi. Poiché la GGT dà inizio alla degradazione del GSH extracellulare rendendo possibile la successiva captazione degli amminoacidi che lo compongono da parte della cellula (ciclo del γ-glutammile), viene considerata un enzima ancillare dei sistemi antiossidanti basati sul GSH; da questo punto di vista l'enzima potrebbe avere un ruolo protettivo contro il danno ossidativo intracellulare (Hanigan e Pitot,
1985; Hanigan et al.,1998) (Fig 1.4).
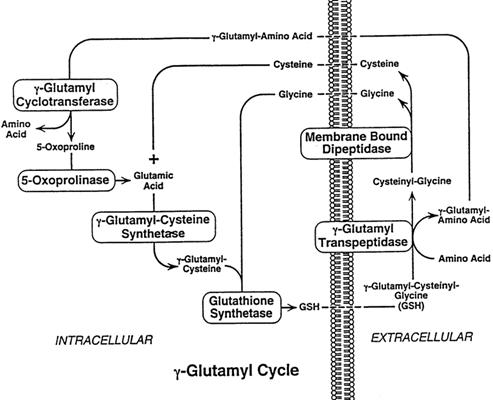
Fig 1.4 Ciclo del γ-glutammile (Lieberman et al., 1995)
Attraverso il ciclo del γ-glutammile la GGT gioca un ruolo importante per il trasporto transmembrana degli amminoacidi che compongono il glutatione fra cui la cys, fondamentale per la sintesi proteica; in casi di deficit enzimatico, tuttavia, non sono stati riscontrati particolari problemi di trasporto di tali amminoacidi. Un'ulteriore conferma del legame molto stretto fra glutatione e GGT si è avuta osservando che, se veniva inibita la produzione di glutatione nei topi attraverso dietilmaleato, la concentrazione di GGT-mRNA aumentava significativamente negli epatociti e così pure la concentrazione sierica dell'enzima (Moriya et al., 1994).
2 Escrezione degli acidi biliari.
Nel fegato l'attività di GGT è regolata dagli acidi biliari liberi e coniugati. Gli acidi biliari liberi (colato, chenodesossicolato, desossicolato) stimolano l'attività enzimatica della GGT con conseguente incremento delle reazioni di idrolisi e di transpeptidazione del GSH fondamentali per il rifornimento di amminoacidi utilizzati nei processi di coniugazione. Gli acidi biliari coniugati con glicina e taurina stimolano la reazione di idrolisi a livello di dotti biliari, ma inibiscono quella di transpeptidazione con un meccanismo di feed-back negativo, riducendo così la disponibilità degli amminoacidi necessari per la formazione dei coniugati (Abbott e Meister, 1983).
3 Il ruolo pro-ossidante della GGT
Se da un lato abbiamo visto come la GGT permetta la sintesi di un importante antiossidante intracellulare, d'altra parte negli ultimi anni si è sempre più indagato circa le possibili implicazioni pro-ossidanti che la GGT può assumere in particolari condizioni.
Il substrato della GGT, il GSH, è un tripeptide le cui proprietà antiossidanti sono basate sulle capacità riducenti del gruppo tiolico (-SH) del residuo amminoacidico di cisteina. I tioli, però, specialmente nella loro forma dissociata di anione tiolato (R- S¯), possono cedere elettroni (cioè possono ridurre) cationi metallici come ferro e rame. Questo fenomeno innesca il trasferimento degli stessi elettroni dai cationi metallici all'ossigeno molecolare, generando anione superossido
e acqua ossigenata, i quali in presenza di Fe3+, libero (reazione di Fenton) o chelato all'ADP (reazione di Haber-Weiss), possono generare radicali idrossili che insieme al radicale tiile danno inizio alle reazioni a catena della perossidazione lipidica, con conseguente perdita della struttura e della stabilità della membrana cellulare, nonché delle sue importanti funzioni (Zalit et al., 1996).
E' importante sottolineare come questi fenomeni avvengono almeno inizialmente sul lato esterno della membrana e quindi all'esterno della cellula, e perciò non sottoposti ai meccanismi di difesa in essa contenuti (Maellaro et al.,
2000).
Mentre il GSH, a causa delle peculiari proprietà del gruppo carbossilico libero del suo residuo di acido glutammico, è poco propenso a ridurre cationi metallici, la sua idrolisi da parte della GGT determina il rilascio di un catabolita, la cistenilglicina, molto più reattivo ed estremamente efficiente nel ridurre i cationi metallici, innescando così la produzione di radicali liberi e specie reattive dell'ossigeno.
L'azione proossidante della GGT è legata alla presenza di metalli redox attivi nell'ambiente extracellulare, cosa che in vivo è fortemente prevenuta grazie alla formazione di complessi quali ferritina, transferrina e ceruloplasmina che non permettono ai metalli di catalizzare reazioni con radicali liberi. A tal proposito è interessante osservare che l'attività di GGT è in grado di ridurre e di promuovere il rilascio degli ioni ferro legati alla transferrina (Drozdz et al., 1998; Dominici et al.,
2003a) e che l'azione proossidante è stata osservata anche in presenza di ceruloplasmina (Glass e Stark, 1997), ovvero due sorgenti fisiologiche di ioni di metalli di transizione. Inoltre il rilascio di ioni ferro dalle loro forme di immagazzinamento è stato osservato in molte condizioni fisiopatologiche, un processo questo che potrebbe rendere i metalli disponibili per promuovere l'azione proossidante della GGT (Paolicchi et al., 2002a).
E' stato anche osservato che l'attività di GGT poteva promuovere l'ossidazione GSH-Fe dipendente delle lipoproteine a bassa densità (LDL) umane isolate promuovendo un processo che si ritiene essere fondamentale nella formazione della placca aterosclerotica e del danno vascolare (Berliner e Heinecke,
1996; Paolicchi et al., 1999).
4 Il metabolismo del nitrosoglutatione
Il nitrosoglutatione (GSNO) è un metabolita del GSH e dell'ossido nitrico (Hart, 1985) che può avere numerose attività farmacologiche come ad esempio l'inibizione dell'aggregazione piastrinica, la protezione dal danno da riperfusione cardiaca e durante l'esposizione ad agenti ossidanti (Konorev et al., 1995). Il GSNO, appartenendo alla classe dei composti γ-glutammilici, è un possibile substrato per l'enzima GGT. Hogg e collaboratori (1997) hanno dimostrato che in vitro la GGT, in presenza di Gly-Gly come accettore della reazione di transpeptidazione, catalizzava la conversione di GSNO in 5-nitroso-cistenil-glicina (CG-SNO) con una Km più elevata di quella in presenza di GSH (Singh et al. 1995). Il CG-SNO in presenza di ioni metallici di transizione si dissociava spontaneamente in Cys-Gly e NO.
Zeng e collaboratori (2001), studiando il meccanismo di decomposizione del GSNO usando cellule endoteliali di aorta bovina (BAEC), hanno concluso che il meccanismo di decomposizione del GSNO mediato da tali cellule endoteliali comportava la riduzione di disolfuri extracellulari a gruppi sulfidrilici che a loro volta riducevano il GSNO. Pertanto questi autori hanno ipotizzato che il GSNO si degradasse in seguito ad una modificazione dello stato di ossido-riduzione dell'ambiente extracellulare. La GGT potrebbe partecipare a tali modificazioni tramite la promozione di reazioni pro-ossidanti che comportano una modulazione dei gruppi tiolici delle proteine sulla superficie esterna della membrana cellulare (Dominici et al., 2003b; Corti et al., 2005)
5 Il metabolismo dei leucotrieni e deficit di GGT
I leucotrieni (LTs) sono una classe di mediatori lipidici attivi nell'infiammazione derivanti dall'acido arachidonico prodotti dall'azione dell'enzima lipossigenasi. Questa classe di molecole comprende il diidrossieicosatetraenoato LTB4 e i cisteinil-leucotrieni (LTC4 ,LTD4 e LTE4) che rappresentano costituenti biologicamente attivi da tempo conosciuti come "sostanze
della risposta breve all'anafilassi". I leucotrieni, C4 e D4 inclusi, legano specifici recettori sulle cellule muscolari liscie causando prolungata broncocostrizione (Anderson et al., 1982; Bernstrom e Hammarstrom, 1982). Il leucotriene LTC4 è coniugato ad una molecola di GSH ed è convertito in LTD4 dall'attività enzimatica della GGT, l'idrolisi del residuo di Gly da LTD4 porta alla formazione di LTE4 (Lewis et al., 1990).
E' stato dimostrato inoltre che i cisteinil-leucotrieni sono vasocostrittori particolarmente potenti delle arterie coronariche e sono associati con eventi ischemici (Allen et al Circulation, 1998). Inoltre è noto che inibitori dell'enzima 5- lipoossigenasi e antagonisti dei recettori per i cisteinil-leucotrieni sono efficaci per ridurre l'estensione dell'infarto e dell'aritmia indotta dalla riperfusione in modelli animali e in ischemie indotte sperimentalmente. Il fatto che il livello di produzione dei cisteinil-leucotrieni aumenti nei pazienti con malattia coronarica è un ulteriore prova che i cisteinil-leucotrieni siano effettivamente implicati negli eventi coronarici e cardiaci. Per capire l'effettivo coinvolgimento dei leucotrieni nella risposta contrattile è stata confrontata l'entità di questo evento con la capacità delle arterie coronariche, arterosclerotiche e non, di legare il LTC4 e il LTD4. Le arterie non aterosclerotiche non rispondevano ai leucotrieni LTC4 e LTD4; al contrario queste molecole inducono contrazione dose-dipendente sulle arterie aterosclerotiche che rispondevano con potenti contrazioni al LTC4 e con contrazioni più modeste al LTD4. L'iper-reattività delle arterie coronariche arterosclerotiche ai leucotrieni LTC4 e LTD4 non risentiva dell'azione di mediatori derivati dall'endotelio (Allen et al., Circulation, 1998), ma era piuttosto dovuta ad un aumento del numero dei recettori e quindi al potenziamento del sistema di trasduzione del segnale. Invece, non sembravano essere presenti recettori per cisteinil-leucotrieni nelle arterie coronariche non aterosclerotiche come suggerisce l'incapacità di LTC4 e LTD4 di indurre la loro contrazione. Il ruolo della GGT nella modulazione degli effetti
biologici dei cisteinil- leucotrieni non è stato ancora del tutto approfondito.
Il deficit di GGT è un disturbo molto raro e solo un esiguo numero di pazienti affetti è stato descritto in letteratura; proprio il metabolismo dei cisteinil-leucotrieni è stato recentemente studiato in tre pazienti con deficienza di GGT (Mayatepek et al., 2004). Questi hanno mostrato un incremento nella concentrazione plasmatica e urinaria di LTC4 insieme alla totale assenza di LTD4 e LTE4, mentre la sintesi di LTB4 è rimasta invariata. La deficienza di GGT può essere considerata come un errore ereditario della sintesi dei cisteinil-leucotrieni. Per motivi non ancora chiari, nei topi tale deficit è associato a gravi disturbi come ritardo di crescita e morte precoce. Tuttavia anche nei soggetti umani diversi disordini neurologici sono correlabili con la deficienza di GGT, in particolare per quanto riguarda il metabolismo dei leucotrieni; infatti, un deficit di sintesi di LTC4 è stato associato ad una sindrome che può risultare fatale, la quale include una severa ipotonia muscolare, ritardo psicomotorio, sterilità e microcefalia (Mayatepek et al., 1998).
 |
| Appunti su: ciclo di meister, ciclo del gamma glutamile, gamma gt sintesi glutatione, https:wwwappuntimaniacomsuperioribiologiale-funzioni-fisiologiche-delle15php, ciclo di meister glutatione, |
|