 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2599 | Gradito: |
Leggi anche appunti:Come si e' giunti al modello atomico odiernoCOME SI E' GIUNTI AL MODELLO ATOMICO ODIERNO Nel 1905 Millikan dimostrò Modello atomico di BohrModello atomico di Bohr La contraddizione del modello atomico planetario di KirchooffKirchooff La prima legge, detta anche "legge dei nodi,"dice che in un |
 |
 |
COME SI E' GIUNTI AL MODELLO ATOMICO ODIERNO
Nel 1905 Millikan dimostrò che la carica elettrica è sempre un multiplo intero di una quantità elementare pari 1,602 10-19 Coulomb, carica che si dimostrò appartenere sia al protone che all'elettrone. Nota la carica dell'elettrone ed il rapporto e/m fu quindi possibile ricavare il valore assoluto della massa dell'elettrone.

Il fatto che un atomo neutro contenesse al suo interno particelle negative di massa trascurabile rispetto a quella dell'intero atomo, richiedeva naturalmente la presenza di una controparte positiva alla quale associare la maggior parte delle sua massa.
|
|
Nel 1886 Goldstein, usando un tubo a raggi catodici con catodo forato, rilevò dietro al catodo, una luminescenza provocata da radiazioni con movimento opposto a quello dei raggi catodici.. Egli dimostrò che si trattava di particelle cariche positivamente (raggi canale). Poiché la massa di tali particelle era diversa a seconda del gas contenuto nel tubo, si ritenne, correttamente. che gli elettroni che attraversavano il gas, accelerati dalla differenza di potenziale fossero in grado, urtandoli, di strappare gli elettroni contenuti negli atomi del gas, facendoli così diventare ioni positivi i quali, attirati dal catodo, andando a formare i raggi canale. Si dimostrava dunque che l'atomo neutro doveva presentare una struttura interna formata da particelle negative di piccola massa (elettroni) che neutralizzavano una porzione positiva più massiccia.
Lo studio
dei raggi canale portò in seguito lo stesso Thomson nel
Nel 1904 Rutherford dimostrò che la radiazione alfa è costituita da nuclei di Elio. Lo stesso Rutherford, con la collaborazione di Soddy, fu in grado ben presto di dimostrare che durante l'emissione delle radiazioni alfa e beta, l'elemento radioattivo si trasforma, con un ritmo caratteristico, in un elemento di peso e numero atomico diverso (e quindi in un altro elemento chimico).
Decadimento alfa - Quando un nucleo radioattivo (e quindi instabile) emette una radiazione , esso si trasforma, o decade, nell'elemento che lo precede di due posti nella tabella periodica, a causa della perdita di due protoni (e due neutroni). Tale processo è noto come
![]()
Decadimento b (beta-meno) Quando un nucleo radioattivo emette una radiazione -, esso si trasforma, o decade, nell'elemento che lo segue di un posto nella tabella periodica, a causa della trasformazione di un neutrone del suo nucleo in un protone (che rimane nel nucleo), un elettrone e un antineutrino (che si allontanano dal nucleo)
![]()
![]()
Decadimento b (beta-più) Quando un nucleo radioattivo emette una radiazione +, esso si trasforma, o decade, nell'elemento che lo precede di un posto nella tabella periodica, a causa della trasformazione di un protone del suo nucleo in un neutrone (che rimane nel nucleo), un positrone ed un neutrino (che si allontanano dal nucleo)
![]()
![]()
Cattura elettronica (cattura K). Si produce quando uno degli elettroni presenti nel guscio più vicino al nucleo (livello K) viene catturato da un protone che si trasforma in un neutrone ed un neutrino
![]()
![]()
Agli inizi del '900 vi erano dunque sufficienti elementi per formulare un modello atomico coerente. Nel 1904 J.J. Thomson ipotizzò che gli atomi fossero costituiti da una massa carica positivamente, uniformemente distribuita, all'interno della quale erano presenti gli elettroni, carichi negativamente, in numero tale da determinare l'equilibrio delle cariche e quindi la neutralità.
Per cercare di chiarire la reale distribuzione delle cariche positive e negative che costituiscono l'atomo è possibile studiare gli effetti di deflessione (scattering o diffusione) che queste producono su particelle-proiettile dotate di carica. Tale tecnica, oggi divenuta molto comune per sondare la struttura della materia, fu utilizzata per la prima volta proprio sull'atomo, utilizzando come proiettili particelle a e b
Nel 1911 Rutherford, a conclusione di una serie di esperimenti di scattering condotti sugli atomi, giunse a modificare profondamente il modello di Thomson
In tali esperimenti vennero fatte collidere particelle con sottilissimi fogli metallici di oro o platino.
Il loro comportamento risultò sorprendente ed incompatibile con il modello di Thomson: la maggior parte delle particelle attraversava indisturbata il diaframma metallico proseguendo in linea retta, ma alcune particelle subivano vistose deflessioni, in alcuni casi rimbalzando addirittura indietro. Il numero delle particelle deviate risultava correlato al numero atomico degli atomi bombardati.
L'esperienza suggerisce che:
a) La struttura atomica sia estremamente rarefatta, visto l'alto numero di particelle in grado di attraversarla
b) la diffusione sia provocata dalla repulsione tra particelle alfa incidenti ed una carica positiva estremamente concentrata il cui valore cresca al crescere del numero atomico.
|
|
Infatti se la carica positiva fosse diffusa, distribuita uniformemente su tutto il volume atomico, le particelle a sarebbero sottoposte sempre ad una forza risultante nulla o quasi nulla, sia passando all'interno di un atomo, sia passando tra gli atomi (è quel che accade utilizzando come proiettili-sonda gli elettroni, i quali attraversano la materia subendo deviazioni molto piccole, a causa della distribuzione più omogenea e diffusa delle cariche negative dell'atomo).
Per giustificare i risultati dei suoi esperimenti, Rutherford propose dunque un nuovo modello atomico, detto modello planetario con gli elettroni che andavano a costituire una specie di corteccia
esterna al massiccio nucleo positivo, in modo da garantire la neutralità a livello macroscopico. Per non cadere nel nucleo, attirati dalla carica positiva in esso presente, gli elettroni negativi dovevano naturalmente possedere un'energia cinetica agente in senso opposto.
Da calcoli
effettuati sulle percentuali e sugli angoli di deviazione, Rutherford giunse a
calcolare che, mentre l'atomo doveva possedere un diametro dell'ordine di 10-
Lo stesso Rutherford proporrà in seguito di chiamare protone il nucleo dell'elemento più leggero, l'idrogeno. L'esistenza dei protoni venne definitivamente confermata nel 1925 da Blackett, il quale riuscì ad ottenere immagini fotografiche (camera di Wilson) della trasmutazione dell'azoto,
che, colpito da una particella si trasforma in un nucleo di ossigeno e libera un protone del suo nucleo.
![]()
Solo molto più tardi (1932) James Chadwick, bombardando il Berillio con particelle a scoprì che nei nuclei sono presenti anche particelle neutre, aventi una massa dello stesso ordine di grandezza del protone, anche se leggermente superiore, che vennero chiamati neutroni.
![]()

La scoperta dei neutroni permise di giustificare completamente l'esistenza degli isotopi, scoperti in precedenza da Thomson. Inoltre permise di classificare gli atomi dei vari elementi in funzione del numero dei protoni presenti nel loro nucleo.
Il modello di Rutherford presentava tuttavia gravi difetti in quanto gli elettroni che ruotano intorno al nucleo dovrebbero perdere energia cinetica sotto forma di emissione di radiazione elettromagnetica, come previsto dalle leggi dell'elettrodinamica, finendo per cadere sul nucleo. Inoltre gli atomi, in opportune condizioni, sono in grado di emettere e assorbire radiazione elettromagnetica secondo modalità che il modello planetario di Rutherford non era in grado di giustificare.
Fu pertanto necessario introdurre un nuovo modello atomico. Ma prima di parlarne è necessario affrontare, sia pur brevemente, il problema della natura della radiazione elettromagnetica e dei fenomeni di interazione che essa manifesta con la materia.
Nel Natale del 1900 Max Planck ebbe un'intuizione che, come ebbe a dire egli stesso, fu più un atto di disperazione che una vera e propria scoperta scientifica.
Nel tentativo di trovare una equazione che descrivesse correttamente la curva di corpo nero, Planck propose che le onde elettromagnetiche non potessero essere emesse da un radiatore ad un ritmo arbitrario e continuo, ma solo sotto forma di pacchetti d'onde che egli chiamò quanti
Ogni quanto possedeva una certa quantità di energia che dipendeva dalla lunghezza d'onda della luce, secondo la relazione:
E = h v
dove v è la frequenza della radiazione e h è una nuova costante, detta costante di Planck
Dalla relazione appare evidente come un quanto di luce rossa possa contenere meno energia di un quanto di luce blu. In tal modo un corpo emittente ad una certa temperatura potrebbe avere energia sufficiente per emettere quanti di luce infrarossa o gialla, ma potrebbe non avere sufficiente energia per emettere neppure un quanto di radiazione X o gamma. In tal modo ad alte frequenze il numero di quanti emessi si ridurrebbe drasticamente (e ciò spiegherebbe ad esempio il paradosso di Jeans
La cosa incredibile fu che la curva di corpo nero così calcolata era in perfetto accordo con i dati sperimentali.
L'introduzione della costante di Planck che inizialmente poteva sembrare più che altro un espediente per salvare i fenomeni, risultò invece portare con sé una serie di novità sconcertanti e rivoluzionarie all'interno della fisica. Con essa nasce quella parte della fisica moderna che va sotto il nome di meccanica quantistica e di cui avremo modo di parlare in seguito.
Planck non portò alle estreme conseguenze il concetto di quanto di radiazione. Si limitò semplicemente a verificare che nel caso particolare in cui la materia emetteva radiazione non lo faceva come un flusso continuo, secondo le leggi dell'elettromagnetismo classico, ma, per qualche misterioso motivo, attraverso scariche di particelle di energia dette quanti. L'ipotesi quantistica di Planck ruppe definitivamente con l'idea del continuo per l'energia.
La luce non poteva dunque più essere considerata semplicemente un fenomeno ondulatorio, visto che, almeno in questo caso particolare, i fisici erano costretti a descriverne il comportamento attraverso un modello corpuscolare. D'altra parte il modello corpuscolare quantistico era inapplicabile per spiegare fenomeni tipicamente ondulatori come la diffrazione e l'interferenza.
Nasce l'idea di un comportamento duale della luce, la quale richiede due modelli, apparentemente in reciproca contraddizione, per essere descritta. Si utilizza il modello ondulatorio per descrivere i fenomeni di propagazione della radiazione elettromagnetica. Si utilizza il modello corpuscolare per descrivere i fenomeni di interazione con la materia (emissione ed assorbimento).
Pochi anni più tardi, nel 1905 Einstein confermò la descrizione quantistica della radiazione, utilizzando l'ipotesi di Planck per spiegare l'effetto fotoelettrico, fenomeno inspiegabile sulla base della teoria ondulatoria.
Come si è già avuto modo di dire il modello planetario di Rutherford risultava in contraddizione con i principi dell'elettrodinamica classica e doveva pertanto essere corretto. Rimaneva inoltre ancora irrisolto il problema degli spettri a righe, la cui soluzione appariva con molta probabilità legata proprio alla struttura atomica.
Visto il successo ottenuto nella risoluzione del problema del corpo nero e dell'effetto fotoelettrico, attraverso l'introduzione nel formalismo matematico della costante di Planck, Bohr decise di tentare la stessa strada anche per risolvere il problema degli spettri a righe.
Preso in considerazione l'atomo di Idrogeno, Bohr introdusse alcune ipotesi in modo da far intervenire all'interno della struttura atomica la costante h.
|
1a ipotesi |
Esiste uno stato stazionario dell'atomo caratterizzato da particolari orbite circolari lungo le quali gli elettroni si muovono senza emettere radiazioni elettromagnetiche. Gli elettroni che percorrono tali orbite stazionarie possiedono una certa quantità ben definita di energia detta livello energetico dell'orbita.
Essendo gli
elettroni in equilibrio in tali orbite la forza centrifuga (![]() ) deve eguagliare la forza di attrazione coulombiana
) deve eguagliare la forza di attrazione coulombiana ![]() tra l'elettrone
negativo ed il suo nucleo, contenente Z protoni con carica pari alla carica e
dell'elettrone. Per l'Idrogeno Z = 1 e la relazione diventa
tra l'elettrone
negativo ed il suo nucleo, contenente Z protoni con carica pari alla carica e
dell'elettrone. Per l'Idrogeno Z = 1 e la relazione diventa
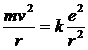
da cui si ricava il raggio
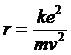
|
2a ipotesi |
A questo punto Bohr impose, del tutto arbitrariamente una condizione di quantizzazione. Tra le infinite orbite che soddisfano la 1) sono permesse solo quelle che soddisfano la seguente relazione
2) 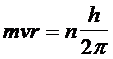
dove mvr è il momento della quantità di moto
dell'elettrone in orbita attorno al suo nucleo, detto anche momento angolare orbitale h/2π prende il nome di costante di Planck normalizzata e viene spesso indicata con ![]() (acca tagliato) ed
n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una
condizione di quantizzazione del momento angolare, che si rivelerà in seguito
fondamentale e caratteristica di qualsiasi corpo rotante.
(acca tagliato) ed
n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una
condizione di quantizzazione del momento angolare, che si rivelerà in seguito
fondamentale e caratteristica di qualsiasi corpo rotante.
Tale condizione si esprime dicendo che il momento angolare dell'elettrone deve essere un multiplo intero di acca tagliato
Il momento angolare quantizzato condiziona i valori che possono assumere il raggio delle orbite e l'energia totale (cinetica + potenziale) o livello energetico, che l'elettrone possiede.
Raggi e livelli energetici risultano pertanto anch'essi quantizzati in funzione di n.
Raggio quantizzato: Dalla condizione di quantizzazione del momento angolare si ricava la velocità che sostituita nella 1) fornisce la relazione quantistica del raggio
![]()
per n = 1
r = 5,292 10-
Energia quantizzata (livello
energetico): L'energia associata ad un elettrone in moto
su di un'orbita quantizzata si calcola come somma dell'energia cinetica (![]() ) e dell'energia potenziale (
) e dell'energia potenziale (![]() ). Se esplicitiamo
dalla 1) la quantità
). Se esplicitiamo
dalla 1) la quantità ![]() e la sostituiamo nell'espressione dell'energia cinetica,
l'energia totale vale
e la sostituiamo nell'espressione dell'energia cinetica,
l'energia totale vale
![]()
Sostituendo r con il valore quantizzato del raggio si ottiene
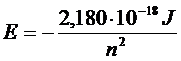
pari a -13,61 n-2 eV.
Il valore negativo dell'energia deriva dalla convenzione di porre pari a zero l'energia potenziale dell'elettrone a distanza infinita.
Per n = 1 l'elettrone si trova nello stato di minima energia possibile, detto stato fondamentale. Gli stati caratterizzati da n > 1 si dicono stati eccitati.
|
3^ Ipotesi |
L'atomo può passare dallo stato fondamentale ad uno eccitato assorbendo energia. In questo modo gli elettroni possono assumere l'energia necessaria per passare da un'orbita più interna ad una più esterna. L'energia assorbita affinché avvenga il salto quantico dell'elettrone, o transizione elettronica, deve essere esattamente uguale alla differenza di energia esistente tra il livello energetico superiore e quello inferiore. Quando l'elettrone si trova in un orbita superiore a quella in cui si trova normalmente, l'atomo possiede un surplus di energia che lo rende instabile (eccitato). L'elettrone è quindi destinato a tornare nell'orbita di partenza riemettendo l'energia precedentemente assorbita tramite un fotone la cui energia è appunto pari a
E2 - E1 = ΔE = hv
La radiazione emessa, avendo una frequenza univocamente determinata dalla differenza di energia esistente tra due particolari livelli energetici, è rigorosamente monocromatica ed apparirà come una ben determinata riga allo spettroscopio.
L'energia emessa durante una transizione da un livello n2 ad un livello n1, con n2 > n1, è
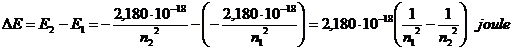
Ricordando
che ΔE = hv e che c = ln, sostituendo opportunamente si
ottiene ![]() , quindi
, quindi ![]() ed in definitiva
ed in definitiva
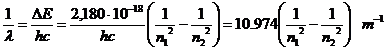
Per
calcolare il numero d'onde![]() (reciproco della lunghezza d'onda) della riga emessa durante
una transizione elettronica, Bohr ritrova dunque, per via teorica, la medesima
relazione trovata empiricamente da Balmer :
(reciproco della lunghezza d'onda) della riga emessa durante
una transizione elettronica, Bohr ritrova dunque, per via teorica, la medesima
relazione trovata empiricamente da Balmer : ![]()
I numeri interi n ed m che nella relazione di Balmer non presentavano alcun significato fisico, nel modello atomico di Bohr diventano rispettivamente il numero quantico del livello più interno n1 ed il numero quantico del livello più esterno n2, tra i quali avviene la transizione.
Ponendo nella n1 = 2 ed n2 intero superiore a due si possono trovare tutte le lunghezze d'onda delle righe spettrali prodotte dalle transizioni elettroniche dalle orbite più esterne verso la seconda orbita. Tale righe spettrali corrispondono ovviamente alla serie di Balmer
Ponendo invece n1 = 1 si ottengono le righe spettrali della serie di Lyman, le quali rappresentano dunque le transizioni elettroniche dalle orbite più esterne verso la prima e così via per le altre serie
Ponendo infine n2 = si ottiene la lunghezza d'onda che deve possedere la luce con cui irraggiare l'atomo per estrarre l'elettrone e portarlo all'infinito. In altri termini è possibile calcolare teoricamente l'energia di ionizzazione dell'atomo.
Il numero quantico principale n può assumere teoricamente tutti i valori compresi tra 1 ed infinito. In pratica però tutti gli atomi conosciuti sistemano i loro elettroni al massimo in 7 livelli energetici, i quali vengono spesso indicati con le lettere K, L, M, N, O, P, Q.
Un altro aspetto notevole del modello di Bohr è che la costante di Rydberg viene ad essere calcolata in funzione di costanti note (come la carica dell'elettrone, la sua massa, la velocità della luce, etc) ed il suo valore risulta in ottimo accordo con il valore misurato sperimentalmente.
Il modello di Bohr è in grado di giustificare in modo soddisfacente solo il comportamento spettrale dell'Idrogeno e degli atomi idrogenoidi (ioni di altri elementi leggeri con un solo elettrone, come He+ e Li2+), mentre risulta inadeguato per atomi plurielettronici. D'altra parte quando Bohr impose la sua condizione di quantizzazione non poté darne alcuna giustificazione teorica, se non quella che in tal modo era possibile calcolare il valore numerico della costante di Rydberg e le righe spettrali dell'Idrogeno. Solo una decina di anni più tardi Louis De Broglie, avrebbe dimostrato che la condizione imposta da Bohr era una conseguenza della natura ondulatoria dell'elettrone.
Tra il 1913 ed il 1914 venne un'ulteriore conferma del modello atomico di Bohr, grazie agli esperimenti condotti da Moseley sugli spettri di emissione a righe nella regione della radiazione X di vari elementi chimici.
Quando un elettrone del primo livello energetico (livello K) viene espulso, in seguito ad una collisione con un elettrone proiettile o in seguito ad irradiazione con fotoni altamente energetici (gli elettroni del primo livello sono fortemente legati), il suo posto può essere occupato da un elettrone presente nei livelli superiori. Se l'elettrone proviene dal livello L (n = 2) la riga spettrale che si forma è detta K, se proviene dal livello M (n = 3) è detta K, e così via.
Se l'elettrone inizialmente espulso interessa il livello L, le righe che si formano per transizione elettronica dagli strati superiori M, N sono dette L, L
La serie K è sostanzialmente analoga alla serie di Lyman per l'idrogeno, ma si manifesta nella regione X.
 Le diverse righe della serie K
presentano naturalmente un valore diverso nei vari elementi chimici, a causa
delle differenze di energia esistenti tra livelli energetici dello stesso tipo
in atomi aventi una diversa carica nucleare Z.
Le diverse righe della serie K
presentano naturalmente un valore diverso nei vari elementi chimici, a causa
delle differenze di energia esistenti tra livelli energetici dello stesso tipo
in atomi aventi una diversa carica nucleare Z.
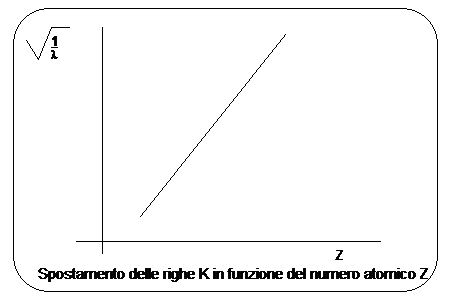
Moseley dimostrò che la riga più intensa di questi spettri (riga K) si spostava regolarmente quando si passava da un elemento al successivo nella tavola periodica e che la lunghezza d'onda di tale riga si poteva esprimere in funzione del numero atomico Z, attraverso una relazione sostanzialmente analoga alla relazione di Balmer
![]()
dove a è la costante di schermo, introdotta per tener conto del fatto che la carica del nucleo 'vista' da ciascun elettrone è, a causa della presenza degli altri elettroni, inferiore a Ze.
Per la riga K la relazione diventa
![]()
La relazione dimostra che la radice quadrata della lunghezza d'onda è inversamente proporzionale al numero atomico Z.
Ciò, oltre a confermare il modello di Bohr, permise, da una parte di dare al numero atomico Z il suo significato preciso di numero di cariche elettriche concentrate nel nucleo (e quindi anche di numero di elettroni orbitanti esternamente per rendere l'atomo neutro), dall'altra di ordinare correttamente gli elementi nella tavola periodica secondo il numero atomico crescente e non secondo il peso atomico crescente. Gli elementi devono infatti essere ordinati con lo stesso ordine con cui si succedono le righe della serie K. Risultò ad esempio che il Co precede il Ni e non viceversa.
Del 1914 sono gli esperimenti condotti da J. Franck e G. Hertz (nipote di H. Hertz) che dimostrarono in modo conclusivo, non solo l'esistenza degli stati stazionari postulati da Bohr, ma anche che i salti quantici degli elettroni avvenivano effettivamente secondo le regole di quantizzazione teorizzate.
Nel 1921 Otto Stern e W. Gerlach verificarono un'altra conseguenza della teoria di Bohr. Infatti non solo le singole orbite, ma anche l'intero atomo deve possedere un momento angolare quantizzato, calcolato come vettore risultante dei singoli momenti interni.
In pratica quindi anche l'intero atomo (se possiede un momento magnetico risultante netto) può assumere solo orientazioni spaziali discrete.
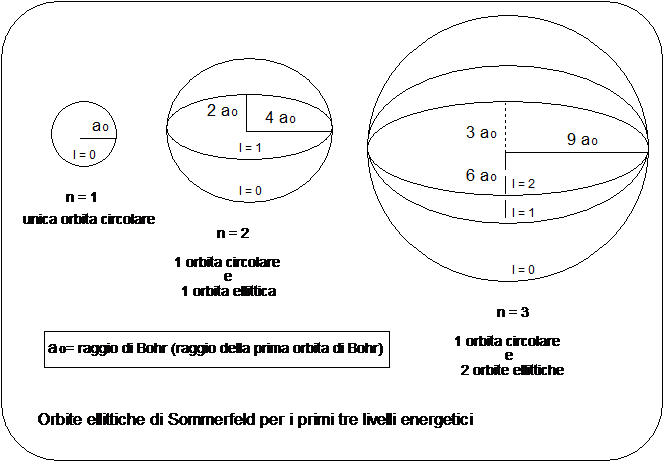
Tra le ipotesi iniziali di Bohr vi era quella che le orbite degli elettroni fossero circolari. Si trattava di un'ipotesi semplificatrice visto che la teoria di Bohr si basa sulla legge di Coulomb, formalmente simile alla legge di gravitazione universale, la quale costringe i corpi a ruotare intorno ad un baricentro comune su orbite ellittiche (la circonferenza può essere considerata un caso particolare di ellisse, con e = 0).
Nel
Egli dimostrò che mentre nel primo livello l'elettrone poteva percorrere solo un'orbita circolare. nel secondo livello oltre ad un'orbita circolare l'elettrone avrebbe potuto occupare con la stessa energia, anche un'orbita ellittica avente l'asse maggiore della stessa lunghezza del diametro dell'orbita circolare.
Nel terzo livello era poi possibile per l'elettrone occupare, oltre all'orbita circolare due orbite ellittiche aventi assi maggiori uguali al diametro dell'orbita circolare, ma diversa eccentricità e cosi via.
L'introduzione delle orbite ellittiche sembrò rappresentare inizialmente una inutile complicazione nei calcoli. Esse permisero invece di risolvere il problema della cosiddetta struttura fine delle righe spettrali
Con l'affinamento delle tecniche spettroscopiche risultò infatti che, utilizzando maggiori risoluzioni, ciascuna riga spettrale appariva composta da una serie di sottili righe molto ravvicinate, ad indicare la probabile esistenza di sottolivelli all'interno di ciascun livello energetico principale.
La teoria di Bohr era una teoria non relativistica, nel senso che non utilizzava nel suo formalismo le relazioni della relatività speciale. In effetti le equazioni della relatività speciale possono essere trascurate senza incorrere in errori eccessivi se i corpi che si stanno studiando presentano velocità molto inferiori alla velocità della luce. Nel caso la velocità del corpo oggetto di studio si avvicini a quella della luce, la relatività dimostra che la massa del corpo non rimane costante ma cresce al crescere della velocità in modo sensibile.
Tenendo presente che gli elettroni viaggiano a velocità molto elevate intorno al nucleo atomico, Sommerfeld introdusse le condizioni relativistiche nel modello di Bohr.
In pratica, ricordando che nel moto lungo un'ellisse l'elettrone è costretto a viaggiare più velocemente quando si trova più vicino al nucleo e più lentamente quando si trova più distante, la massa elettronica subisce delle modificazioni, aumentando in prossimità del nucleo e diminuendo nel punto più distante. Ciò comporta una diversificazione, seppur minima, delle energie associate alle orbite ellittiche, le quali non coincidono più con le energie delle orbite circolari del livello di appartenenza.
L'introduzione delle condizioni relativistiche da parte di Sommerfeld permise di spiegare in parte la struttura fine dello spettro.
Le orbite ellittiche di Sommerfeld resero però necessaria l'introduzione di un altro numero quantico detto numero quantico secondario o azimutale indicato con l.
l è un numero intero positivo il cui valore dipende dal valore assunto da n
l n - 1
Quindi
se n = 1 l = 0 orbita di tipo s
( ciò significa che nel primo livello vi è una sola orbita circolare, indicata appunto con l = 0, o anche con la lettera 's').
se n = 2 l = 0 orbita di tipo s
l = 1 orbita di tipo p
(ciò significa che nel secondo livello oltre ad una orbita circolare (l = 0), naturalmente di diametro maggiore della precedente, vi è anche un'orbita ellittica ( l = 1) indicata anche con la lettera 'p'.
se n = 3 l = 0 orbita di tipo s
l = 1 orbita di tipo p
l = 2 orbita di tipo d
(ciò significa che nel terzo livello possono trovar posto oltre ad un'orbita circolare s ed una ellittica di tipo p, una seconda orbita ellittica (l = 2), avente naturalmente eccentricità differente, indicata anche con la lettera 'd'.
se n = 4 l = 0 orbita di tipo s
l = 1 orbita di tipo p
l = 2 orbita di tipo d
l = 3 orbita di tipo f
(ciò significa che nel quarto livello, oltre alle precedenti orbite può trovar posto una terza orbita ellittica (l = 3), avente forma diversa ed indicata con la lettera 'f'.
In pratica il numero quantico secondario determina la forma dell'orbita descritta dall'elettrone. Comunemente però i quattro tipi di orbite possibili vengono per semplicità indicate con le lettere s, p, d ed f.
Le lettere s, p, d, f sono le iniziali dei termini con cui storicamente venivano indicate in spettroscopia le righe corrispondenti; sharp, principal, diffuse e fundamental.
 |
| Appunti su: |
|
| Appunti Chimica |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |