 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 5267 | Gradito: |
Leggi anche appunti:Dopo il conflitto atomicDOPO IL CONFLITTO ATOMIC 1 LA MORTE PER RADIAZIONI TOCCA L'AMBIENTE SCIENTIFICO: Relazione di chimica delle fermentazioniRELAZIONE DI CHIMICA DELLE FERMENTAZIONI Titolo: Determinazione della glicemia Idrolisi neutraIdrolisi neutra (sale derivato da un acido forte e da una base forte) Si |
 |
 |
Quando gli elettroni vengono condivisi da atomi del medesimo elemento, ciascun atomo li attrae con la medesima intensità. In questo caso gli elettroni condivisi (elettroni di legame) possono essere immaginati come una nuvola negativa che si dispone in maniera uniforme e simmetrica intorno ai due nuclei senza produrre alcun tipo di polarità sulla molecola. Si parla in questo caso di legame covalente puro. Nella maggior parte dei casi però gli atomi che formano il legame covalente appartengono ad elementi diversi che presentano una diversa forza di attrazione sugli elettroni di legame.
Si definisce elettronegatività χ (la lettera greca "chi") la forza con cui un atomo attira a sé gli elettroni condivisi.
L'elettronegatività è una grandezza di difficile valutazione poiché, a differenza dell'affinità elettronica e dell'energia di ionizzazione che si riferiscono ad atomi isolati, l'elettronegatività si riferisce ad atomi legati ad altri atomi.
In generale il valore dell'elettronegatività può dunque variare, per uno stesso elemento, in relazione al tipo e al numero di atomi di altri elementi impegnati nel legame.
Nonostante ciò, al fine di avere a disposizione un parametro che permetta di valutare, anche se in modo approssimato, la polarità di un legame, sono stati proposti diversi metodi di calcolo per assegnare un valore di elettronegatività ai diversi elementi.
Tra i metodi più importanti vi sono quelli proposti da Mulliken e da Pauling.
L'elettronegatività secondo Mulliken è pari alla media aritmetica dell'energia di ionizzazione e dell'affinità elettronica.
![]()
Pauling notò che il legame covalente tra due atomi differenti (A-B) è normalmente più forte di quanto ci si potrebbe in teoria aspettare calcolando la forza media dei due legami A-A e B-B.
Pauling definisce il legame teorico AB "legame covalente normale" ed inizialmente ne stima la forza calcolando la media aritmetica delle energie dei due legami A-A e B-B
![]()
Successivamente sostituisce alla media aritmetica la media geometrica
![]()
Il surplus di energia (e quindi anche di stabilità) del legame effettivo rispetto a quello teorico viene indicato da Pauling con Δ
![]()
Pauling ipotizza che tale surplus di energia di legame dipenda dal fatto che il legame A-B possieda una certa percentuale di carattere ionico che i legami A-A e B-B non presentano. Il legame AB è visto da Pauling come un ibrido di risonanza (per il concetto di risonanza vedi più avanti § 7.2.2) tra un legame covalente puro ed un legame ionico puro. Pauling trova infine una buona correlazione tra la differenza di elettronegatività Δχ = χB - χA ed il quadrato del surplus Δ di energia del legame A-B misurato in eV
![]()
ed ammette quindi che la differenza di elettronegatività tra due elementi sia uguale alla radice quadrata della quantità Δ, detta energia di risonanza ionico-covalente espressa in eV
![]()
In altre parole, l'energia di risonanza ionico-covalente Δ misura la differenza di energia tra il legame covalente reale AB ed un ipotetico legame covalente puro AB (legame covalente normale).
Nel caso l'energia di legame sia espressa in kJ/mol o in kcal/mol è necessario applicare un coefficiente k di conversione (per trasformare in eV/particella), che vale rispettivamente 0,0103643 e 0,0433641.
![]()
I valori della scala di Pauling sarebbero in teoria espressi in eV0,5,
ma si conviene che l'elettronegatività sia adimensionale e dunque ![]() viene divisa per
1 eV0.5
viene divisa per
1 eV0.5
Per poter utilizzare la relazione di Pauling è evidentemente necessario fissare arbitrariamente l'elettronegatività di un elemento che faccia da riferimento. Pauling assunse inizialmente per l'idrogeno χ = 2,1 (successivamente portato a χ = 2,2).
Esempio
Calcoliamo l'elettronegatività del Cloro secondo Pauling, sapendo che l'energia del legame H2 è 436 kJ/mol, del legame Cl2 è 242 kJ/mol e del legame HCl è 431 kJ/mol.
L'energia
del legame HCl considerato come covalente puro è pari a ![]()
L'energia di
risonanza ionica-covalente è pari ![]()
La
differenza di elettronegatività calcolata è pertanto ![]()
Sapendo che l'elettronegatività dell'idrogeno è convenzionalmente 2,1 si ottiene per il Cloro
![]()
La scala di Mulliken è più rigorosa della scala di Pauling essendo costruita su grandezze misurabili. Nella pratica si usa però prevalentemente la scala di Pauling in quanto per molti elementi il valore dell'affinità elettronica è di difficile determinazione.
D'altra parte le due scale forniscono valori in gran parte coincidenti, risultando legate, anche se in modo approssimato, dalla seguente relazione
![]()
Esempio
Calcoliamo l'elettronegatività del cloro secondo Mulliken sapendo che la sua energia di ionizzazione è pari a 1260 kJ/mol (13,1 eV/particella) e la sua affinità elettronica è pari a -349 kJ/mol (-3,6 eV/particella) e convertiamo il valore ottenuto nella scala di Pauling
![]()
trasformiamo ora il valore nella scala di Pauling
![]()
I valori di elettronegatività secondo Pauling si trovano tabulati nella tabella periodica e presentano il valore minimo in basso a sinistra (Francio = 0.7) e crescono diagonalmente fino ad assumere il valore massimo in alto a destra (Fluoro = 4).
|
Elettronegatività (Pauling) |
|||||||||||||||||
|
H |
|
He |
|||||||||||||||
|
Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
|||||||||
|
Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
|||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Uub |
Uut |
Uuq |
Uup |
Uuh |
Uus |
Uuo |
|
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
|
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
E' evidente che tanto maggiore sarà la differenza di elettronegatività tra due elementi impegnati in un legame, tanto maggiore sarà la polarità del legame.
Dunque, quando si forma un legame covalente tra due atomi che presentano diversa elettronegatività la nube elettronica che costituisce il legame covalente risulta spostata verso l'atomo più elettronegativo. Quest'ultimo acquista pertanto una carica parzialmente negativa (indicata con -), mentre l'altro una carica parzialmente positiva (+). La distribuzione asimmetrica della nuvola elettronica produce dunque due poli aventi carica opposta (dipòlo) ed il legame viene perciò definito covalente polare.
E' ciò che accade, ad esempio nella molecola dell'acido Cloridrico (HCl) in cui l'Idrogeno condivide un elettrone con il Cloro. Il Cloro più elettronegativo presenta una parziale carica negativa e la molecola di HCl risulta polare
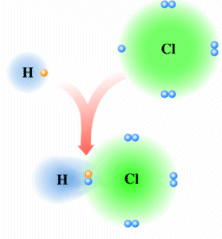
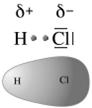
La distribuzione di carica elettrica di un dipolo può essere rappresentata tramite una mappa (o superficie) di potenziale elettrostatico (o densità elettronica) dove le tonalità del rosso indicano la carica negativa, quelle del blu la carica positiva, mentre il verde la neutralità.
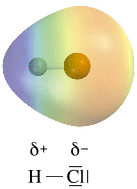
Maggiore è la differenza di elettronegatività (Δχ) tra i due elementi e maggiore sarà la polarità del legame (le cariche parziali saranno più vicine ad una intera carica).
Quando la differenza di elettronegatività tra i due elementi supera il valore critico di 1.9, si assume che l'elemento più elettronegativo sia in grado di strappare l'elettrone all'altro elemento ed il legame viene descritto come ionico. Possiamo dunque descrivere il legame ionico come un caso limite del legame covalente polare per Δχ > 1.9
L'intensità di un dipolo si esprime attraverso la determinazione del suo momento dipolare. Si definisce momento dipolare μ il prodotto della carica Q associata ad uno dei baricentri di carica (la carica dell'altro baricentro ha valore uguale e di segno opposto) per la distanza r tra i baricentri.
μ = Q . r
L'unità di misura del momento dipolare è il debye (D).
Un momento dipolare presenta l'intensità di 1 debye quando 2 cariche elettriche di segno opposto, aventi intensità di 10-10 u.e.s. (unità elettrostatiche o franklin) si trovano alla distanza di 1 Å.
1 D = 10-10 ues Å = 3,335641·10-30 C m
Per caratterizzare la polarità di un legame covalente è possibile assegnargli una certa percentuale di carattere ionico, calcolabile in funzione del suo momento dipolare.
La percentuale di carattere ionico si calcola come rapporto percentuale tra il momento dipolare effettivo (misurato) ed il momento dipolare di un teorico legame ionico
![]()
Il momento dipolare di un ipotetico legame completamente ionico si calcola con
μionico = Qe. r = 4,8 . r
dove Qe è la carica dell'elettrone (e = 4,8 10-10 u.e.s.) ed r il valore della lunghezza del legame in Å.
Ad esempio, sapendo che il momento dipolare dell'acido cloridrico è μHCl = 1,1 D e la lunghezza del legame H-Cl è di 1,27 Å, si calcola
![]()
Sopra l'atomo di Cloro è presente una parziale carica negativa (-) pari al 18% dell'intera carica dell'elettrone, mentre sopra l'atomo di Idrogeno sarà presente una parziale carica positiva (+) della medesima intensità.
La polarità di un legame può anche essere stimata utilizzando la relazione di Pauling che correla la percentuale di carattere ionico alla differenza di elettronegatività (Δχ).
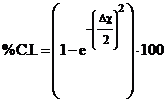
Ad esempio, sapendo che la differenza di elettronegatività tra Idrogeno e Fluoro è pari a Δχ = χF - χH = 4 - 2,2 = 1,8, possiamo stimare la percentuale di carattere ionico dell'acido fluoridrico
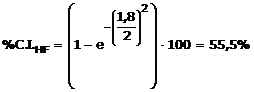
Il momento dipolare è una grandezza vettoriale, che viene rappresentata con una freccia orientata dal polo positivo al quello negativo.
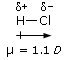
Nelle molecole in cui sono presenti più legami il momento di dipolo dell'intera molecola risulta essere la somma vettoriale dei momenti di dipolo dei singoli legami. Se il momento di dipolo risultante è diverso da zero allora la molecola è polare. Se il momento di dipolo risultante è uguale a zero, la molecola risulta apolare (anche se i suoi legami sono polari).
La polarità di una molecola dipende quindi non solo dalla polarità dei suoi legami, ma anche dalla sua geometria.
Così, ad esempio, se confrontiamo la polarità dell'anidride carbonica e dell'acqua, troveremo che mentre l'anidride carbonica è apolare, l'acqua è polare. L'anidride carbonica è infatti una molecola lineare ed il momento di dipolo dei suoi due legami risulta essere uguale e contrario, per cui il momento risultante è nullo.
L'acqua è invece una molecola angolata e la polarità dei suoi due legami si compone vettorialmente per dare un momento di dipolo diverso da zero. L'acqua è un dipolo.
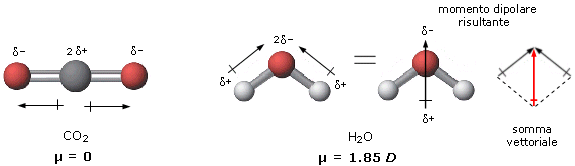
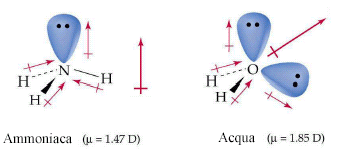
In effetti il momento dipolare totale di una molecola è dato dalla somma vettoriale non solo dei momenti dipolari relativi ai legami covalenti, ma anche ai dipoli associati alle coppie solitarie presenti nella molecola.
Una molecola polare è un minuscolo dipòlo il quale è in grado di ruotare orientandosi opportunamente se posto in un campo elettrico.
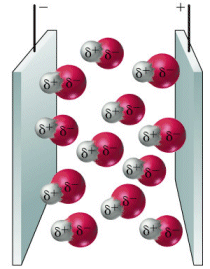
Dipoli orientati in un campo elettrico
 |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |