 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2747 | Gradito: |
Leggi anche appunti:Le prestazioni del bipropellente H2O2-C2H6Le prestazioni del bipropellente H2O2-C2H6 Perossido di idrogeno e etano Pesi atomici e molecolari relativi: l'unità di massa atomicaPesi atomici e molecolari relativi: l'unità di massa atomica Se infatti volumi uguali Molecole con elettroni spaiati e paramagnetismoMolecole con elettroni spaiati e paramagnetismo Non sempre gli atomi utilizzano |
 |
 |
Agli inizi dell'800 erano già stati identificati una cinquantina di elementi chimici che il chimico svedese J.J. Berzelius (1779 - 1848) raccolse nel 1818 in una tabella. Lo stesso Berzelius propose di adottare la simbologia chimica attualmente in uso.
Ciascun elemento chimico viene univocamente associato ad un simbolo, in genere corrispondente all'iniziale del suo nome latino (o alle prime due lettere se vi è possibilità di equivoco con altri elementi). Ad esempio C è il Carbonio, Ca il Calcio, Ce il Cerio, Co il Cobalto, Cu il Rame.
I simboli rappresentano sia gli elementi che i relativi atomi. Così N rappresenta l'elemento Azoto, ma anche un atomo di Azoto. In questo modo è possibile rappresentare le sostanze chimiche mediante opportune scritture convenzionali, dette formule.
Nelle formule grezze (o brute) sono rappresentati i simboli degli elementi chimici che costituiscono la sostanza, ciascuno seguito in basso a destra da un numero, detto indice, che specifica quanti atomi di quell'elemento sono presenti. L'indice 1 non compare, essendo sottinteso.
H2SO4 CO2 H2O N2 Na2CO3 O2 Mg(NO3)2
Come si può osservare dalle formule che le rappresentano, le sostanze chimiche possono essere costituite da atomi di uno stesso elemento (O2 N2) e sono perciò dette sostanze elementari, o da atomi di elementi diversi (H2SO4 CO2) e sono perciò dette sostanze composte o, semplicemente, composti.
I composti sono sostanzialmente di due tipi: molecolari o ionici.
Un composto molecolare è formato da molecole. Una molecola è la più piccola parte di materia che presenta le medesime caratteristiche chimiche della sostanza alla quale appartiene. È costituita da un gruppo definito di atomi, tra loro legati, ma distinti e separati dagli atomi che costituiscono altre molecole. Le formule che rappresentano tali composti sono dette formule molecolari.
Un composto ionico è costituito dall'alternarsi di anioni e cationi legati dalla reciproca attrazione elettrostatica e presenti in rapporti precisi, definiti dalla loro carica. Ad esempio nel carbonato di sodio si alternano ioni Na+ e ioni CO32- nel rapporto di 2:1, necessario per neutralizzare le cariche elettriche. La formula Na2CO3 non rappresenta la molecola, che non esiste in quanto tale, ma descrive il minimo rapporto di combinazione tra gli elementi. Tali formule sono dette formule minime.
Gli ioni presentano, ad esponente del simbolo che li rappresenta, il numero di cariche, positive o negative che li caratterizza, esattamente pari al numero di elettroni persi o acquistati.
Esistono anche ioni poliatomici.
Le formule grezze (sia molecolari che minime) non danno alcuna informazione sul modo in cui gli atomi sono legati (connettività). A questo scopo sono state introdotte rappresentazioni, dette formule di struttura. Nel caso si desiderino evidenziare anche informazioni relative alla disposizione nello spazio degli atomi e dei loro legami è necessario utilizzare formule spaziali o steriche, le quali, oltre ad evidenziare la posizione dei legami, mostrano anche la loro orientazione (angolo di legame) e danno quindi informazioni sulla struttura tridimensionale (geometria) della sostanza
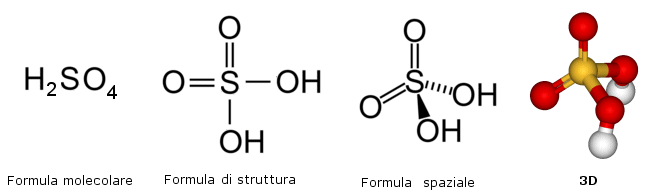
Nelle formule spaziali (o steriche) valgono le seguenti convenzioni

Nelle trasformazioni chimiche, comunemente dette reazioni chimiche, le sostanze messe a reagire, dette reagenti, si trasformano in altre specie chimiche, dette prodotti di reazione. Ciò avviene essenzialmente perché alcuni legami che tenevano uniti gli atomi nelle sostanze reagenti si spezzano e si riformano secondo nuove combinazioni. Le nuove configurazioni atomiche che si generano costituiscono i prodotti finali della reazione.
Ovviamente durante tali trasformazioni il numero totale di atomi di ciascun elemento chimico non varia, anche se si trova diversamente combinato nei prodotti rispetto ai reagenti (principio della conservazione della materia).
Una reazione chimica viene simbolicamente
rappresentata mediante un'equazione chimica. A primo membro
troviamo le formule dei reagenti, mentre a secondo membro le formule dei
prodotti di reazione, tutte separate dal segno di addizione (+). Il segno di
eguaglianza tra i due membri (=) viene sostituito dalla freccia di reazione ( ), se la reazione si completa e tutti i reagenti si trasformano nei
prodotti o dalla doppia freccia di
reazione (![]() ), se si tratta di un equilibrio chimico e la reazione forma una
miscela in equilibrio di reagenti e prodotti.
), se si tratta di un equilibrio chimico e la reazione forma una
miscela in equilibrio di reagenti e prodotti.
 |
| Appunti su: simbologia chimica, tesina simboli in chimica, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |