 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2334 | Gradito: |
Leggi anche appunti:Reazioni di secondo ordine (cinetiche di secondo ordine)Reazioni di secondo ordine (cinetiche di secondo ordine) Presentano una cinetica Il gas naturaleIl gas naturale Il gas naturale è un combustibile di origine fossile, La chimica organica: gli idrocarburiLA CHIMICA ORGANICA: GLI IDROCARBURI La chimica organica si occupa |
 |
 |
Il pH della soluzione può avere notevole influenza sul potenziale di un semielemento. Ciò avviene per tutti i semielementi nei cui equilibri compaiono ioni H+ oppure OH-. Di particolare interesse risulta la dipendenza dal pH dei potenziali dell'idrogeno e dell'ossigeno.
Idrogeno
La reazione di riduzione degli ioni H+ presenti nelle soluzioni acquose può liberare idrogeno gassoso H2 secondo la seguente semireazione
2H+ + 2e D H2 E°(H+/H2) = 0 V
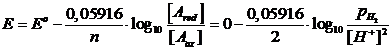
![]()
![]()
Se poi consideriamo una pressione parziale dell'Idrogeno pari ad 1 atm, essendo log 1 = 0, la relazione diventa
![]()
Si tenga infine presente che per concentrazioni di ioni H+ molto piccole (pH alti) l'eventuale formazione di H2 appare difficilmente spiegabile in base alla sola scarica degli ioni H+. Si preferisce in tal caso considerare la semireazione, equivalente a quella appena trattata, di riduzione delle molecole di acqua.
2H2O + 2e D H2 + 2OH- E°(H2O/ H2) = -0,828 V
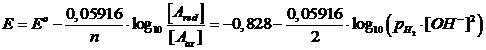
(si noti come la concentrazione dell'acqua, considerata costante, non compaia)
![]()
![]()
e, considerando una pressione parziale dell'Idrogeno pari ad 1 atm, la relazione diventa
![]()
ed, essendo pOH = 14 - pH
![]()
la quale fornisce risultati identici alla precedente
Ossigeno
La reazione di ossidazione degli ioni OH- presenti nelle soluzioni acquose può liberare ossigeno gassoso O2 secondo la seguente semireazione
4OH- D O2 + 2H2O + 4e E°(O2/OH-) = + 0,401 V (potenziale di riduzione)
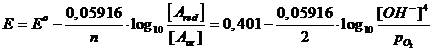
(si noti come la concentrazione dell'acqua, considerata costante, non compaia)
![]()
![]()
Se poi consideriamo una pressione parziale dell'Ossigeno pari ad 1 atm, essendo log 1 = 0, la relazione diventa
![]()
ed, essendo pOH = 14 - pH
![]()
Si tenga infine presente che per concentrazioni di ioni OH- molto piccole (pH bassi) l'eventuale formazione di O2 appare difficilmente spiegabile in base alla sola scarica degli ioni OH-. Si preferisce in tal caso considerare la semireazione, equivalente a quella appena trattata, di ossidazione delle molecole di acqua.
2H2O D O2 + 4H+ + 4e E°( O2/H2O) = +1.229 V (potenziale di riduzione)
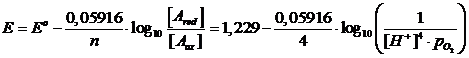
(si noti come la concentrazione dell'acqua, considerata costante, non compaia)
![]()
![]()
Se poi consideriamo una pressione parziale dell'Ossigeno pari ad 1 atm, la relazione diventa
![]()
la quale fornisce risultati identici alla precedente
Acqua (Ossigeno + Idrogeno)
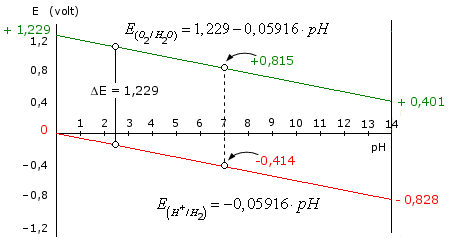
I potenziali di riduzione dell'Ossigeno e dell'Idrogeno presentano, come abbiamo appena visto, una medesima dipendenza dal pH, variando di 0,05916 V per ogni punto di pH. Di conseguenza la differenza tra i due potenziali, che corrisponde alla reazione di sintesi dell'acqua dai suoi elementi, risulta indipendente dal pH, presentando sempre il medesimo valore costante pari a 1,229 V.
Consideriamo infatti le due seguenti semireazioni di riduzione (con il potenziale espresso in funzione del pH ad 1 atm)
O2 + 4H+ + 4e → 2H2O ![]()
2H+
+ 2e → H2 ![]()
Scriviamo la seconda come semireazione di ossidazione e sommiamole (dopo aver moltiplicato per 2 la seconda per bilanciare gli elettroni scambiati) per ottenere la reazione redox di sintesi dell'acqua
O2 + 4H+ + 4e → 2H2O +
2H2→ 4H+ + 4e =
───────────────────
O2 + 2H2 → 2H2O E = 1,229 V
Il potenziale della reazione complessiva si ottiene sommando il potenziale di riduzione della prima al potenziale di riduzione della seconda cambiato di segno (essendo scritta come una ossidazione)
![]()
La reazione di sintesi dell'acqua presenta dunque un potenziale costante di 1,229 V, indipendente dal pH della soluzione.
Si noti infatti che i potenziali di riduzioni delle due semireazioni, espressi in funzione del pH ad 1 atm, vengono entrambi descritti da una relazione lineare (retta) in funzione del pH. Le due rette presentano la medesima pendenza pari a - 0,05916 e sono dunque parallele. La differenza tra i valori delle ordinate (ΔE) per una medesima ascissa (pH) rimane costante.
Esempio
Calcolare la fem a 25°C della pila costruita utilizzando i seguenti due elettrodi
Pt│H2(g, 1 atm)│H+ (aq, pH = 4)
Ag(s) │ Ag+ (aq, 0.025 M) E°(Ag+/Ag) = +0.799 V
e scrivere la reazione complessiva ed il diagramma di cella
Calcoliamo il potenziale di riduzione dell'elettrodo ad idrogeno a pH = 4 ed 1 atm
![]()
Calcoliamo il potenziale di riduzione della coppia redox Ag+ /Ag
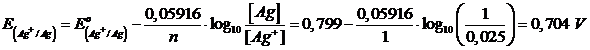
L'elettrodo di argento presenta potenziale di riduzione maggiore e funge da catodo Ag+ + e → Ag
L'elettrodo di idrogeno presenta il potenziale inferiore e funge da anodo H2 → 2H+ + 2e
La reazione redox complessiva sarà pertanto
2Ag+ + H2 → 2Ag + 2H+
la fem della pila è
Ecat - Ean = 0,704 - (0,237) = + 0,941 V
Il diagramma di cella è
(-) Pt│H2(g, 1 atm)│H+ (aq, pH = 4) || Ag+ (aq, 0.025 M) │ Ag(s) (+)
anodo ponte catodo
 |
| Appunti su: appuntimania, ph o potenziale rilasio idrogeno, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |