 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1262 | Gradito: |
Leggi anche appunti:Sfruttamento pacifico dell'energia atomicaSFRUTTAMENTO PACIFICO DELL'ENERGIA ATOMICA 1 LE CENTRALI NUCLEARI A FISSIONE BarioBARIO Il bario è l'elemento chimico di numero atomico 56 e di peso atomico Relazione tra Keq e fem (E°cella)Relazione tra Keq e fem (E°cella) Mentre una pila fornisce corrente elettrica al |
 |
 |
LA VELOCITA' DI REAZIONE
Abbiamo appena parlato di enzimi, e del fatto che sono dei catalizzatori e che influenzano la velocità di reazione. Ma soffermiamoci proprio su questa. Per velocità di reazione si intende la quantità di reagenti che viene consumata nell'unità di tempo, o anche la quantità di prodotti che si forma nell'unità di tempo. La quantità di sostanza consumata o prodotta viene indicata mediante la sua concentrazione molare, mentre il tempo viene espresso in secondi.
![]()
La velocità di reazione dipende da 4 fattori:
natura dei reagenti;
concentrazione dei reagenti;
temperatura;
catalizzatori.
Considerata una reazione generica tra 2 reagenti A e B che formano la sostanza C:
![]() aA + bB cC
aA + bB cC
e supponiamo la temperatura costante, la dipendenza della velocità di reazione dalla concentrazione dei reagenti è data dall'equazione:
![]()
che prende il nome di legge della velocità della reazione. In questa equazione, V rappresenta la velocità di reazione, [A] e [B] rappresentano le concentrazioni molari dei reagenti, m ed n sono 2 esponenti che possono essere interi o frazionari, mentre K è una costante, chiamata costante specifica di velocità di reazione ed il suo valore dipende dalla natura dei reagenti e dalla temperatura. Sia K, sia m ed n, sono calcolati sperimentalmente. Tuttavia, i 2 esponenti m ed n esprimono l'ordine della reazione, in quanto m rappresenta l'ordine della reazione rispetto alla sostanza A, n rappresenta l'ordine di reazione della sostanza B, la loro somma (m n) esprime l'ordine della reazione globale. E' obbligo dire che i valori numerici di m ed n non coincidono necessariamente con i coefficienti stechiometrici a e b della reazione bilanciata presa come modello.
La determinazione dell'ordine di una reazione, è stata effettuata calcolando la velocità iniziale della reazione. Affinché ci siano risultati validi, la velocità di reazione deve essere sufficientemente lenta in modo da ammettere che la velocità misurata sia quella relativa alla concentrazione iniziale dei reagenti. Per questo si ricorre al calcolo differenziale, considerando cosi la velocità di reazione a ogni istante. Partendo cosi dalla reazione:
![]() aA prodotti
aA prodotti
possiamo affermare che, per la legge prima annunciata,:
![]()
e per definizione matematica della velocità di reazione, esprimiamo in modo differenziale:
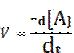
in cui -d[A] rappresenta la diminuzione infinitamente piccola della concentrazione della sostanza [A]. Confrontando queste 2 equazioni possiamo affermare che:
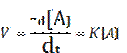
Questa equazione scritta nella forma:
![]()
ci consente di calcolare la variazione globale della concentrazione della sostanza A dopo un intervallo finito di tempo. Se indichiamo con [A0] la concentrazione iniziale della sostanza A (corrispondente cioè a t = 0), è possibile ricavare la [A] della stessa sostanza dopo il tempo t dall'inizio della reazione calcolando l'integrale dell'equazione scritto sopra agli estremi [A0] e [A] e i relativi 0 e t di reazione, e quindi:
![]()
Risolvendo lì integrale abbiamo che:
![]()
![]()
![]()
![]()
e quindi:
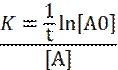
poiché sappiamo che:
ln a = 2,303 log a
possiamo scrivere:
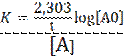
e questa prende il nome di equazione cinetica di una reazione del primo ordine.
Tuttavia, una reazione chimica, oltre che essere studiata dal punto di vista cinetico, e quindi relativamente alla velocità di reazione, può essere studiata dal punto di vista termodinamico, e cioè studiando l'energia libera di una reazione. Essa viene indicata con G, ed è definita per una reazione che viene condotta a temperatura e pressione costante. E' matematicamente legata dalla relazione:
![]()
ed è quindi una funzione di stato, poiché è legata alle funzioni di stato entalpia(H) ed entropia(S), ed alla variabile di stato temperatura(T). La variazione di energia libera (∆G) si usa per definire se una reazione chimica è spontanea o meno. La variazione di entropia del sistema isolato (costituito dal sistema e dall'ambiente circostante), se il processo è spontaneo, dovrà aumentare, cioè:
∆Stot = ∆Ssist + ∆Samb > 0
noi sappiamo che:
![]()
e sostituendo abbiamo che:
∆Stot = ∆Ssist ![]() >
0
>
0
con riferimento al sistema avremo che:
T∆S - ∆H >0 e quindi ∆H - ∆S < 0
Poiché la definizione di energia libera ci dice che:
G = H - TS
se facciamo il differenziale di questa funzione avremo:
dG = dH - TdS - SdT
e poiché la temperatura è costante poniamo che dT = 0 e quindi:
dG = dH - TdS
e per un incremento finito avremo
∆G = ∆H - T∆S
e, per un processo spontaneo, concludiamo che:
∆G < 0
In un processo naturale, cioè spontaneo, che avviene a pressione e temperatura costanti, la grandezza energia libera diminuisce: ed è questo il criterio per stabilire se in queste condizioni una reazione sia spontanea o no. Infatti avremo che:
∆G < 0 Processo spontaneo
∆G = 0 Processo all'equilibrio
∆G > 0 Processo non spontaneo
Il valore assoluto dell'energia libera nei sistemi materiali non è noto, come anche la loro energia interna e la loro entalpia. Per la Termodinamica chimica è importante solo conoscere la variazione di energia libera (∆G) che si verifica quando il sistema passo da uno stato iniziale ad uno finale. Questo perché è la conoscenza di questo valore che ci permette di sapere la spontaneità si un processo, quando questo avviene a temperatura e pressione costante. Calcoliamo adesso la variazione di energia libera si un sistema materiale. Supponiamo un sistema termodinamico passi da uno stato iniziale con energia libera G1 ad uno finale con energia libera G2. Applicando a questa trasformazione il calcolo infinitesimale, ammettendo che il processo sia reversibile, la variazione infinitesima dG del sistema è data dalla relazione:
dG = -dLut + VdP - SdT
ma poiché l'unica forma di lavoro fornito dal sistema è quello di tipo meccanico (PdV), il Lut sarà uguale a 0, e quindi avremo che:
dG = VdP - SdT
Supponendo che il processo sia anche isotermo, oltre che reversibile, e cioè dT = 0, si avrà:
dG = VdP
Dall'equazione di stato, per una mole di gas perfetto si ha che:
PV = RT e quindi V =![]()
e quindi l'equazione diventa:
dG = ![]() dP
dP
A questo punto per valutare la variazione finita di energia libera ∆G, per il passaggio della mole di gas da P0 a P basta integrare questa equazione:
![]()
dato che R è una costante e T è mantenuta costante otteniamo:
![]()
e, infine risolvendo l'integrale definito avremo che:
![]()
Adesso possiamo stabilire uno stato iniziale di riferimento di energia libera da cui iniziare la valutazione dell'energia libera indicata con G°, e ne consegue che in ogni miscuglio gassoso e ad ogni temperatura la pressione parziale è uguale ad 1 atm. Quindi sostituendo avremo che:
G2 = G° + RT lnP
in cui G° prende il nome di energia libera standard.
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |