 |
|
| Appunti superiori |
|
 |
|
| Appunti superiori |
|
| Visite: 2292 | Gradito: |
Leggi anche appunti:Gli agenti mutageniGLI AGENTI MUTAGENI I mutageni sono quegli agenti che causano delle mutazioni FratturaFrattura 1 INTRODUZIONE Rottura parziale o totale di AmenorreaAmenorrea 1 INTRODUZIONE Assenza del flusso mestruale. Tale |
 |
 |
LO STATO SOLIDO
1 PROPRIETà MACROSCOPICHE DEI SOLIDI.
Le proprietà macroscopiche più notevoli dei gas sono la compressibilità e la fluidità. La teoria cinetica molecolare spiega questo comportamento macroscopico sulla base di una rappresentazione microscopica, la cui principale caratteristica è il movimento caotico di molecole indipendenti, molecole che soltanto di rado esercitano una sull'altra forze di un certo rilievo.
Le più notevoli caratteristiche macroscopiche dei solidi cristallini sono, invece, la rigidità, l'incompressibilità e la caratteristica geometria. Per spiegare queste proprietà macroscopiche per mezzo della teoria atomica, è necessario introdurre il concetto di reticolo, cioè di una disposizione di atomi stabilmente ordinata, tenuta insieme da forze considerevoli.
Nei gas e nei solidi si verificano, pertanto, le situazioni estreme del comportamento molecolare. Nei primi, si ha il caos molecolare e forze molecolari trascurabili, negli altri, una disposizione ordinata in cui grandi sono le forze interatomiche.
Nell'ambito dello studio delle proprietà macroscopiche dei solidi, una prima distinzione va fatta fra:
solidi amorfi, come il vetro, la gomma, il plexiglas e ogni altra sostanza plastica, che possiedono soltanto alcune delle proprietà meccaniche che di solito vengono associate al vocabolo "solido" e non si presentano in forme caratteristiche regolari. Essi sono isotropi, ossia le loro proprietà, come la resistenza meccanica, l'indice di rifrazione e la conducibilità elettrica, sono le stesse in tutte le direzioni. Si tratta di una caratteristica che esse hanno in comune con i liquidi e i gas. Inoltre le sostanze amorfe non hanno punti di fusione ben definiti.
solidi cristallini, come il cloruro di sodio, lo zucchero e lo zolfo elementare, che non soltanto possiedono le proprietà della rigidità e dell'incompressibilità, ma si presentano in natura con forme geometriche caratteristiche. Essi sono anisotropi, ossia le loro proprietà meccaniche ed elettriche dipendono in generale dalla direzione lungo la quale esse vengono misurate. L'anisotropia dei cristalli è importante poiché essa, più di ogni altra proprietà macroscopica, fornisce una valida indicazione sull'esistenza di reticoli ordinati di atomi. Per di più i solidi cristallini hanno un punto di fusione ben definito; le proprietà meccaniche di un cristallo mutano soltanto di poco fino ad una certa temperatura, alla quale il cristallo fonde bruscamente, trasformandosi in un liquido.
Lo stato cristallino è facilmente riconoscibile in molti casi, in particolare nei minerali naturali. Gli angoli e le facce ben definite, caratteristiche dei cristalli di quarzo naturale, suggeriscono la considerazione che essi siano l'effetto dell'esistenza di un reticolo interno ordinato. Altre volte le sostanze solide si presentano sotto forma di polvere, zolle, agglomerati che somigliano, in molti casi a sostanze amorfe; ma se si esamina una singola particella al microscopio, è possibile distinguere gli angoli che sono caratteristici di un cristallo. È necessario perciò far attenzione a distinguere fra solidi amorfi e solidi policristallini. Tra questi ultimi vi sono singoli cristalli con i loro reticoli atomici ordinati, ma così piccoli da essere distinguibili soltanto con il microscopio. I metalli si presentano spesso nella condizione policristallina. I limiti dei singoli grani di un cristallo sono evidenti, anche se piuttosto irregolari. Poiché i singoli cristalli sono orientati a caso, un campione metallico può apparire isotropo anche se un cristallo singolo è anisotropo.
In generale, l'accrescimento lento da una soluzione, solo debolmente soprasatura, favorisce la formazione di cristalli grossi. I cristalli formati in laboratorio nel corso di precipitazioni sono invece molto piccoli, poiché essi spesso si formano rapidamente da soluzioni notevolmente soprasature. È possibile però migliorare la qualità di questi cristalli lasciandoli "maturare" in presenza della loro soluzione satura. Durante il processo di maturazione i cristalli imperfetti più piccoli, che sono relativamente instabili, tendono a sciogliersi, ed i cristalli più grandi, più stabili, tendono a crescere. Così, come risultato di un continuo ridisciogliersi e riprecipitare, un precipitato di materiale virtualmente amorfo può essere convertito in una sostanza policristallina.
La forma di un cristallo è caratteristica della sostanza di cui è formato, ma è anche soggetta a qualche influenza da parte delle condizioni di accrescimento. Inoltre l'influenza dell'ambiente può anche essere più determinante: i cristalli sotto l'azione di condizioni esterne, possono assumere numerose forme, ma gli angoli fra due facce caratteristiche sono sempre gli stessi; ciò deve essere determinato da una geometria fissa del reticolo stesso.
2 TIPI DI SOLIDI.
L'esistenza di un reticolo ordinato è responsabile di due delle proprietà macroscopiche caratteristiche dei solidi cristallini: l'anisotropia e la caratteristica geometria. Le caratteristiche più sottili dei solidi debbono, invece, essere in stretto rapporto con la natura delle forze che tengono insieme il reticolo del cristallo.
Di conseguenza, si ritiene utile distinguere tra
solidi ionici,
solidi molecolari,
solidi a struttura covalente,
solidi metallici,
e associare tutto un insieme di proprietà caratteristiche a ciascuno di questi tipi di legame. Lo scopo di questo sistema di classificazione è quello di fornire un criterio per riconoscere e sistemare somiglianze e differenze tra le proprietà dei vari solidi. Se certe proprietà macroscopiche possono essere associate a ciascuno di questi tipi di legame, si potrà eventualmente utilizzare il comportamento macroscopico come strumento diagnostico per determinare il tipo di legame esistente in nuove sostanze. Si deve ricordare, però, che tale schema di classificazione è alquanto arbitrario; possono esservi, infatti, sostanze che non sono chiaramente inseribili in nessuna delle quattro classi.
Cristalli ionici
Nei cristalli ionici le unità ripetitive del reticolo sono frammenti cariche positivamente e negativamente disposti in modo che l'energia potenziale degli ioni nelle posizioni del reticolo è più bassa di quella corrispondente agli ioni separati (per il calcolo dell'energia reticolare dei cristalli ionici vedere il capitolo 3 a pag. 53).
È importante notare che ogni ione di un dato segno occupa una posizione equivalente nel reticolo, e che nel cristallo non vi sono gruppi di atomi o molecole distinti. Infatti ogni ione di un dato segno è legato dalla forza coulombiana a tutti gli ioni di segno opposto nel cristallo. Si tratta di forze elettrostatiche, che sono molto più rilevanti delle normali forze di Van der Waals, per chi l'energia di legame è relativamente elevata.
I cristalli ionici tendono ad essere duri e fragili. Per deformare un cristallo ionico perfetto è necessario che due piani di ioni si spostino l'uno rispetto all'altro. A seconda della natura dei piani che si spostano e della direzione del movimento, uno spostamento può portare ioni della stessa carica l'uno vicino all'altro. Quando ciò si verifica le forze di coesione fra i due piani vengono sostituite da una forte repulsione coulombiana e ne risulta la frattura del cristallo. Vi sono comunque dei piani che possono essere spostati l'uno rispetto all'altro senza portare in opposizione ioni dello stesso segno. Lo spostamento di questi piani l'uno rispetto all'altro è il modo più facile per deformare il cristallo. Persino lungo questa direzione più favorevole la deformazione del cristallo richiede una forza elevata, poiché ogni movimento degli ioni l'uno rispetto all'altro trova resistenza nelle forze coulombiane che tendono a mantenere gli ioni nella posizione che essi hanno nel reticolo.
Un'altra caratteristica propria dei cristalli ionici è che essi sono isolanti elettrici a bassa temperatura e buoni conduttori elettrici, se si trovano allo stato fuso. Difatti nel cristallo perfetto, tutti gli ioni occupano posizioni ben definite; muovendosi dalla sua posizione nel reticolo attraverso il cristallo, uno ione seguirebbe un cammino tortuoso che lo porta vicino a ioni della stessa carica. Nello stato liquido, invece, la disposizione degli ioni è più disordinata e meno densa e il loro moto sotto l'influenza di un campo elettrico è di gran lunga facilitato.
Cristalli molecolari
Nei cristalli molecolari l'unità ripetitiva è un atomo o molecola chimicamente identificabile che non possiede una carica definita. La coesione di questi cristalli è una conseguenza delle forze di Van der Waals che sono di gran lunga più deboli delle forze di attrazione coulombiana fra due ioni e di conseguenza l'energia di legame dei cristalli molecolari è relativamente piccola.
Questi cristalli tendono ad essere piuttosto volatili ed hanno punti di fusione e di ebollizione bassi, poiché è necessaria poca energia per separare le singole molecole. La grandezza delle forze di Van der Waals può, però, variare considerevolmente, secondo il numero degli elettroni e la polarità delle molecole. Anche se è molto facile che un cristallo molecolare sia volatile, non tutti i cristalli molecolari lo sono.
I cristalli molecolari tendono in genere ad essere teneri, compressibili e facilmente deformabili. Anche queste proprietà sono una conseguenza di forze molecolari relativamente deboli e della loro natura non direzionale. Tutte le molecole non polari esercitano un'attrazione l'una sull'altra, la cui grandezza non è molto sensibile all'orientamento molecolare. Così due piani di un cristallo molecolare possono essere spostati l'uno rispetto all'altro senza una significativa diminuzione delle forze di attrazione fra esse. Poiché l'energia delle posizioni intermedie non è maggiore di quella delle posizioni stabili, la deformazione richiede poco dispendio di energia.
I cristalli molecolari sono, in genere, buoni isolati elettrici. Le molecole per sé stesse non hanno carica elettrica effettiva e non possono perciò trasportare l'elettricità. Inoltre il fatto che esistano molecole distinte porta con sé che gli elettroni tendono ad essere localizzati intorno ad un gruppo specifico di nuclei. Di conseguenza, non vi sono particelle cariche sia ioni che elettroni, libere di muoversi in un campo elettrico e capaci di condurre l'elettricità.
Solidi a reticolo covalente
Nei solidi a reticolo covalente tutti gli atomi sono collegati da un sistema continuo di legami covalenti ben definiti a coppie di elettroni.
|
|
Un classico esempio di solido a struttura covalente è rappresentato dal diamante, in cui ogni atomo di carbonio forma legami covalenti con altri quattro atomi posti ai vertici di un tetraedro regolare: tutti gli atomi di carbonio sono legati fra loro mediante legami s localizzati, formati per sovrapposizione degli orbitali ibridi sp3. La disposizione degli atomi di carbonio nel diamante è mostrata nella figura di lato. Essa può essere descritta come una struttura cubica a facce centrate (vedremo meglio il significato di tale struttura) con atomi di carbonio addizionali situati a metà fra vertici alterni ed il centro del cubo.
Il solido deve essere considerato come una enorme molecola dato che la trama dei legami covalenti è estesa a tutto il solido. Ne deriva per questi cristalli un'elevata durezza ed un alto punto di fusione.
|
|
In alcuni cristalli vi sono reticoli covalenti infiniti bidimensionali. L'esempio più noto è la struttura della grafite. Questa è una modificazione cristallina del carbonio, la cui struttura è determinata da una ibridizzazione sp2 degli atomi di carbonio, anziché sp3 come nel diamante. Ciascun atomo di carbonio è legato in modo covalente ad altri tre in modo tale che tutti gli atomi giacenti in un singolo piano sono collegati secondo una struttura a lamina. Nel cristallo di grafite, queste infinite lamine di atomi sono riunite in una struttura a strati nella quale le forze di attrazione tra i diversi strati sono del tipo Van der Waals. Tale struttura può essere descritta come una struttura esagonale regolare.
I solidi a reticolo covalente, come quelli ionici, sono estremamente volatili e hanno punti di fusione molto elevati. Inoltre sono tra le sostanze più dure e più incomprimibili. Infatti in essi un atomo centrale stabilisce forti legami covalenti con i suoi vicini solo se essi occupano certe posizioni ben definite. Perciò qualunque deformazione notevole di un reticolo solido covalente implica la rottura di legami covalenti; ciò richiede notevoli quantità di energia.
Per quanto riguarda la volatilità e le proprietà meccaniche, i cristalli a reticolo covalente infinito sono molto simili ai solidi ionici. Perciò, il fatto che una sostanza sia molto dura ed abbia un punto di fusione e di ebollizione elevato, non dice quale tipo di legame esista nel cristallo. Si possono però usare le proprietà elettriche per distinguere tra solidi a reticolo ionico e solidi a reticolo covalente. Entrambi i tipi sono isolanti elettrici a bassa temperatura. Le sostanze ioniche diventano buone conduttrici dell'elettricità solo a temperature al di sopra del loro punto di fusione. La conducibilità di un solido a reticolo covalente è in generale molto piccola e, mentre essa può aumentare con il crescere della temperatura, non aumenta bruscamente se la sostanza viene fusa.
Cristalli metallici
Nei solidi metallici gli atomi hanno un numero di coordinazione elevato e sono disposti come si disporrebbero delle sfere in modo da lasciare il minore volume vuoto possibile (impacchettamento compatto).
La struttura elettronica dei metalli differisce da quella delle altre sostanze nel fatto che gli elettroni di valenza degli atomi del metallo non sono localizzati in ciascun atomo, ma sono di proprietà generale del cristallo nel suo complesso: si può dire che un metallo è un insieme di ioni positivi immersi in un "mare" di elettroni mobili.
L'elevata conduttività elettrica dei metalli si spiega facilmente se gli elettroni di valenza sono liberi di muoversi in un campo elettrico applicata. L'elevata conduttività termica dei metalli è anch'essa conseguenza degli elettroni liberi che possono acquistare elevata energia termica cinetica, muoversi rapidamente attraverso il cristallo e trasportare calore.
Poiché non vi sono legami localizzati altamente direzionali, un piano di atomi può essere spostato rispetto all'altro con dispendio di energia relativamente ridotto. Poiché gli elettroni di valenza non sono localizzati ed il legame metallico non è fortemente direzionale, non è necessario rompere completamente le forze di legame quando il cristallo viene piegato.
3 RETICOLI CRISTALLINI E CELLE ELEMENTARI.
Il modo con cui si realizza la disposizione regolare degli atomi all'interno di un cristallo si chiama struttura del cristallo.
La disposizione regolare degli atomi in un cristallo si genera per ripetizione periodica tridimensionale di un'unità di base.
Si ha ripetizione periodica lungo una certa direzione quando un dato motivo si ripete identico per successivi spostamenti di lunghezza a lungo una direzione data. Un esempio di ripetizione periodica è riportato nella figura seguente: il filare dei motivi rappresentati definisce un reticolo lineare. Parametro del reticolo è la distanza elementare a, detto periodo d'identità lungo la direzione del filare.
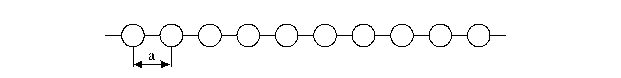
Supponiamo ora che lo stesso motivo venga ripetuto periodicamente in due direzioni diverse, formanti un angolo g fra loro, con successivi spostamenti di lunghezza a e b, rispettivamente. La disposizione risultante dei motivi così ripetuti è riportata nella figura seguente. Essa costituisce un reticolo piano: parametri di tale reticolo sono le due distanze elementari a e b, detti periodi d'identità, e l'angolo g tra queste ultime.

In modo analogo si avrà un reticolo spaziale quando il motivo si ripete periodicamente lungo le tre direzioni non complanari. I tre periodo d'identità a, b, c lungo le tre direzioni e gli angoli a (tra b e c), b (tra a e c), g (tra a e b), costituiscono le costanti reticolari del reticolo spaziale. L'elemento di volume definito dagli spigoli a, b, c si chiama cella elementare.
4 LE STRUTTURE CRISTALLINE Più COMUNI.
Esistono alcuni tipi di strutture che non soltanto hanno caratteristiche geometriche semplici, ma si presentano di frequente tra i cristalli naturali.
Reticolo cubico semplice
Nella figura seguente è mostrata la cella elementare di un cristallo cubico semplice.
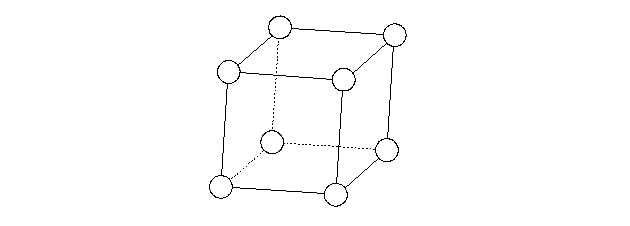
Per traslazione della cella nelle tre direzioni assiali si genera l'intero cristallo. Ogni atomo, situato ai vertici della cella cubica, è in comune con altre otto celle elementari contigue. Perciò nella cella elementare è contenuto 8/8=1 atomo. Il numero di coordinazione è sei, cioè ogni atomo è a contatto con altre sei atomi.
La grande scarsità di esempi di strutture di questo tipo è molto probabilmente dovuta al fatto che nel reticolo viene lasciato molto spazio vuoto. Difatti se le sfere della figura venissero ingrandite in modo che si toccano, è facile rendersi conto che solo poco più della metà del volume della cella elementare è occupato dalle sfere.
Reticolo cubico a corpo centrato
Nella figura seguente è mostrata la cella elementare di un reticolo cubico a corpo centrato.
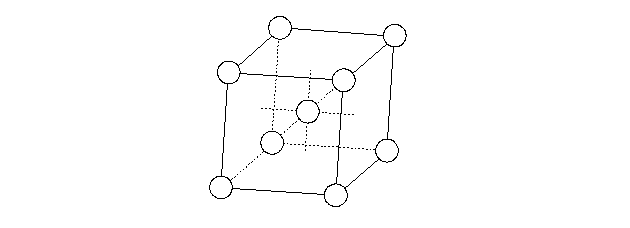
Essa è costituita dagli atomi di un dato elemento posti ai vertici di un cubo e da un atomo dello stesso elemento posto al centro del cubo. Nella cella elementare sono contenuti due atomi, 8/8 ai vertici e 1 al centro. Il numero di coordinazione di questa struttura è otto. L'atomo al centro della cella elementare è equidistante dagli otto atomi ai vertici del cubo. Tutti gli atomi della struttura hanno lo stesso intorno.
Reticolo cubico a facce centrate
Nella figura seguente è mostrata la cella elementare di un reticolo cubico a facce centrate.
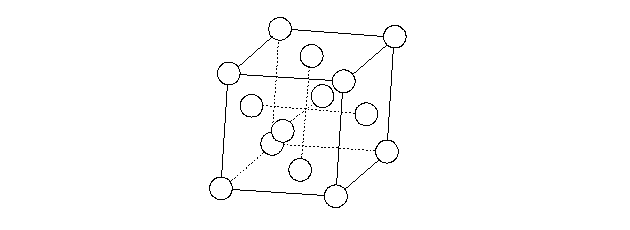
Essa è costituita dagli atomi di un dato elemento posti ai vertici di un cubo e da quattro atomi dello stesso elemento posti ciascuno al centro di una faccia del cubo. Nella cella elementare sono contenuti quattro atomi. Il numero di coordinazione di questa struttura è dodici.
5 DIFETTI IN STRUTTURE SOLIDE.
Nella trattazione finora fatta si sono tacitamente ammesse strutture reticolari perfette per i solidi cristallini. In realtà, i cristalli che si trovano in natura hanno un notevole numero di difetti. Questi difetti hanno una influenza importante e talvolta determinante sulle proprietà dei solidi.
Imperfezioni del reticolo vengono classificate secondo le caratteristiche geometriche in:
difetti di punto, che interessano soltanto uno o due siti del reticolo;
difetti di linea, che sono alterazioni o spostamenti di una fila di siti reticolari;
difetti di piano, che risultano quando un piano di siti è imperfetto.
Difetti di punto
I due tipi più comuni di difetti di punto che si presentano in un cristallo di un solo tipo di atomi o molecole sono:
se manca un atomo in un sito del reticolo, vi è una lacuna; un atomo fuori posto è chiamato autointerstiziale;
un atomo estraneo che occupa un sito reticolare è chiamato impurezza sostituzionale, mentre un sito fuori posto è detto impurezza interstiziale.

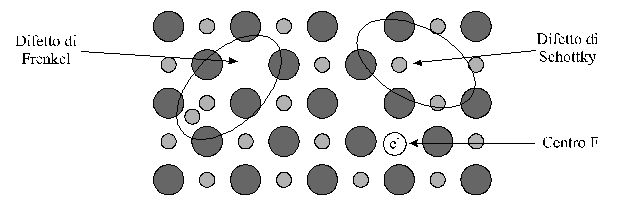
Nei solidi ionici si riscontrano certi casi speciali di difetti di punto.
Difetti di Schottky: una lacuna in un sito cationico è accompagnata spesso da una lacuna nel sito anionico vicino. Tali lacune accoppiate catione-anione mantengono la neutralità elettrica del cristallo; la loro formazione richiede un'energia relativamente piccola.
Difetto di Frenkel: un catione abbandona la sua posizione nel reticolo ed assume una posizione interstiziale. Anche questo processo mantiene la neutralità elettrica globale. La formazione di tali difetti richiede un'energia relativamente piccola, se gli anioni sono grandi ed il catione è piccolo.
Centro F (da Farbe che in tedesco significa "colore"): Una semplice lacuna anionica in un cristallo ionico genera un eccesso locale di carica positiva. Un elettrone può migrare a questo sito e venire legato, prendendo, in effetti, il posto dello ione negativo assente. La presenza di un certo numero di tali difetti conferisce colore al cristallo, altrimenti incolore.
Difetti di linea
Esistono essenzialmente due tipi di difetti di linea:
in una dislocazione a cuneo è presente un piano extra di atomi. Il resto del reticolo, lungo lo spigolo di questo piano è alternativamente compresso o espanso in modo da accoglierlo;
in una dislocazione a vite, parte di un insieme di piani reticolari ha spostato una o più celle elementari rispetto ai loro piani reticolari vicini.
Difetti di piano
L'interfaccia tra due microcristalli orientati in modo diverso è un esempio di difetto di piano o di superficie. Poiché i piani del reticolo di due tali microcristalli vicini tendono ad essere orientati a caso, gli atomi di superficie dei due cristalli avranno anch'essi un orientamento irregolare. Di conseguenza, vi sarà una regione di transizione tra i cristalliti, in cui la distanza atomica sarà irregolare.
6 LEGAMI METALLICI.
Vi sono due particolari caratteristiche significative che sono comuni a praticamente tutti gli atomi degli elementi metallici:
le energie di ionizzazione degli atomi liberi degli elementi metallici e semimetallici sono generalmente piccole, quasi sempre meno di 220 kcal/mole, fatta eccezione per il mercurio, la cui energia di ionizzazione è 240 kcal/mole. Invece gli atomi dei non metalli hanno di solito energie di ionizzazione maggiori di 220 kcal/mole;
il numero dei suoi elettroni di valenza è minore del numero dei suoi orbitali di valenza.
Si esaminino le conseguenze di queste caratteristiche per vedere come esse siano collegate con il legame metallico.
Una bassa energia di ionizzazione significa che un atomo ha una relativamente piccola attrazione per i suoi elettroni di valenza. Poiché la stabilità di un legame covalente deriva dall'abbassamento di energia potenziale di cui risentono gli elettroni di valenza quando si muovono sotto l'influenza di più di un nucleo, se ciascuno dei due atomi che vengono legati ha un'attrazione piuttosto piccola per gli elettroni, non ci si può aspettare un notevole abbassamento di energia dei loro elettroni di valenza nella molecola. Non si dovrebbe quindi essere sorpresi di trovare che gli atomi degli elementi metallici formano fra di loro legami a coppia di elettroni relativamente deboli.
Mentre l'interazione di un atomo metallico con un solo altro atomo spesso non porta ad un significativo abbassamento di energia, è possibile che una stabilità maggiore possa essere raggiunta se gli elettroni di valenza di un atomo si muovono sotto l'influenza di parecchi altri nuclei. La seconda caratteristica dei metalli, cioè meno elettroni di valenza di quanto non siano gli orbitali di valenza, rende possibile questo tipo di interazione.
|
|
Per i metalli si può ipotizzare una struttura formata da un insieme ordinato di "noccioli", cioè ioni positivi circondati da un "fluido" formato dagli elettroni di valenza di tutti gli atomi. Tali elettroni si disporranno nelle vicinanze delle cariche positive in zone ad energia via via crescente formando un reticolo più o meno mobile esteso su tutto il cristallo che lega gli ioni.
Molte proprietà fisiche dei metalli possono essere messe in relazione col tipo di struttura ipotizzata; ad esempio l'elevata conducibilità viene spiegata con la mobilità del reticolo elettronico.
Modello a bande
Quando più atomi isolati si sistemano ordinatamente in un reticolo cristallino, gli elettroni dei singoli atomi interagiscono tra loro in modo che, alla distanza di legame, ciascun sottolivello di ciascun atomo, modifica lievemente la sua energia.
Ad esempio se consideriamo la formazione della molecola Li2 da due atomi di litio, possiamo osservare che portando gli atomi vicini, i livelli di energia degli elettroni atomici 2s si separano in due nuovi livelli, chiamati s2s e s*2s, che corrispondono agli orbitali molecolari di legame e di antilegame. In Li2, entrambi gli elettroni occupano l'orbitale s2s, ma qualsiasi elettrone nell'orbitale s2s o s*2s appartiene alla molecola nel suo complesso. D'altra parte, gli elettroni 1s sono fortemente localizzati vicino a particolari atomi, dato che la loro energia totale è minore di quella necessaria ad oltrepassare la barriere di energia potenziale che esiste fra i due atomi.
In generale, quando N atomi vengono avvicinati, vi sono N orbitali molecolari che derivano dalla sovrapposizione di orbitali 2s soltanto, e le energie di questi orbitali formano una banda di livelli molto vicini l'un l'altro. Altri orbitali si formano dalla sovrapposizione degli orbitali atomici 2p, e le energie di questi si trovano pure in una densa banda unita senza interruzione alla banda formata dagli orbitali 2s. Qualsiasi elettroni in uno di questi orbitali appartiene al cristallo nel suo complesso, e serve per tenere assieme molti nuclei.
Quindi a ciascun sottolivello degli atomi isolati corrisponderà nel cristallo una banda di livelli energetici molto vicini formata dall'insieme degli stessi sottolivelli degli atomi isolati. Dato il numero elevatissimo di atomi, le bande sono costituite da una serie così fitta di livelli da poter essere considerate continue.
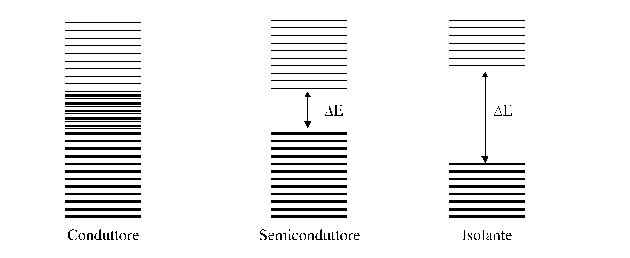
Nei cristalli metallici costituiti da atomi con i livelli energetici più esterni parzialmente pieni, la banda di energia più esterna, detta banda di valenza, è soltanto parzialmente occupata da elettroni. Gli elettroni sono quindi in grado con pochissima energia di migrare attraverso il cristallo utilizzando la parte vuota della banda di valenza che si comporta come banda di conduzione. I solidi metallici sono pertanto buoni conduttori di elettricità.
Nei cristalli covalenti ed in quelli ionici gli atomi hanno i livelli energetici più esterni completamente pieni per cui la banda di valenza è completamente occupata da elettroni. La banda di energia immediatamente superiore a quella di valenza, detta banda di conduzione, è invece completamente vuota. Se la differenza di energia fra le due bande è molto elevata, gli elettroni non possono passare dalla banda di valenza a quella di conduzione ed in tal caso il solido si comporta da isolante. Se l'intervallo è modesto, il salto di qualche elettrone dalla banda di valenza a quella di conduzione diviene possibile ed il solido si comporta da semiconduttore.
Un aumento di temperatura da un lato aumenta il numero di elettroni capaci di passare dalla banda di valenza a quella di conduzione, dall'altro aumenta la vibrazione degli atomi nel reticolo che interferiscono con la migrazione degli elettroni nel reticolo. Il primo effetto prevale nei semiconduttori per cui la conduttività di questi ultimi aumenta al crescere della temperatura. Il secondo effetto prevale nei metalli la cui conduttività diminuisce al crescere della temperatura.
7 CENNI SULLO STATO VETROSO.
Alcuni liquidi, a causa della loro elevata viscosità, a temperature prossime a quella di fusione, se raffreddati con velocità sufficientemente elevata, mantengono "congelata" una struttura per molti aspetti analoga a quella dei liquidi di partenza ossia, pur mantenendo una struttura disordinata tipica dei liquidi, assumono un volume proprio tipico dei solidi. Tale struttura, nota come stato vetroso, è instabile perché può diminuire la sua energia libera trasformandosi in un sistema cristallino.
Il vetro, pertanto, è un solido amorfo che non presenta un ordine ripetitivo regolare delle particelle che lo costituiscono. Il comune vetro è ottenuto dalla fusione di una miscela di silice SiO2, carbonato di calcio CaCO3 e carbonato di sodio Na2CO3. Durante la fusione queste sostanze reagiscono dando origine ad un liquido di elevata viscosità costituito da ossianioni polimerici del silicio e ioni calcio Ca++ e sodio Na+. A causa dell'elevata viscosità e della complessità della struttura cristallina dei composti ionici formati da tali ioni, questo liquido per raffreddamento "congela" in una struttura vetrosa.
 |
| Appunti su: caratteristiche macroscopiche dei solidi, |
|