 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2219 | Gradito: |
Leggi anche appunti:"Caratterizzazione (+)Limonane, a-Pinene, n-Ottene""Caratterizzazione (+)Limonane, a-Pinene, n-Ottene" Dati. L'industria chimicaL'INDUSTRIA CHIMICA L'industria chimica prevede, partendo da materiali che Produzione del vetroProduzione del vetro lI vetro è una miscela di silicati complessi |
 |
 |
Spesso le reazioni redox vengono rappresentate in forma ionica netta, riportando solo gli ioni e le molecole indissociate nelle quali avviene un cambiamento del numero di ossidazione ed eventualmente, se necessario ioni H+, OH- e molecole di H2O a seconda che la reazione avvenga in ambiente acido, basico o neutro.
Quando una redox viene proposta in forma ionica è necessario specificare se essa decorre in ambiente acido, basico o neutro. Più correttamente, se la reazione decorre in ambiente acido dovrebbe comparire uno ione H+ sopra la freccia di reazione, mentre se decorre in ambiente basico dovrebbe comparire uno ione OH- sopra la freccia di reazione.
La strategia di bilanciamento prevede
bilancio elettroni (conservazione degli elettroni scambiati)
bilancio cariche (conservazione della carica elettrica)
bilancio masse (conservazione della massa)
Esempio 1 - redox in forma ionica in ambiente acido
I- + MnO4- ![]() I2 + Mn2+
I2 + Mn2+
si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell'elemento che reagisce. Nell'esempio il Manganese diminuisce il suo nox (riduzione) da +7 a +2, con una variazione di 5 elettroni, mentre lo Iodio passa da -1 a 0 (ossidazione) con una variazione di 1 elettrone
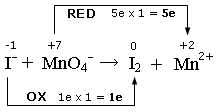
Si scrivono le semireazioni di ossidazione e di riduzione. Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell'esempio che segue dobbiamo bilanciare lo Iodio ed aggiornare a 2 il numero di elettroni persi durante la semireazione di ossidazione (1 elettrone per ciascun atomo di Iodio)
I- → I2 + e
(ossidazione)
MnO4- + 5e → Mn2+
(riduzione)
Si scrivono le semireazioni di ossidazione e di riduzione. Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell'esempio che segue dobbiamo bilanciare lo Iodio ed aggiornare a 2 il numero di elettroni persi durante la semireazione di ossidazione (1 elettrone per ciascun atomo di Iodio)
I- → I2 + e
(ossidazione)
MnO4- + 5e → Mn2+
(riduzione)
Il rapporto di scambio elettronico tra le due semireazioni è 2/5 (per ogni 2 elettroni persi dalla semireazione di ossidazione vi sono 5 elettroni acquistati dalla semireazione di riduzione)
Si usa rapporto di scambio elettronico per il bilancio degli elettroni. Si usa il numero di elettroni trovato in una semireazione per moltiplicare l'altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti. Si sommano quindi le due semireazioni
(2I- → I2 + 2e) x 5 = I- → I2 + 10e
(MnO4- + 5e → Mn2+) x 2 = MnO4- + 10e → Mn2+
![]()
10I- + 2MnO4- → 5I2 + 2Mn2+
Si esegue il bilancio di carica con ioni H+ (ambiente acido) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. La reazione presenta 12 cariche negative tra i reagenti e 4 cariche positive tra i prodotti
![]()
![]()
10I- + 2MnO4- → 5I2 + 2Mn2+
12 cariche Θ 4 cariche
![]()
![]()
Aggiungiamo 16 ioni H+ tra i reagenti per bilanciare la carica e 8 molecole d'acqua tra i prodotti per ribilanciare la massa
10I- + 2MnO4- + H+→ 5I2 + 2Mn2+ + 8H2O
4 cariche 4 cariche
Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione.
Esempio 2 - redox in forma ionica in ambiente basico
MnO4- + NH3 ![]() MnO2 + NO3-
MnO2 + NO3-
si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell'elemento che reagisce. In questo caso si tratta di una redox in cui il Manganese (nox = +7) si riduce, diminuendo il suo numero di ossidazione a +4 (Δnox = 3e) e l'Azoto (-3) si ossida, aumentando il suo numero di ossidazione a +5 (Δnox = 8e).
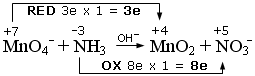
si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell'esempio che segue sia l'Azoto che il Manganese risultano già bilanciati.
NH3 → NO3- + 8e
(ossidazione)
MnO4- + 3e → MnO2
(riduzione)
Il rapporto di scambio elettronico tra le due semireazioni è 8/3 (per ogni 8 elettroni persi dalla semireazione di ossidazione vi sono 3 elettroni acquistati dalla semireazione di riduzione)
Usiamo il rapporto di scambio elettronico per il bilancio degli elettroni. Si usa il numero di elettroni trovato in una semireazione per moltiplicare l'altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti. Si sommano quindi le due semireazioni
(NH3 → NO3- + 8e) x 3 = NH3 → NO3- + 24e
(MnO4- + 3e → MnO2 ) x 8 = MnO4- + 24e → MnO2
![]()
MnO4- + NH3 → MnO2 + NO3-
Si esegue il bilancio di carica con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
![]()
![]() La reazione presenta 3 cariche
negative tra i prodotti e 8 cariche negative tra i reagenti
La reazione presenta 3 cariche
negative tra i prodotti e 8 cariche negative tra i reagenti
MnO4- + NH3 → MnO2 + NO3-
8 cariche Θ 3 cariche Θ
![]()
![]() Aggiungiamo 5 ioni OH- tra
i prodotti per bilanciare la carica e 2 molecole d'acqua tra i prodotti per
ribilanciare la massa
Aggiungiamo 5 ioni OH- tra
i prodotti per bilanciare la carica e 2 molecole d'acqua tra i prodotti per
ribilanciare la massa
8MnO4- + 3NH3 → 8MnO2 + 3NO3- + OH- + H2O
8 cariche Θ 8 cariche Θ
Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione (in questo caso non è necessario).
Esempio 3 - Dismutazione in forma ionica in ambiente basico
P4 ![]() H2PO2- + PH3
H2PO2- + PH3
si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell'elemento che reagisce. In questo caso si tratta di una dismutazione in cui il Fosforo elementare (nox = 0) si ossida, aumentando il suo numero di ossidazione a +1 (Δnox = 1e) e si riduce a -3, diminuendo il suo numero di ossidazione a -3 (Δnox = 3e).
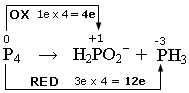
si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti.
P4 → H2PO2- + 4e
(ossidazione)
P4 + 12e → PH3
(riduzione)
bilanciamo gli atomi di Fosforo
P4 → H2PO2- + 4e
P4 + 12e → PH3
rapporto di scambio elettronico: 4/12 = 1/3
Usiamo il numero trovato in una semireazione per moltiplicare l'altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti (bilancio elettronico). Si sommano quindi le due semireazioni
(P4 → 4H2PO2- + 4e) x 3 = 3P4 → 12H2PO2 + 12e
(P4 + 12e → 4PH3 ) x 1 = P4 + 12e → 4PH3
![]()
4P4 → 12H2PO2- + 4PH3
Semplifichiamo i coefficienti
P4 → 3H2PO2- + PH3
Si esegue il bilancio di carica con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi.
La reazione presenta 2 cariche negative tra i prodotti e nessuna carica tra i reagenti
![]()
P4 → 3H2PO2- + PH3
3 cariche Θ
![]()
![]() Aggiungiamo 3 ioni OH- tra
i reagenti per bilanciare la carica e 3 molecole d'acqua tra i reagenti per
ribilanciare la massa.
Aggiungiamo 3 ioni OH- tra
i reagenti per bilanciare la carica e 3 molecole d'acqua tra i reagenti per
ribilanciare la massa.
P4 + OH- + H2O → 3H2PO2- + PH3
3 cariche Θ 3 cariche Θ
 |
| Appunti su: strategie per bilanciare reazione, https:wwwappuntimaniacomscientifichechimicastrategia-di-bilanciamento-di-84php, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |