 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 5599 | Gradito: |
Leggi anche appunti:I modelli atomici di Thomson e RutherfordI modelli atomici di Thomson e Rutherford Agli inizi del '900 vi erano dunque Acidi e basi secondo ArrheniusAcidi e basi secondo Arrhenius Nel 1887 il chimico svedese Svante Arrhenius I miscugliI MISCUGLI OBIETTIVO: separare i componenti dei miscugli MATERIALE: polvere |
 |
 |
Spesso la struttura di una molecola la si può rappresentare
con formule diverse, tutte ovviamente valide, che differiscono unicamente
per la posizione di coppie elettroniche.
Questa possibilità la avevamo già incontrata all'inizio del capitolo, a
proposito della rappresentazione della molecola del monossido di carbonio,
facendo un primo esempio del fenomeno della risonanza.
Adesso che conosciamo le regole da seguire nella scrittura di una formula, possiamo approfondire l'argomento. È tuttavia necessario puntualizzare prima un'ulteriore regola, peraltro del tutto naturale, cui occorre sempre prestare la massima attenzione:
|
Nella rappresentazione di una formula di struttura, si deve rispettare il numero totale di elettroni presenti negli strati di valenza di tutti gli atomi della formula. |
Proviamo ora a scrivere nuovamente la formula di un composto che abbiamo già preso in considerazione a proposito dell'ibridazione sp2: lo ione nitrito, NO2-.
Lo ione nitrito era stato rappresentato come nella struttura qui sotto:
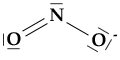
Tuttavia, non c'è nessun motivo particolare per cui il doppio legame N-O sia con l'ossigeno di sinistra. Una rappresentazione dello ione, altrettanto valida e corretta, è infatti quella che segue:
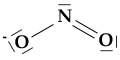
Qual è allora la vera struttura dello ione? Nessuna delle due. La molecola reale è una 'via di mezzo' tra le due rappresentazioni*, che vengono definite formule limite o canoniche.
La molecola reale è un ibrido di risonanza che ha il 50% delle caratteristiche di una formula e il 50% delle caratteristiche dell'altra. In accordo con la teoria della risonanza, la molecola reale si può rappresentare con una freccia a due punte posta fra le formule limite:

Tutto ciò implica che il doppio legame N-O della formula (I) sia in realtà intermedio ad un legame semplice e un legame doppio (ordine di legame 1.5) e che il legame semplice della stessa formula sia anch'esso intermedio a un legame semplice e un legame doppio. Lo stesso discorso vale per la formula (II). In sostanza, i due legami N-O sono perfettamente equivalenti, come è dimostrato anche dai dati sperimentali circa lunghezze e energie di legame.
Nel caso dello ione nitrito, quello che si definisce il 'contributo' di ogni singola formula di risonanza all'ibrido, è paritario; lo si può intuire facilmente, considerando la perfetta equivalenza delle due formule. Ma non sempre è così: spesso ogni singola formula limite dà un contributo diverso all'ibrido (come accade ad esempio nella risonanza del monossido di carbonio, di cui abbiamo già parlato ed è assai comune il caso in cui le formule limite siano più di due.
Vedremo nel paragrafo conclusivo quali siano i criteri che ci consentono di 'pesare' qualitativamente i contributi delle varie formule di un ibrido di risonanza. Prima è però opportuno introdurre un aspetto particolare correlato con il fenomeno della risonanza: l'energia di risonanza.
*) La risonanza si indica anche con il termine mesomeria, che letteralmente significa 'struttura intermedia'.
Una delle conseguenze più importanti del fenomeno della risonanza, è il fatto che l'energia potenziale della molecola reale è sempre minore di quella della formula limite a più bassa energia.
Tale
differenza di energia si definisce energia di risonanza ed è un indice
della stabilità della molecola.
Ovviamente, mentre è possibile misurare sperimentalmente l'energia potenziale
della molecola reale, le energie delle formule limite (che non esistono nella
realtà), possono essere solo calcolate su basi teoriche.
Questo aspetto assume particolare rilievo nel caso in cui una molecola sia rappresentata da più formule risonanti energeticamente equivalenti, quando cioè il loro contributo all'ibrido sia paritario o molto simile. In tal caso, la molecola reale è notevolmente più stabile di quanto lo siano, teoricamente, le singole formule limite.
Questo effetto, che si indica come stabilizzazione per risonanza, è tanto più marcato, quanto più numerose sono le possibili formule di risonanza e quanto più equivalente è il loro contributo all'ibrido. Quindi, maggiore è l'energia di risonanza, maggiore è la stabilità della molecola reale.
Vedremo che dal punto di vista pratico, l'applicazione del concetto di risonanza può limitarsi alla descrizione delle molecole contenenti legami multipli. Sono infatti gli elettroni π e i doppietti solitari che giocano un ruolo fondamentale nella risonanza, in quanto possono essere delocalizzati nella molecola, non essendo costretti da particolari vincoli, come lo sono invece gli elettroni di legame σ.
Nella chimica organica faremo spesso ricorso alla delocalizzazione degli elettroni π per giustificare le proprietà chimico-fisiche di numerosi composti, come ad esempio la reattività del benzene e dei suoi derivati.
Mentre è relativamente semplice scrivere le possibili formule di risonanza di un composto, non è altrettanto facile stabilire quale sia il contributo delle singole strutture all'ibrido.
Valutare il
contributo di una formula limite all'ibrido di risonanza, significa in sostanza
dare un giudizio sulla sua ipotetica stabilità; ciò è possibile attraverso la
valutazione del suo contenuto di energia potenziale. Il binomio energia -
stabilità e l'equivalenza minore energia = massima stabilità sono
punti fermi cui fare costante riferimento.
Spesso, in questa operazione ci si può affidare al 'buon senso', ma
risulteranno certamente utili alcune indicazioni pratiche che sono riportate di
seguito.
Linee guida da osservare nella scrittura delle formule di risonanza:
Il problema
che spesso si pone è quante e quali formule risonanti siamo
autorizzati a rappresentare: fino a che punto si può 'spingere' la
delocalizzazione degli elettroni?
Il punto (4) è indubbiamente il riferimento principale per dare una risposta
adeguata all'interrogativo. Se per un ibrido si possono scrivere varie formule
risonanti, ma con energia potenziale piuttosto diversa, solo quelle con
energia più bassa daranno un contributo significativo alla descrizione
della molecola, mentre le altre, con energia più elevata, potranno essere
trascurate.
. Generalmente, la formula con il maggior numero di legami è la più stabile, poiché la sua energia potenziale è minore (nella formazione dei legami si libera energia).
. Se le diverse strutture risonanti hanno lo stesso numero di legami, ma alcune portano delle cariche, le molecole cariche saranno meno stabili di quelle prive di carica.
. Le strutture cariche più stabili sono quelle in cui la carica negativa è ospitata dall'atomo più elettronegativo e la carica positiva da quello meno elettronegativo.
. Maggiore è il numero di cariche separate e maggiore è la loro distanza, minore è la stabilità della struttura.
. Le strutture cariche possono comunque dare un contributo significativo all'ibrido di risonanza, poiché avremo in ogni caso un numero maggiore di formule limite che contribuiscono a dare maggior stabilità all'ibrido.
. Infine una considerazione banale, ma necessaria, poiché è spesso disattesa dallo studente: gli elementi del secondo periodo non violano mai l'ottetto e l'idrogeno può disporre al massimo di una coppia di elettroni.
Proviamo a mettere in pratica queste indicazioni per rappresentare la molecola dell'anidride carbonica.
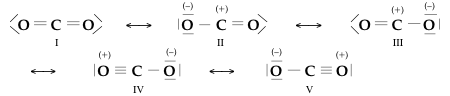
Le strutture (II) e (III), oltre a portare cariche separate, contengono tre soli legami; inoltre il carbonio non completa l'ottetto. La loro energia è piuttosto elevata e il loro contributo all'ibrido è del tutto trascurabile.
Le strutture (IV) e (V), pur contenendo cariche separate piuttosto distanziate, conservano lo stesso numero di legami della (I) e danno un parziale contributo all'ibrido, come indica il valore sperimentale delle lunghezze di legame: entrambi 1.16 Å, contro 1.18 previsti per un doppio legame carbonio-ossigeno. Nell'anidride carbonica, il legame C-O ha pertanto parziale carattere di triplo legame. La molecola reale si può comunque considerare descritta in maniera soddisfacente dalla struttura (I).
Altri modelli classici, comunemente usati nella esemplificazione della scrittura di formule risonanti di molecole contenenti legami multipli, sono l'ozono (O3) e gli ioni molecolari nitrato (NO3-) e carbonato (CO32-).
Dovreste essere ormai in grado di scrivere da soli le formule di risonanza di questi composti e di fare anche alcune osservazioni e commenti sul contributo che danno all'ibrido e sulle caratteristiche delle corrispondenti 'molecole reali'.
Vi suggerisco caldamente di provarci, prima di andare a verificare le soluzioni cliccando sui link che seguono. Una formula scritta da soli vale più di cento formule copiate da un libro.
Alcuni suggerimenti:
. L'ozono ha formula molecolare O3; è una forma allotropica dell'ossigeno molecolare. I tre atomi di ossigeno sono legati in successione; partite dai simboli elettronici di Lewis (l'ossigeno ha 6 elettroni nello strato di valenza) e disponete i legami facendo in modo da rispettare la regola dell'ottetto per tutti e tre gli atomi e il numero complessivo degli elettroni 'esterni' (18 in totale, quindi 9 coppie rappresentate da altrettanti trattini). Cercate di dare un'idea della geometria molecolare, come conseguenza del tipo di ibridazione.
. Lo ione nitrato deriva dalla dissociazione di un H+ dall'acido nitrico. Ha formula molecolare NO3-; nella struttura, l'azoto sta al centro e lega i tre ossigeni. Seguite gli stessi accorgimenti indicati per l'ozono (ricordando che l'azoto non può espandere l'ottetto) e attribuite le cariche formali dove necessario, tenendo presente che lo ione dovrà risultare con una carica netta negativa.
La molecola dell'ozono
|
|
|
Con questa rappresentazione, tutti gli atomi raggiungono la configurazione otteziale. Le due strutture sono perfettamente equivalenti: ciascuna di esse dà pertanto lo stesso contributo (50%) all'ibrido di risonanza. Ciascuno dei due legami con l'ossigeno 'centrale' è intermedio ad un legame semplice e un legame doppio (ordine di legame 1.5). Tutto ciò implica che tutti e tre gli atomi di ossigeno abbiano ibridazione sp2. La molecola è quindi planare: i due legami σ e cinque doppietti solitari giacciono sullo stesso piano; tre orbitali p puri, uno per ciascun atomo, perpendicolari al piano, si sovrappongono a formare un unico orbitale π delocalizzato sull'intera molecola, che ospita 4 elettroni. Per effetto della particolare distribuzione elettronica e della geometria angolare della molecola, l'ozono ha un momento dipolare non nullo, nonostante sia costituito da atomi dello stesso elemento. La correttezza di questa rappresentazione è confermata dai dati sperimentali relativi alle distanze e all'angolo di legame. Ciascuno dei due legami misura infatti 1.37 Å, un valore esattamente intermedio a quelli previsti per un legame semplice e per un legame doppio ossigeno-ossigeno. L'angolo di legame è invece 117°, molto prossimo al valore atteso per una geometria planare-triangolare risultante dall'ibridazione sp |
|
|
Lo ione nitrato
|
Lo ione molecolare nitrato, NO3-, è un altro esempio di molecola in cui troviamo un orbitale π delocalizzato. |
|
|
|
È possibile scrivere una quarta formula, contenente esclusivamente legami semplici, ma il suo contributo all'ibrido è trascurabile: ha infatti un legame in meno, un'ulteriore separazione di carica e l'azoto non completa l'ottetto. Le tre formule limite indicano che ciascun legame ha 1/3 di carattere di doppio legame (l'ordine di legame è 1.33); tutti gli atomi dello ione hanno ibridazione sp2 (la geometria molecolare è planare-triangolare, con angoli di 120°) e sei elettroni si trovano delocalizzati in un orbitale π, esteso all'intera molecola e formato dalla sovrapposizione di quattro orbitali p puri. La forte acidità dell'acido nitrico trova una spiegazione proprio nel fenomeno della risonanza. Per l'acido nitrico si possono scrivere solo due formule limite, mentre diventano tre, tutte energeticamente equivalenti e con un orbitale π delocalizzato sull'intera molecola, per lo ione nitrato. Quest'ultimo è quindi molto più stabile dell'acido da cui deriva. La dissociazione dell'idrogenione -evento che richiede energia- è largamente compensata dal notevole abbassamento di energia potenziale dello ione nitrato, per effetto della stabilizzazione per risonanza. |
 |
| Appunti su: Geometria molecolare anione nitrito, https:wwwappuntimaniacomscientifichechimicarisonanza85php, ione nitrato, risonanza co2, lewisstructuur nitraat ion, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |