 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2229 | Gradito: |
Leggi anche appunti:Equilibrio di complessazione e pHEquilibrio di complessazione e pH Analogamente a quanto accade per gli equilibri Calcolo del pH di acidi e basi deboli molto diluiti e/o molto deboliCalcolo del pH di acidi e basi deboli molto diluiti e/o molto deboli Quando Bilanciamento con numeri di ossidazione frazionariBilanciamento con numeri di ossidazione frazionari I numeri di ossidazione |
 |
 |
Nel 1887 il chimico svedese Svante Arrhenius propose le seguenti definizioni di acido e di base:
HA → H+ + A-
BOH → B+ + OH-
Sono esempi di acidi di Arrhenius gli idracidi, gli ossiacidi e gli acidi carbossilici. Gli acidi carbossilici sono acidi organici in cui è presente il gruppo carbossilico -COOH in grado di dissociarsi in uno ione H+ ed un anione carbossilato
RCOOH ![]() RCOO¯ + H+
RCOO¯ + H+
In generale L'acidità di un idrogeno dipende da una serie di fattori:
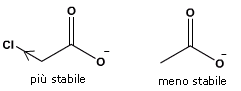
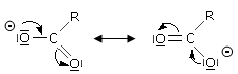
Le basi di Arrhenius sono gli idrossidi dei metalli del primo e secondo gruppo della tavola periodica, come NaOH, KOH, Ca(OH)2. Infatti in questi composti il legame fra l'ossigeno ed il metallo è ionico per cui in acqua si dissociano liberando ioni OH¯ .
Come abbiamo già visto la reazione fra un acido ed una base in soluzione acquosa è in definitiva una reazione di ricombinazione tra ioni H+ e ioni OH-
![]()
Na+ + OH¯ + H+ + Cl¯ Na+ + Cl¯ + H2 O
Base acido sale acqua
Idrossido di sodio Acido cloridrico Cloruro di sodio
Gli ioni Na+ e Cl- sono detti ioni spettatori in quanto non partecipano alla reazione. la vera reazione che avviene é
H+ + OH¯ → H2O
mentre resta in soluzione il sale dissociato.
 |
| Appunti su: |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |