 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3020 | Gradito: |
Leggi anche appunti:Dieni ePolieniDieni ePolieni Idrocarburi contenenti due o più doppi legami CC Preparazione Equilibri chimici omogenei ed eterogeneiEquilibri chimici omogenei ed eterogenei Si parla di equilibri in fase omogenea La carboneriaLa carboneria Con la morte all'inizio dell'anno anche di FERDINANDO I di Borbone, |
 |
 |
L'acqua costituisce un dipolo particolarmente intenso in quanto la differenza di elettronegatività tra Ossigeno ed Idrogeno risulta piuttosto elevata. In queste condizioni le molecole d'acqua allo stato liquido tendono a disporsi in modo da presentare il polo negativo (Ossigeno) di una rivolto verso il polo positivo (idrogeno) di un'altra. Si formano così legami intermolecolari di natura elettrostatica (legami idrogeno) che mantengono fra loro unite le molecole.
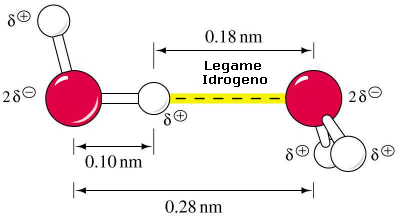
Tale legame è meno intenso di un normale legame covalente e a temperatura ambiente non è in grado di bloccare le molecole in una posizione determinata. Se ciò avvenisse l'acqua solidificherebbe.
Ciononostante il legame tra le molecole dipolari dell'acqua è molto più intenso della maggior parte dei legami esistenti tra altre molecole polari. Nell'acqua i legami a idrogeno si formano e si spezzano in continuazione (si calcola che la vita media di un legame a idrogeno sia di circa 10-11 s) lasciando libere le molecole di muoversi scivolando le une rispetto all'altro, ma garantendo complessivamente una notevole forza di coesione tra esse.
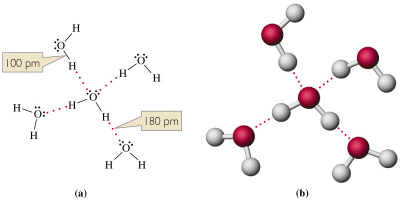
La presenza del legame a idrogeno tra le molecole d'acqua è fondamentale per comprendere le caratteristiche chimico-fisiche e biologiche di quest'ultima.
La presenza dell'acqua è essenziale per qualsiasi forma di vita conosciuta. E' nell'acqua che si ritiene sia nata la vita e di acqua sono costituite, per gran parte della loro massa, le cellule.
|
Temperatura e passaggi di stato La temperatura di un qualsiasi corpo è una misura dell'energia
cinetica media ( Se infine facciamo aumentare ulteriormente la temperatura le molecole riescono a vincere le forze di attrazione che le tengono unite e non aderiscono più. Le distanze che separano una molecola dall'altra diventano molto elevate e la materia viene a trovarsi in tal modo allo stato gassoso o aeriforme. |
L'acqua presenta un elevato calore specifico.
Il calore specifico di una sostanza è il numero di calorie necessarie per elevare di 1°C la temperatura di un grammo di sostanza. Ricordando la definizione di caloria è evidente che il calore specifico dell'acqua è 1 cal/(g °C).
Dire che l'acqua presenta un elevato calore specifico significa che, a parità di massa, l'acqua necessita di una quantità di calore molto più elevata di qualsiasi altra sostanza inorganica (ammoniaca (NH3) esclusa) per manifestare lo stesso effetto di riscaldamento (lo stesso aumento di temperatura). In altre parole l'acqua, rispetto ad altre sostanze può assorbire molto calore senza scaldarsi eccessivamente. Una conseguenza di questo fenomeno è che l'acqua si scalda (e si raffredda) molto più lentamente delle altre sostanze.
L'elevata capacità termica dell'acqua (quantità di calore necessaria per aumentare di 1°C la temperatura di un corpo di massa qualsiasi) si spiega con la presenza dei legami idrogeno tra le sue molecole. Quando forniamo calore all'acqua solo una parte di questo si trasforma in un aumento di energia cinetica delle molecole, e quindi in un aumento di temperatura, poichè in parte esso è utilizzato per spezzare i legami idrogeno che imbrigliano le strutture molecolari.
Per lo stesso motivo l'acqua assorbe anche molto calore durante il processo di evaporazione, presenta cioè un elevato calore di evaporazione (a 25°C e 1 Atm 0,584 kcal/g). Ancora una volta il calore fornito deve vincere delle forze di attrazione tra le molecole particolarmente intense (legami idrogeno) per farle passare allo stato di vapore, abbandonando la superficie del liquido.
L'elevata capacità termica e l'elevato calore di evaporazione fanno dell'acqua un ottimo liquido refrigerante e, in generale, termoregolante, capace cioè di ammortizzare in modo molto efficace gli sbalzi termici.
E' ad esempio un fatto noto che l'acqua del mare si scalda e si raffredda più lentamente della terraferma e quindi le grandi masse d'acqua presenti sulla superficie terrestre, come un'enorme volano termico, riducono le escursioni termiche giornaliere e stagionali, svolgendo un'azione mitigatrice sul clima delle località marine e lacustri.
Ma al di là delle modificazioni climatiche, gli effetti più importanti da questo punto di vista, l'acqua li manifesta sugli esseri viventi. L'acqua presente negli organismi (dal 50% al 95% in peso) è infatti in grado di assorbire in modo particolarmente efficace le variazioni esterne di temperatura. In particolare alcuni esseri viventi, tra cui l'uomo, sono in grado di eliminare calore in eccesso facendo evaporare acqua (sudorazione).
Il mantenimento dell'equilibrio termico è un fatto vitale per gli esseri viventi in quanto molte macromolecole sono termolabili e vengono distrutte ad elevate temperature, mentre a basse temperature la velocità delle reazioni chimiche diminuisce al punto tale da essere incompatibile con la vita.
Un'altra caratteristica notevole dell'acqua è che quando solidifica aumenta di volume, contrariamente a quanto fanno la maggior parte delle altre sostanze chimiche. Ciò è dovuto al fatto che la solidificazione avviene attraverso una stabilizzazione dei legami idrogeno, i quali costringono ora le molecole a disporsi in una struttura cristallina ordinata, a maglie più larghe rispetto a quanto avveniva nel liquido. Se il ghiaccio fosse più pesante dell'acqua si accumulerebbe, anno dopo anno, sul fondo dei bacini idrici senza possibilità di ritornare allo stato liquido. In tal modo le riserve idriche mondiali si esaurirebbero (diventando tra l'altro sempre più salate) ed ogni forma vivente in esse sarebbe destinata all'estinzione. La formazione di strati di ghiaccio galleggiante tende invece a proteggere l'acqua sottostante da ulteriori diminuzioni di temperatura.
Per la sua elevata polarità l'acqua aderisce (forze di adesione) fortemente a qualunque superficie costituita da molecole che presentino cariche elettriche. In tal modo si spiega perchè l'acqua 'bagna'. Tale capacità dell'acqua è alla base dei fenomeni di capillarità ed imbibizione, per i quali l'acqua è in grado di salire attraverso tubi sottili (capillari) o di invadere materiali porosi, letteralmente scalando le loro superfici. I fenomeni di capillarità ed imbibizione presentano una notevole valenza biologica, soprattutto nel mondo vegetale, in quanto sono alla base della circolazione dei fluidi nelle piante. L'imbibizione è ad esempio fondamentale per i processi di germinazione, poichè permette di spaccare i resistenti tegumenti che proteggono il seme (si ritiene che gli Egiziani staccassero i blocchi di pietra necessari per costruire le piramidi, praticando dei fori all'interno dei quali facevano dilatare dei bastoni di legno per imbibizione).
Ma l'azione biologica probabilmente più importante svolta dall'acqua è quella di agire da mezzo disperdente per le molecole.
Tutte le reazioni chimiche che avvengono all'interno della cellula richiedono infatti che i reagenti siano intimamente mescolati a livello molecolare. Il sistema che ne deriva prende il nome di soluzione acquosa. In una soluzione acquosa l'acqua è il solvente, mentre le sostanze presenti in concentrazione minore sono i soluti. Le reazioni che avvengono in soluzione sono molto più veloci di reazioni di tipo diverso, poiché essendo i reagenti completamente mescolati a livello molecolare hanno una maggior probabilità di scontrarsi e reagire.
Inoltre le sostanze disciolte in acqua possono essere trasportate all'interno dell'organismo in modo semplice ed efficiente (sangue, linfa etc).
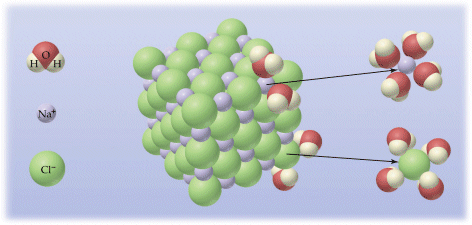
L'acqua non scioglie qualsiasi sostanza, ma solo le sostanze dotate di carica elettrica (ioniche e polari) per le quali presenta grande affinità. Infatti i dipoli che costituiscono le molecole d'acqua vengono attirati dagli ioni o dalle molecole polari. L'attrazione che l'acqua esercita su tali particelle (interazioni idrofile) è talmente elevata da arrivare a vincere le forze interne di coesione. Le molecole di soluto vengono quindi staccate ad una ad una, rivestite di molecole d'acqua (idratazione) e portate in soluzione.
Nel caso ad esempio di un soluto ionico, come il Cloruro di Sodio, gli ioni Na+ vengono circondati da molecole d'acqua che puntano verso di essi il proprio polo negativo (Ossigeno), mentre gli ioni Cl- attirano i poli positivi delle molecole d'acqua (Idrogeno).
Se il soluto è costituito di particelle di dimensioni superiori a 10-3 (1 = 10-3 mm) e inferiori a 1, (sopra il micron si parla di sospensioni) la soluzione presenta delle caratteristiche particolari e viene detta soluzione (o sistema) colloidale. Nei colloidi il soluto prende il nome di fase dispersa. A differenza di quanto avviene nelle soluzioni vere, nei colloidi è possibile evidenziare le particelle della fase dispersa tramite l'effetto Tyndall, illuminando cioè il colloide ed osservandolo perpendicolarmente alla direzione del fascio luminoso. Le particelle della fase dispersa, avendo dimensioni dell'ordine di grandezza della lunghezza d'onda della luce impiegata per illuminarle, la diffondono e diventano così visibili (è lo stesso effetto che si produce quando un raggio di sole che entra da una finestra si "materializza" illuminando il pulviscolo atmosferico).
Inoltre se aumentiamo la concentrazione di una soluzione vera il soluto si deposita come corpo di fondo cristallino, mentre in un sistema colloidale ciò non avviene ed esso o diventa gelatinoso o coagula (floccula) formando grossi agglomerati irregolari (albume d'uovo, sangue etc). I colloidi diluiti sono simili alle soluzioni vere e sono detti sol, quelli più concentrati presentano un aspetto gelatinoso e sono detti gel.
Le soluzioni biologiche, oltre a presentare soluti di piccole dimensioni (ioni, zuccheri, amminoacidi etc), contengono anche grosse macromolecole (soprattutto proteine) che ne fanno dei sistemi che presentano sia le caratteristiche delle soluzioni vere che quelle delle soluzioni colloidali.
L'acqua non scioglie le sostanze apolari come i grassi (lipidi). Le molecole apolari vengono letteralmente escluse dall'acqua, per cui esse tendono a formare grossi aggregati tra di loro (olio in acqua). Tali effetti di esclusione a carico di molecole apolari vanno sotto il nome di interazioni idrofobiche.
Nelle cellule le interazioni idrofobiche hanno grande importanza, sia nel costituire riserve di sostanze lipidiche, sia soprattutto nel determinare la struttura delle membrane cellulari. Le membrane che circondano tutte le cellule e le separano dall'ambiente esterno sono in pratica costituite da sottili strati lipidici stabilizzati dalle repulsioni idrofobiche che l'acqua esercita sia dall'interno che dall'esterno della cellula.
Il comportamento dell'acqua è legato infine ad un'altra importante caratteristica delle soluzioni: l'acidità.
Nell'acqua pura una piccolissima percentuale di molecole (circa 2 molecole ogni miliardo) si dissociano secondo la reazione
H2O H+ + OH-
In pratica un atomo di Idrogeno si separa dalla molecola d'acqua alla quale apparteneva, abbandonando il suo elettrone. L'Idrogeno si distacca quindi come ione positivo o idrogenione, mentre lo ione negativo che si forma prende il nome di ione ossidrile o idrossido (OH-).
Naturalmente nell'acqua pura il numero di ioni H+ è uguale al numero di ioni OH-. In tali condizioni la soluzione si dice neutra.
Ma se introduciamo nell'acqua un soluto in grado di rilasciare ioni H+ o ioni OH- l'equilibrio viene alterato.
Le sostanze che in acqua sono in grado di dissociarsi, facendo aumentare gli ioni H+ sono dette acide. Un esempio è l'acido cloridrico (HCl), una sostanza secreta anche dal nostro stomaco
HCl H+ + Cl-
Quando in una soluzione vi è un eccesso di ioni H+ rispetto agli ioni OH-, la soluzione si dice acida
Le sostanze che in acqua sono in grado di dissociarsi, facendo aumentare gli ioni OH- sono dette basiche. Un esempio è l'idrossido di sodio (NaOH)
NaOH Na+ + OH-
Quando in una soluzione vi è un eccesso di ioni OH- rispetto agli ioni H+, la soluzione si dice basica Per misurare la concentrazione degli ioni H+ si ricorre ad una scala convenzionale, la scala del pH
pH = 7 soluzione neutra
pH < 7 soluzione acida
pH > 7 soluzione basica
Una soluzione è tanto più acida quanto più basso è il suo pH ed è tanto più basica quanto più elevato il suo pH. La scala del pH va solitamente da 0 a 14, ma sono possibili anche valori esterni a tale intervallo. La scala del pH è una scala logaritmica. Ciò significa che per ogni variazione di un punto del pH la concentrazione degli ioni H+ varia di un fattore 10. Una soluzione a pH = 2 è 104 = 10.000 più concentrata in ioni H+ di una soluzione a pH = 6
In genere ogni soluzione biologica presenta un pH ben determinato e non tollera variazioni eccessive.
Il sangue umano ad esempio presenta un pH = 7,4 ed una variazione superiore a 0,3 può rapidamente portare al coma ed alla morte. Questa enorme sensibilità alle variazioni di pH è essenzialmente legata al fatto che le proteine che controllano il nostro metabolismo (enzimi) lavorano correttamente solo a certi valori di pH. Ad esempio la pepsina, un enzima che inizia la digestione delle proteine nello stomaco, è in grado di lavorare solo con pH compresi tra 1 e 2 (questo è uno dei motivi per cui le pareti dello stomaco sono in grado di secernere grandi quantità di acido cloridrico).
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |