 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 13687 | Gradito: |
Leggi anche appunti:Il sistema periodico degli elementiIL SISTEMA PERIODICO DEGLI ELEMENTI Nel 1869 Mendeleev ordinò gli elementi Composti bi- e polifunzionaliCOMPOSTI bi- e polifunzionali. Fino a questo punto si sono pressoché L'ossigenoL'ossigeno L'ossigeno , che è il primo elemento del 6s gruppo B del sistema periodico, |
 |
 |
Valenza: Termine obsoleto per indicare il numero di altri elementi che un elemento può legare. Attualmente questo termine è sostituito da COVALENZA
Valenza ionica: Termine usato per identificare la carica che uno ione può assumere.
Oggi si preferisce parlare di numero o grado di ossidazione. Un termine solo in parte alternativo ai due precedenti (valenza e covalenza), ma concettualmente molto più importante e descrittivo.
Il numero o grado di ossidazione si può definire come:
'La carica che assumerebbe un elemento in un composto, se si attribuissero gli elettroni di legame all'elemento più elettronegativo'.
Tale
definizione richiede un paio di precisazioni affinché possa essere di utilità
pratica:
(a) Nel caso di un legame fra due elementi uguali (o della stessa
elettronegatività) si assegna un elettrone a ciascun elemento.
(b) La carica che l'elemento 'assume', si determina dal confronto con la configurazione elettronica esterna dell'elemento, nel suo stato fondamentale.
Oltre che attraverso la definizione data, i numeri di ossidazione si possono determinare applicando le regole che seguono. Questa via è più rapida e più semplice, specialmente se non si è in grado di rappresentare la formula di struttura del composto.
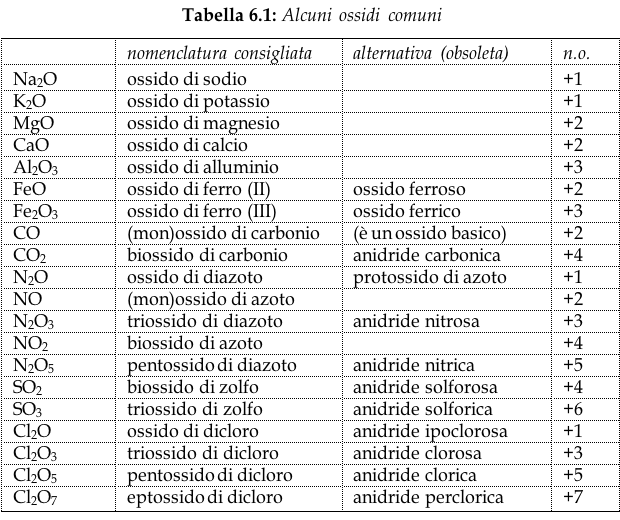
Gli ossidi sono composti binari dell'Ossigeno in cui l'Ossigeno ha sempre numero di ossidazione -2.
Gli ossidi dei non metalli vengono anche detti anidridi. Il termine anidridi è tuttavia obsolescente ed è tuttora consentito solo per alcuni ossidi: CO2 (anidride carbonica), SO2 (anidride solforosa), SO3 (anidride solforica).
Attualmente la IUPAC impone di usare i prefissi mono-, di-, tri- tetra-, penta-
etc. per indicare il numero degli elementi che compongono l'ossido.
Gli ossidi dei non metalli hanno proprietà acide. La maggior parte di essi, reagendo con l'acqua, generano infatti acidi ossigenati (ossiacidi). Questi ossidi sono tipicamente covalenti.
Gli ossidi della maggior parte dei metalli hanno proprietà basiche. Reagendo con l'acqua generano idrossidi. Gli ossidi dei metalli del I e del II gruppo hanno caratteristiche spiccatamente ioniche.
Alcuni
elementi danno ossidi con proprietà anfotere, ovvero possono avere
caratteristiche acide o basiche. La natura acido-base di un ossido (specialmente
di metalli di transizione e di semimetalli) può infatti variare dal basico
all'acido all'aumentare del grado di ossidazione dell'elemento.
Un esempio classico è quello del cromo, il cui ossido è acido quando il
numero di ossidazione è +6, ed è basico o anfotero quando il numero di
ossidazione è +2 o +3. Anche il manganese ha proprietà analoghe.
Nella scrittura della formula bruta di qualsiasi composto neutro (privo di carica), occorre sempre prestare attenzione al fatto che la somma algebrica dei numeri di ossidazione degli elementi deve risultare ZERO. Ricordando che l'Ossigeno ha sempre no. di ossidazione -2, per 'costruire' la formula di un ossido, occorrerà prendere un numero di ossigeni e un numero di atomi dell'altro elemento tali da soddisfare questa condizione.
I perossidi sono composti contenenti il gruppo perossido: -O-O-. Nei perossidi, l'Ossigeno ha numero di ossidazione -1.
Possono
essere covalenti (ad esempio, perossido di idrogeno o acqua ossigenata,
H2O2)
o ionici (ad esempio, perossido di sodio, Na2O2,
perossido di calcio, CaO2).
In questi ultimi, il gruppo perossido è ovviamente presente in forma ionica: O22-
I superossidi sono composti ionici contenenti lo ione superossido: O2-. Nei superossidi, l'Ossigeno ha numero di ossidazione -1/2.
Sono composti ternari formati da H, O e un non-metallo, oppure un metallo il cui ossido abbia proprietà acide (esempio: Cr, Mn, V).
. Le formule degli ossiacidi si scrivono secondo lo schema HXO, ovvero indicando nell'ordine l'idrogeno, l'elemento caratteristico e l'ossigeno.
. Viceversa
le formule degli idrossidi seguono lo schema XOH, metallo - ione
idrossido.
Questa convenzione consente un immediato riconoscimento della natura acida o basica del composto.
La nomenclatura degli ossiacidi è strutturata in modo da mettere in evidenza il grado di ossidazione dell'elemento caratteristico:
Desinenza -oso = no. ox. Minore
Desinenza -ico = no. ox. maggiore
I numeri di ossidazione cui si fa riferimento non sono tutti i possibili numeri di ossidazione dell'elemento, ma quelli che esso assume negli ossiacidi che può generare.
Esempio: acido solforoso (H2SO3, n.o. S = +4) e acido solforico (H2SO4, n.o. S = +6)
Qualora tali desinenze non siano sufficienti - e solo allora -, si fa ricorso ai prefissi ipo- (per indicare il no. ox. più basso) e per- (per indicare quello più alto).
In pratica,
secondo le raccomandazioni IUPAC, il prefisso ipo- è consentito solo
negli acidi: iponitroso (H2N2O2) e ipocloroso,
ipobromoso, ipoiodoso (schema HXO);
il prefisso per- è consentito solo negli acidi: perclorico, perbromico,
periodico, permanganico (tutti con schema HXO4).
Nei sali (e negli anioni), le desinenze -oso e -ico diventano rispettivamente -ito e -ato, mentre eventuali prefissi si conservano invariati.
Acidi meta, orto e piro
Talvolta può essere necessario distinguere il diverso 'grado di idratazione' di un ossiacido, ovvero il diverso contenuto di molecole d'acqua.
Tale distinzione si fa mediante i prefissi meta-, orto- e piro-
(o di-).
La formula bruta degli acidi 'di' si costruisce quindi raddoppiando gli elementi dell'acido orto e sottraendo due idrogeni e un ossigeno.
Anche questi prefissi si conservano invariati nella nomenclatura dei sali (e degli anioni).
Per quanto
riguarda i prefissi orto e meta, la IUPAC ha approvato il loro
uso solo per i seguenti acidi :
ortoborico (H3BO3), ortosilicico (H4SiO4),
ortofosforico (H3PO4), ortoperiodico (H5IO6);
metaborico (HBO2), metasilicico (H2SiO3), metafosforico (HPO3)n.
Il prefisso piro è consentito solo per l'acido pirofosforico (H4P2O7); in tutti gli altri casi si dovrebbe usare il prefisso di-.
Tioacidi con questo termine si indica la sostituzione di un O con S in un ossiacido.
Esempio: H2S2O3, acido tiosolforico (ipotetico).
Perossoacidi si indica la sostituzione di -O- con -O-O- (gruppo perossido).
Esempio: H2S2O8, acido perossodisolforico; H2SO5, acido perosso(mono)solforico.
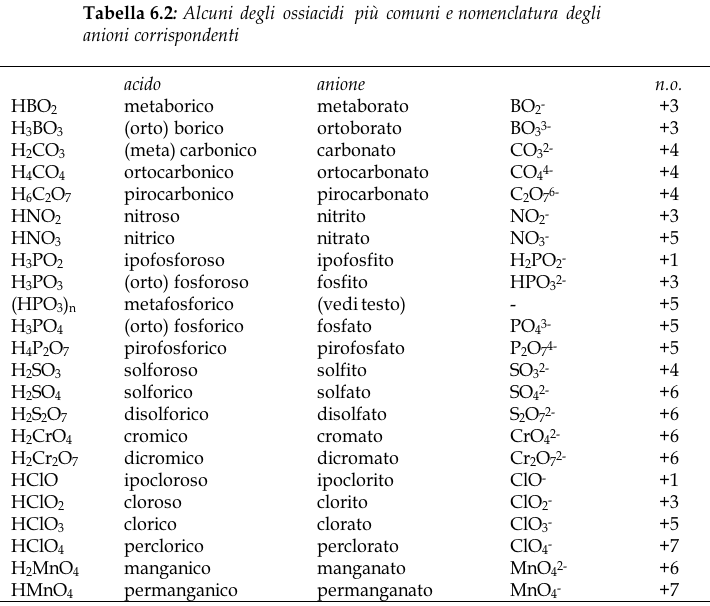
Gli acidi si dicono monoprotici, diprotici, triprotici etc., a seconda del numero di idrogenioni che possono dissociare. L'anione riportato in tabella è quello prodotto dalla dissociazione completa dell'acido.
Il fluoro non forma acidi ossigenati. Gli acidi ipofosforoso e fosforoso sono detti più correttamente fosfinico e fosfonico ed i loro relativi anioni fosfonito e fosfonato. Il fatto che gli anioni di questi due acidi contengano atomi di idrogeno, indica che tali idrogeni non sono dissociabili. Essi sono infatti legati direttamente al fosforo.
Sono composti ternari formati da H, O ed un metallo. In maniera più appropriata, si possono definire come composti formati da un metallo e ioni OH- (idrossido), mettendone in evidenza la natura ionica.
Nota: il nome ossidrile per lo ione OH- è da considerare obsoleto.
Le formule
degli idrossidi si scrivono secondo lo schema XOH, metallo - ione
idrossido.
Viceversa, le formule degli ossiacidi seguono lo schema HXO, idrogeno -
elemento caratteristico - ossigeno.
Questa convenzione consente un immediato riconoscimento della natura basica o acida del composto.
Esempi:
NaOH, idrossido di sodio; KOH, idrossido di potassio ;
Mg(OH)2, idrossido di magnesio; Ca(OH)2, idrossido di calcio; Zn(OH)2, idrossido di zinco; Fe(OH)2, idrossido di ferro (II);
Al(OH)3, idrossido di alluminio; ; Cr(OH)3, idrossido di cromo; Fe(OH)3, idrossido di ferro (III).
Gli idrossidi hanno generalmente proprietà basiche.
Gli
idrossidi dei metalli alcalini (gruppo IA) sono tipiche basi forti.
Alcuni idrossidi dei metalli alcalino-terrosi (in particolare Mg) sono poco
solubili e quindi basi molto deboli.
Viceversa, idrossidi come Al(OH)3 o Zn(OH)2 hanno un comportamento anfotero.
Sono composti binari dell'Idrogeno.
I rapporti con cui l'idrogeno si lega con gli elementi dal I al VII gruppo sono fissi e si ripetono con estrema periodicità: 1, 2, 3, 4, 3, 2, 1
. Idruri
metallici: gli idruri dei gruppi IA e IIA sono detti idruri metallici.
Negli idruri metallici, l'idrogeno ha numero di ossidazione -1.
Ad eccezione degli idruri di Li e Be, gli altri hanno cateristiche nettamente
ioniche.
In essi l'idrogeno è presente come ione idruro (H:-).
. Idruri covalenti: gli idruri degli elementi dal IV gruppo in avanti hanno natura molecolare.
Esempi:
CH4, metano; SiH4, silano
NH3, ammoniaca; PH3, fosfina
. Idracidi:
gli idruri del VI e del VII gruppo sono definiti più esattamente idracidi.
Per la loro nomenclatura si premette il termine acido e di aggiunge la
desinenza -idrico al nome dell'elemento caratteristico.
Esempi:
H2S, acido solfidrico; HF, acido fluoridrico; HCl,
acido cloridrico; HBr, acido bromidrico; HI, acido iodidrico.
Si noti come la formula degli idruri acidi sia scritta anteponendo
l'idrogeno all'altro elemento.
Nota: per
questi composti, la IUPAC raccomanda l'uso alternativo di anione-uro di
idrogeno; ovvero:
solfuro, fluoruro, cloruro, bromuro, ioduro di idrogeno.
Un altro importante idracido (ma non un idruro) è l'acido cianidrico, HCN.
I cationi
derivati da idruri prendono il suffisso -onio.
Ad esempio: PH4+, fosfonio; NH4+,
ammonio; H3O+, ossonio (o idronio).
I sali che derivano dagli idracidi, cambiano il suffisso -idrico in -uro
Lo stesso suffisso, -uro, è quello che si dovrebbe assegnare a tutti gli anioni monoatomici: azoturo, solfuro, fluoruro, cloruro, bromuro, ioduro etc.
Sono composti ionici che si ottengono, normalmente, dalla reazione di un acido con una base.
Non vi è molto da aggiungere alla loro nomenclatura, che abbiamo già indicato di volta in volta, parlando di ossiacidi e di idracidi e che riassumiamo brevemente nella tabella che segue:
|
Acido |
Sale |
|
-oso |
-ito |
|
-ico |
-ato |
|
-idrico |
-uro |
|
Eventuali prefissi si mantengono invariati |
|
Saranno qui sufficienti poche semplici integrazioni.
Una di esse riguarda quei sali che derivano dalla reazione incompleta di acidi poliprotici con basi forti e che quindi mantengono idrogeni acidi nell'anione (sali acidi). In tal caso si indica, prima dell'anione, il numero di idrogeni presenti, usando le particelle mono-, di-, tri- etc.
Esempi:
NaHCO3, idrogenocarbonato
di sodio (in alternativa a idrogenocarbonato, si usava una volta il termine bicarbonato);
KH2PO4, diidrogenofosfato di potassio;
Ca(HSO3)2, idrogenosolfito di calcio.
Sali contenenti gli ioni OH- o O2-
Si usano rispettivamente i termini idrossi e ossi.
Esempi:
Mg(OH)Cl, idrossicloruro di magnesio;
PbOCl2, ossidicloruro di piombo (IV)
Sali doppi: i cationi si scrivono in ordine alfabetico e con lo stesso criterio si scrivono gli anioni. Nella nomenclatura, al nome dell'anione si fa seguire l'aggettivo doppio.
Esempi:
KMgCl3, cloruro doppio di potassio e magnesio;
NH4NaHPO4, idrogenofosfato doppio di ammonio e sodio.
Una delle difficoltà incontrate più frequentemente dagli studenti, riguarda la scrittura delle formule dei sali.
Molto spesso i problemi nascono da una scarsa conoscenza sia della nomenclatura chimica, sia delle formule degli acidi ossigenati, dai quali derivano gran parte dei sali. Con queste pagine cercheremo di fornire allo studente gli strumenti per poter superare il primo scoglio che egli incontrerà all'esame di chimica: la scrittura, appunto, delle formule brute dei sali e delle strutture dei principali ossoacidi.
Formalmente, le formule degli acidi ossigenati si possono ricostruire sommando acqua all'opportuno ossido, facendo attenzione al rispetto delle regole della nomenclatura (-oso, -ico, meta-, orto-, etc.) e alla 'stechiometria' della reazione.
Gli ossidi sono composti binari dell'Ossigeno con un altro elemento. Tutti gli elementi, tranne i gas nobili, possono formare ossidi. Gli ossidi dei metalli hanno natura basica, quelli dei non metalli hanno natura acida (*). Questa caratteristica è molto ben rappresentata sulla maggior parte delle Tavole periodiche, in cui l'angolino in alto a destra della casella dell'elemento è colorato in azzurro (natura basica) o in rosso (natura acida). Addirittura l'intensità della colorazione gradua la forza dell'idrossido o dell'ossoacido, corrispondenti.
|
natura Basica |
natura Acida |
natura Anfotera |
La doppia colorazione dell'angolino (azzurro/rosa) indica che l'ossido dell'elemento ha natura anfotera, può cioè comportarsi sia da base, che da acido. Si deve porre attenzione al fatto che queste proprietà sono riferite all'ossido in cui l'elemento ha grado di ossidazione più elevato. La natura acido-base di un ossido (specialmente di metalli di transizione e di semimetalli) può infatti variare dal basico all'acido all'aumentare del grado di ossidazione dell'elemento caratteristico. Esempio classico è quello del Cromo, il cui ossido è acido quando il numero di ossidazione è +6, ed è basico o anfotero quando il numero di ossidazione è +2 o +3.
(*) Gli ossidi dei non metalli in passato venivano chiamati anidridi. L'attuale nomenclatura ufficiale stabilisce che anche questi ossidi vengano definiti come tali, indicandone la composizione. Ad esempio CO2 = diossido di carbonio e non anidride carbonica. Il termine anidride è comunque tuttora accettabile nella nomenclatura comune.
Come faccio per 'ricostruire' l'ossido?
Basta tener presente che negli ossidi il numero di ossidazione dell'Ossigeno è sempre -2.
Come scelgo l'ossido 'opportuno'?
Negli ossoacidi, per distinguere il grado di ossidazione dell'elemento caratteristico si usano le desinenze -oso e -ico: la prima per il n° di ox inferiore, la seconda per quello superiore. Qualora queste non siano sufficienti -e solo allora-, si fa ricorso ai prefissi ipo- e per- (vedi ad esempio il caso degli ossoacidi del Cloro).
Nei sali, le desinenze -oso e -ico diventano rispettivamente -ito e -ato, mentre gli eventuali prefissi vengono mantenuti inalterati.
|
N° di ossidazione |
Sale |
Ossoacido |
|
minore |
ipo-elemento-ito |
ipo-elemento-oso |
|
intermedio 1 |
elemento-ito |
elemento-oso |
|
intermedio 2 |
elemento-ato |
elemento-ico |
|
maggiore |
per-elemento-ato |
per-elemento-ato |
Come faccio per conoscere i numeri di ossidazione di un elemento?
Su una delle due facce della Tavola Periodica sono riportati i numeri di ossidazione più comuni degli elementi. Il numero in grassetto indica il grado di ossidazione più stabile.
E a questo punto?
Mettiamo in pratica le nozioni acquisite.
Poniamo che vi venga richiesto di scrivere il sale nitrato di sodio.
1. La
desinenza -ato del sale indica che esso deriva da un acido -ico,
per l'esattezza dall'acido nitrico, ovvero l'ossoacido dell'Azoto con
più elevato grado di ossidazione (+5).
Ricordate che, tranne per pochi elementi di transizione, il massimo numero di
ossidazione di un elemento non può mai essere maggiore del suo gruppo di
appartenenza.
2. Se non ricordo la formula dell'acido nitrico, dovrò ricostruirla, aggiungendo acqua all'anidride nitrica.
3. Devo
quindi scrivere l'ossido dell'Azoto con grado di ossidazione +5.
Poiché negli ossidi l'Ossigeno ha sempre no. di ox -2, affinché la somma dei
numeri di ossidazione dell'ossido (composto neutro) risulti ZERO, dovrò
prendere 2 atomi di azoto e 5 di ossigeno:
N2O5
Pentossido di diazoto o anidride nitrica
4. Nella reazione del pentossido di diazoto con l'acqua, occorre fare attenzione che:
N2O5
+ H2O = 2 HNO3 (2 molecole di acido nitrico)
e non
N2O5 + H2O = H2N2O6
5. Infine, per scrivere il sale devo sostituire l'H (ione H+) dell'acido nitrico con lo ione sodio (Na+). Quindi:
NaNO3
Nitrato
di Sodio
E questo è tutto?
No, La nomenclatura degli ossoacidi non
è ancora completa! Non abbiamo infatti definito i prefissi meta-, orto-
e piro-, che vengono usati per distinguere il diverso grado di
idratazione dell'ossoacido.
In sintesi, gli acidi orto si ottengono dai meta per aggiunta di una
molecola di acqua, e viceversa (i meta si ottengono dagli orto per
sottrazione di una molecola di acqua).
Il prefisso piro- (o di-) si usa per indicare gli acidi che
derivano dalla condensazione di due molecole di un orto-ossoacido. In pratica,
si raddoppiano gli elementi presenti nell'acido orto e si sottraggono due H e
un O. Anche questi prefissi vengono mantenuti invariati nella nomenclatua dei
sali corrispondenti.
orto =
meta + H2O
meta = orto - H2O
piro = 2 orto - H2O
Ad esempio, del Fosforo si conoscono tre acidi fosforici (no. ox. P = +5):
Il primo, detto polimetafosforico, esiste in forme polimeriche (questo il motivo della scrittura col pedice n della sua formula bruta) e ha qualche interesse solo per la chimica inorganica. I suoi sali più comuni sono i tri- e i tetrametafosfati. Il secondo è detto comunemente acido fosforico. E' un acido triprotico e forma quindi tre tipi di sali: Fosfati neutri (ione PO43-), monoidrogenofosfati (ione HPO42-), e diidrogenofosfati (ione H2PO2-). Quindi il sale Ca3(PO4)2, indicato comunemente come fosfato di calcio, si dovrebbe definire più precisamente ortofosfato neutro di Calcio
Il terzo acido fosforico, il pirofosforico (o difosforico) deriva dalla condensazione di due molecole di acido ortofosforico. Lo ione pirofosfato è un composto molto importante dal punto di vista biologico.
Oltre agli acidi ossigenati, nella chimica inorganica esiste un'altra categoria di acidi, detti idracidi. Gli idracidi sono sostanzialmente composti binari dell'Idrogeno con un alogeno, con lo zolfo. o con il gruppo CN- (cianuro). La desinenza caratteristica di questi acidi è -idrico, che nei corrispondenti sali diventa -uro.
Ad esempio:
HCl = acido cloridrico => NaCl = Cloruro di Sodio
HCN = acido cianidrico => KCN = Cianuro di Potassio
Generalmente le formule degli ossoacidi si scrivono indicando nell'ordine H, elemento caratteristico, O; mentre quelle degli idrossidi si scrivono indicando prima il metallo e poi gli ioni OH-. Questo ha il vantaggio di permettere l'immediato riconoscimento della natura del composto: acido o base, rispettivamente. Nelle formule dei sali si usa scrivere prima il metallo (o il catione) e poi l'anione dell'acido.
Al termine di questa breve escursione, che peraltro non può essere considerata del tutto ortodossa dal punto di vista chimico, chi non avesse voglia di spremersi eccessivamente le meningi nel seguire questa procedura per la scrittura dei sali, deve fare almeno uno sforzo di memoria e imparare a mente le formule dei più comuni ossoacidi elencati in una tabella a parte.
La conoscenza di queste formule è sufficiente per scrivere sia le formule brute dei sali, sia le strutture degli ossoacidi che vengono normalmente richiesti in sede di esame.
Dove non compare la formula dell'acido, significa che esso non esiste come tale, pur esistendo i suoi sali.
III e IV Gruppo
|
Elemento |
no. ox |
Acido |
Anione |
Struttura |
|
Boro |
|
|
BO2- |
|
|
|
|
H3BO3 |
BO33- |
|
|
Carbonio |
|
H2CO3 |
CO32- |
|
|
|
|
|
CO44- |
|
|
|
|
|
C2O76- |
|
V Gruppo
|
Elemento |
no. ox |
Acido |
Anione |
Struttura |
|
Azoto |
|
HNO2 |
NO2- |
|
|
|
|
HNO3 |
NO3- |
|
|
Fosforo |
|
H3PO2 |
H2PO2- |
|
|
|
|
H3PO3 |
HPO32- |
|
|
|
|
H3PO4 |
PO43- |
|
|
|
|
H4P2O7 |
P2O74- |
|
Si noti la particolarità degli acidi fosfinico e fosfonico che hanno rispettivamente due e un idrogeno direttamente legato all'elemento caratteristico.
VI Gruppo
|
Elemento |
no. ox |
Acido |
Anione |
Struttura |
|
Zolfo |
|
H2SO3 |
SO32- |
|
|
|
|
H2SO4 |
SO42- |
|
|
|
|
|
S2O32- |
|
|
|
|
|
S2O52- |
ione disolfito (no ossigeno a ponte!) |
|
|
|
H2S2O7 |
S2O72- |
|
|
|
|
H2S2O8 |
S2O82- |
|
|
|
|
|
S2O42- |
|
|
|
|
H2S2O6 |
S2O62- |
|
|
|
|
Acidi
politionici: |
Esempio: |
es: acido tetrationico |
VII Gruppo
|
Elemento |
no. ox |
Acido |
Anione |
Struttura |
|
Cloro |
|
HClO |
ClO- |
|
|
|
|
HClO2 |
ClO2- |
|
|
|
|
HClO3 |
ClO3- |
|
|
|
|
HClO4 |
ClO4- |
|
|
Bromo |
|
HBrO |
BrO- |
vedi acido ipocloroso |
|
|
|
HBrO3 |
BrO3- |
vedi acido clorico |
|
|
|
HBrO4 |
BrO4- |
vedi acido perclorico |
|
Iodio |
|
HIO |
IO- |
vedi acido ipocloroso |
|
|
|
HIO3 |
IO3- |
vedi acido clorico |
|
|
|
HIO4 |
IO4- |
vedi acido perclorico |
|
|
|
Lo iodio a n.o. +7, oltre all'acido periodico (detto acido metaperiodico), forma altri due ossiacidi, mesoperiodico (H3IO5) e ortoperiodico (H5IO6). |
||
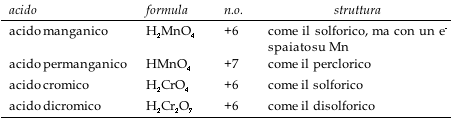
Oltre agli acidi ossigenati elencati, è opportuno ricordare:
 |
| Appunti su: ioduro di idrogeno formula, tavola periodica degli ossidi, tabella completa nomenclatura, tabella acidi basi anfoteri, ortoborato di alluminio, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |