 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2005 | Gradito: |
Leggi anche appunti:Pesi atomici e molecolari relativi: l'unità di massa atomicaPesi atomici e molecolari relativi: l'unità di massa atomica Se infatti volumi uguali Acidi e basi secondo LewisAcidi e basi secondo Lewis La definizione più estensiva di acido e base I sistemi ternariI sistemi ternari Finora abbiamo trattato, al massimo, sistemi binari, ma |
 |
 |
la chimica organica è la chimica del carbonio
La chimica del carbonio è molto più complessa della chimica degli altri elementi e, per questa ragione, viene trattata separatamente come materia a sé stante.
La chimica organica era considerata la chimica del mondo vivente
Si pensava che i composti organici non potessero essere sintetizzati in laboratorio.
Questa credenza traeva origine dal fatto che i composti ricavati da organismi viventi (piante, animali) erano difficilmente isolabili e purificabili e, pur contenendo un numero limitato di elementi (carbonio, idrogeno, ossigeno), possedevano caratteristiche completamente diverse gli uni dagli altri.
Queste osservazioni diedero origine alla teoria vitalistica, secondo la quale i composti organici contenevano una forza vitale che scaturiva dagli organismi viventi che li avevano generati e non potevano essere sintetizzati altro che da essi.
Nel 1828 il chimico tedesco Federic Wholer ottenne l'urea (un composto organico) per riscaldamento dell' isocianato di ammonio, un sale inorganico. Questa scoperta casuale segnò la fine della teoria vitalistica.
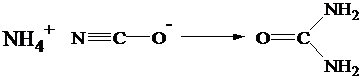 |

Friedrich Wholer (1800-1882)
Da dove nasce la complessità
della chimica organica?
La complessità della chimica organica deriva dal fatto che il carbonio forma legami forti con molti elementi, in particolare con i metalloidi:
tutti gli alogeni (F, Cl, Br, I);
nel 6° gruppo ossigeno, zolfo, selenio;
nel 5° gruppo azoto;
nel 4° gruppo silicio;
nel 3° gruppo boro.
Forma legami quasi ionici anche con numerosi metalli, in particolare litio, sodio, magnesio.
Tuttavia, la caratteristica fondamentale del carbonio è la capacità di formare forti legami con l'idrogeno e con sé stesso.
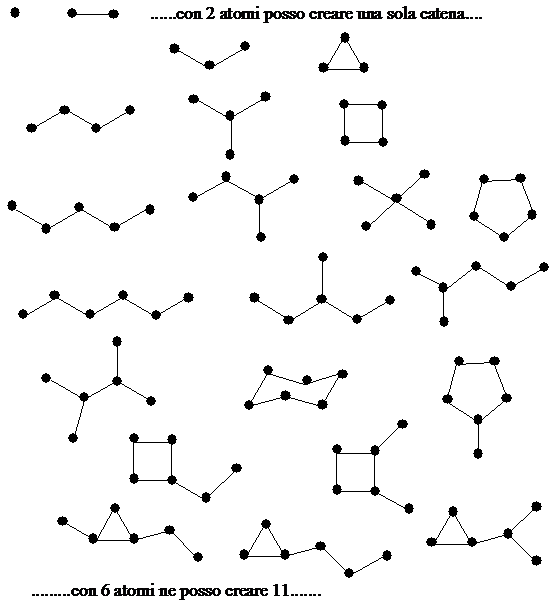
La capacità di formare legami con sé stesso porta alla creazione di catene (lineari, ramificate o cicliche) che formano lo scheletro delle molecole organiche.

Grazie a queste caratteristiche, i composti attualmente noti del carbonio sono più di 10 milioni
Friedrich August Kekulè von Stradonitz.
(Darmstadt, 1829 - Bonn, 1896)
Nel 1858 postulò che gli atomi di carbonio
possono combinarsi l'uno con l'altro per formare catene di qualsiasi
lunghezza e complessità e che il carbonio ha sempre valenza quattro. Formulò il concetto che lo studio
dei prodotti di reazione può dare informazioni sulla struttura, gettando le
basi della moderna chimica organica strutturale. Il suo nome è tuttavia
associato alla definizione (1865) della struttura del benzene basata sulla risonanza, struttura che
fino a quel momento era stata un enigma per i chimici dell'epoca. La
leggenda racconta che l'intuizione gli venne da un sogno: addormentatosi
davanti al fuoco, nel sonno vide sei scimmie che correvano in cerchio
tenendosi per la coda.

Scheletri molecolari con 1, 2 ,3 4, 5 e 6 atomi di Carbonio
Richiami di Chimica Generale
L'elettrone viene descritto come se fosse un'onda tramite l'equazione di Schroedinger. Le infinite soluzioni dell'equazione d'onda introducono il concetto di orbitale, inteso come la regione di spazio entro cui si ha la probabilità massima di trovare l'elettrone. La forma dell'orbitale e la sua energia (ovvero, l'energia dell'elettrone che occupa la regione di spazio definita dall'orbitale) dipendono dai 3 numeri quantici n, l, m. Il numero quantico s definisce l'orientazione del momento magnetico dell'elettrone rispetto a un campo magnetico esterno.
Da n (numero quantico principale) dipendono le dimensioni e l'energia dell'orbitale
n può assumere tutti i valori da 1 a (in realtà, sono noti atomi con n fino a 7)
Da l dipendono la forma e l'energia degli orbitali
l può assumere tutti i valori da 0 a n-1
Da m dipende la direzione spaziale degli orbitali
m può assumere tutti i valori da -l a +l
Da s (numero quantico di spin) dipende l'orientazione del momento
magnetico dell'elettrone rispetto a un campo magnetico esterno
s puè assumere i valori +1/2 e -1/2
Principio di esclusione di Pauli
non esistono due elettroni sullo stesso atomo aventi tutti i numeri quantici uguali.
Corollario al Principio di esclusione di Pauli
poiché un orbitale è definito dai numeri quantici n, l e m, in un orbitale possono stare solo due elettroni, uno con spin +1/2 e l'altro con spin -1/2 (spin antiparalleli)
Configurazione elettronica
Descrive in quali orbitali si dispongono gli elettroni di un elemento.
Gli elettroni si dispongono a due a due con spin antiparallelo riempendo gli orbitali ad energia più bassa.
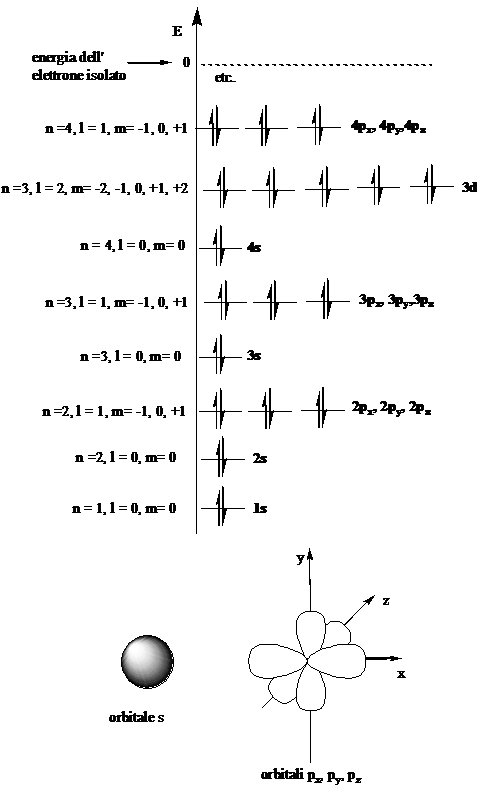
Potenziale di ionizzazione (IP): l'energia richiesta per estrarre un elettrone da un atomo.
Poiché è energia che viene fornita al sistema, l'IP è sempre negativo.
L'estrazione di un elettrone da un atomo (neutro) fornisce una specie contenente un eccesso di una carica positiva (ione positivo o catione).
Affinità elettronica (EA): l'energia che viene liberata quando si immette un elettrone in un atomo.
Poiché è energia che viene fornita dal sistema, è sempre positiva.
L'immissione di un elettrone in un atomo neutro genera una specie contenente un eccesso di una carica negativa (ione negativo o anione)
Elettronegatività (x è la media tra il potenziale di ionizzazione e l'affinità elettronica.
x = (IP + EA)/2
Elementi con bassa elettronegatività sono definiti metalli.
Elementi con alta elettronegatività sono definiti non-metalli
Dimitry Ivanovich Mendeleev
(Tobolsk, Siberia, 1834 -
San Pietroburgo, 1907)
Tavola periodica degli elementi
(Tavola di Mendeleev)
Raccoglie tutti gli elementi noti in ordine crescente di numero atomico. Gli elementi sono classificati in modo che in una riga (periodo) sono contenuti gli elementi con lo stesso numero quantico n (stesso guscio esterno), mentre in una colonna (gruppo) sono presenti elementi con la stessa configurazione elettronica del guscio esterno, definita dai numeri quantici l e m.
|
Gruppo |
Configurazione |
Denominazione |
Caratteristiche |
|
|
s1 |
Metalli alcalini |
Metalli forti (Li, Na, K, Cs) |
|
|
s2 |
Alcalino terrosi |
Metalli (Be, Mg, Ca, Ba) |
|
|
s2 p1 |
Terre |
Non metalli (B), anfoteri (Al, Ga), metalli In) |
|
|
s2px1py1 |
|
Non metalli (C, Si), anfoteri (Sn), metalli (Pb) |
|
|
s2px1py1pz1 |
|
Non metalli (N, P), anfoteri (As, SB) |
|
|
s2px2py1pz1 |
|
Non metalli (O, S, Se) |
|
|
s2px2py2pz1 |
Alogeni |
Non metalli (F, Cl, Br, I) |
|
|
s2px2py2pz2 |
Gas nobili |
Non reattivi |
Da sinistra a destra (lungo un periodo) aumentano sia l'affinità elettronica che il potenziale di ionizzazione e, di conseguenza, l'elettronegatività, (aumenta il carattere non-metallico). Dall'alto al basso (lungo un gruppo) aumentano le dimensioni dell'orbitale, quindi diminuisce il potenziale di ionizzazione (aumento del carattere metallico).
 |
| Appunti su: la chimica del carbonio dispense, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |