 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2364 | Gradito: |
Leggi anche appunti:Radiazioni elettromagnetiche e atomiRadiazioni elettromagnetiche e atomi Le radiazioni luminose (sia visibili Combustori a bassa emissione di inquinantiCOMBUSTORI A BASSA EMISSIONE DI INQUINANTI 1.1. Introduzione Nel Calcolo del bilancio ionicoCalcolo del bilancio ionico Tra le procedure applicate per il controllo della |
 |
 |
La definizione più estensiva di acido e base è stata proposta da Lewis.
La reazione tra un acido di Lewis ed una base di Lewis forma un addotto o complesso
A + B: → B:A
Acido Base Addotto (o complesso)
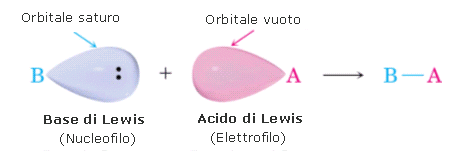
La reazione tra un base ed un acido di Lewis viene rappresentata con frecce curve che partono dal doppietto elettronico della base e vanno all'orbitale vuoto dell'acido.
E' possibile verificare che tutti gli acidi e le basi di Brønsted sono anche acidi e basi di Lewis. Ad esempio
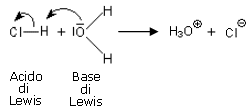
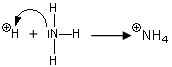
Ma la reazione tra il trifluoruro di boro e l'ammoniaca può essere descritta come una reazione acido/base solo secondo Lewis.
Il trifloruro di boro è un acido di Lewis, mentre non è un acido di Brønsted.
La formazione dello ione idratato esaacquoalluminio [Al(H2O)6]3+ è un altro esempio di una reazione acido-base secondo Lewis. Il catione metallico Al3+ è un acido di Lewis, mentre le sei molecole di acqua che si legano ad esso sono basi di Lewis.
La definizione di Lewis consente di includere tra gli acidi un maggior numero di sostanze rispetto alla definizione di Brønsted. Sono acidi di Lewis i cationi metallici come Mg2+, i composti del gruppo 3A come BF3 e AlCl3 che presentano un orbitale vuoto ed in generale i composti dei metalli di transizione con un orbitale vuoto come TiCl4, FeCl3 eZnCl2.
 |
| Appunti su: appuntimania, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |