Il numero di Avogadro
Si può facilmente
verificare che 1 mole di una qualsiasi sostanza contiene sempre lo stesso
numero di particelle costituenti (atomi, ioni, molecole etc). Per calcolare
tale numero è sufficiente dividere il peso di una mole (Peso molare) per il
peso di una particella (Peso molecolare assoluto).
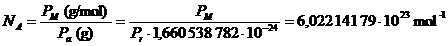
Il Peso molare ed
il Peso molecolare relativo sono per definizione numericamente uguali per
qualsiasi sostanza. Il loro rapporto vale dunque sempre 1 ed il numero di
particelle contenuto in una mole risulta essere il medesimo per ogni sostanza e
numericamente pari al reciproco della massa in grammi dell'unità di massa
atomica. Tale numero, indicato con NA, è conosciuto come numero di Avogadro
(si noti che, se si
esprime il peso molare in kg/mol, il fattore di conversione a denominatore vale
1,6605 10-27 kg/u ed il numero di particelle per mole risulta essere
1000 volte più elevato)
È allora possibile
introdurre una definizione più generale di mole: una mole è una quantità di sostanza contenente un numero di Avogadro
di entità costituenti, identiche e numerabili. Così è possibile ad
esempio parlare di una mole di elettroni senza far riferimento al loro peso, ma
al loro numero ed in definitiva alla loro carica complessiva e quindi ad una
certa quantità di carica elettrica (il Faraday
= 96.485,34 C).
|
Esempio calcolare quante molecole sono
contenute in un bicchier d'acqua avente la capacità di 0,135 litri.
L'acqua
presenta una densità di 1 kg dm-3 (1 dm3 = 1 l) e 0,135
l pesano pertanto 135g che corrispondono a
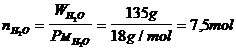
il numero di molecole presenti in 7,5 moli sarà
dunque pari a 7,5 mol x 6,022 1023 mol-1 = 4,52 1024
|
Una conseguenza del
principio di Avogadro è che un medesimo numero di moli di una qualsiasi
sostanza gassosa devono occupare sempre il medesimo volume (a P e T costanti).
Infatti se 'volumi uguali di gas diversi
nelle stesse condizioni di T e P contengono lo stesso numero di particelle',
allora deve anche essere vero che "gas che
contengono lo stesso numero di particelle devono occupare lo stesso volume".
Se ne deduce pertanto che 1 mole di un qualsiasi gas, contenendo sempre lo
stesso numero di particelle (il numero di Avogadro) deve occupare sempre il medesimo volume ed in
particolare, a 0°C e alla pressione di 1 atm occupa un volume pari a 22,414 l, detto volume molare standard




![]()



