 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2565 | Gradito: |
Leggi anche appunti:Determinazione della quantità di prodotto ricorrendo alle moliDeterminazione della quantità di prodotto ricorrendo alle moli Materiale:beuta, Configurazioni elettroniche e Strutture di Lewis degli elementiConfigurazioni elettroniche e Strutture di Lewis degli elementi Se prendiamo Gli Orbitali ibridiGli Orbitali ibridi L'Ibridizzazione prende origine dal fatto che un legame |
 |
 |
L'acqua pura presenta una piccolissima percentuale di molecole dissociate in ioni H+ e ioni OH¯ - secondo il seguente equilibrio (autoprotolisi o autoionizzazione)
H2O + H2O ![]() OH¯ + H3O+
OH¯ + H3O+
L'equilibrio viene tuttavia descritto in modo semplificato considerando solo la molecola d'acqua che si dissocia e non quella che forma il legame dativo con lo ione H+ per dare lo ione ossonio H3O+
H2O ![]() H+ + OH-
H+ + OH-
Anche per tale reazione di dissociazione è possibile calcolare una costante di equilibrio che, alla temperatura di 25°C, vale
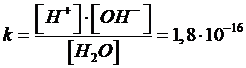
Dal valore della costante di dissociazione deduciamo che l'equilibrio è fortemente spostato verso sinistra. Per questo motivo, possiamo ritenere trascurabile la frazione x di molecole d'acqua che si dissociano rispetto all'acqua indissociata, e considerare la concentrazione di quest'ultima pari alla concentrazione dell'acqua pura.
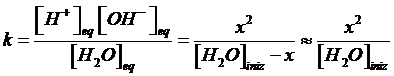
La concentrazione dell'acqua pura è ovviamente una costante e vale
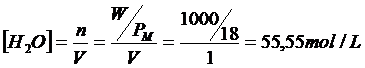
Si conviene pertanto di inglobare la concentrazione dell'acqua nella costante di dissociazione, ottenendo
![]()
La nuova costante kw è detta prodotto ionico dell'acqua e vale
![]()
Poiché nell'acqua pura le uniche molecole che si dissociano sono ovviamente quelle dell'acqua e ogni molecola d'acqua che si dissocia produce uno ione H+ ed uno ione OH-, è evidente che le due specie ioniche dovranno trovarsi nell'acqua in numero uguale, dovranno cioè possedere la stessa concentrazione. Risulta pertanto evidente che la loro concentrazione dovrà essere pari a
![]()
10-7 è evidentemente anche il numero di moli di acqua che si dissociano in un litro d'acqua. Possiamo pertanto calcolare il suo grado di dissociazione
![]()
il che significa che nell'acqua pura a 25°C si dissociano circa 2 molecole d'acqua su 1 miliardo.
Le soluzioni in cui ![]() sono dette neutre
sono dette neutre
Le soluzioni in cui ![]() sono dette acide
sono dette acide
Le soluzioni in cui ![]() sono dette basiche
sono dette basiche
Si tenga comunque presente che la reazione di dissociazione dell'acqua
è una reazione endotermica e quindi, in base al principio di Le Chatelier,
la kw aumenta all'aumentare
della temperatura. Così a temperature maggiori di 25°C la neutralità si
raggiunge per concentrazioni degli ioni H+ e OH-
leggermente superiori di 10-7 mol/L (![]() ).
).
Poiché a Temperatura costante kw è costante, si osservi come nel caso sia nota la [H+] rimanga univocamente determinata anche [OH-] e viceversa.
Essendo [H+] e [OH-] espresse da valori molto piccoli risulta più comodo usare, per misurarle, una notazione logaritmica. Si conviene pertanto di esprimere la concentrazione degli ioni H+ in termini di pH, il quale risulta definito tramite la seguente relazione:
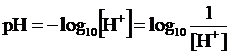
In modo del tutto analogo si può definire come unità di misura della concentrazione degli ioni OH- in una soluzione il pOH
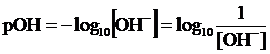
Tra pH e pOH esiste una semplice relazione che possiamo ottenere calcolando il logaritmo negativo di entrambi i membri del prodotto ionico dell'acqua
![]()
da cui
![]()
La somma del pH e del pOH è sempre uguale a 14
Poiché nelle soluzioni neutre ![]() , allora per esse vale anche pH = pOH = 7
, allora per esse vale anche pH = pOH = 7
Costruiamo ora una tabella che metta in relazione il valore delle concentrazioni degli ioni H+ e degli ioni OH- con i valori del pH e del pOH
|
[H+] |
pH |
[OH-] |
pOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Come si può notare il pH può assumere anche valori negativi e valori superiori a 14. Si tratta comunque di casi piuttosto rari con concentrazioni di ioni H+ eccezionalmente basse o elevate.
Si noti inoltre come, essendo la scala del pH una scala logaritmica, ogni grado di pH corrisponde ad una variazione nella concentrazione degli ioni H+ pari a 10 volte. Così una soluzione a pH 2 presenta una concentrazione degli ioni H+ 1000 volte maggiore di una soluzione a pH 5.
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicail-prodotto-ionico-dellacqua14php, prodotto ionico dell27acqua e ph, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |