 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 4468 | Gradito: |
Leggi anche appunti:Criteri di stabilità delle strutture risonantiCriteri di stabilità delle strutture risonanti Abbiamo visto che le strutture-limite Equazione di Clausius-Clapeyron e Legge di HenryEquazione di Clausius-Clapeyron e Legge di Henry Combinando l'equazione di Atomo, Legame metallico, Legame covalente, Legame ionicoAtomo La più piccola porzione di materia che può definire un elemento e che ne |
 |
 |
La vita di una cellula dipende in larga misura dalla sua capacità di immagazzinare ed utilizzare energia. L'unico modo che la cellula possiede per immagazzinare energia è quella di fissarla all'interno dei legami chimici che tengono uniti gli atomi nelle molecole.
E' infatti attraverso una continua rottura e ricostruzione dei legami chimici e quindi attraverso un lavoro ininterrotto di demolizione e di riassemblaggio di molecole (metabolismo cellulare) che la cellula fa circolare l'energia al suo interno.
Una delle caratteristiche importanti di ogni legame chimico è dunque proprio il suo contenuto energetico, comunemente (anche se impropriamente) detto forza di legame.
Durante una reazione chimica vengono rotti alcuni legami dei reagenti, mentre si formano altri legami necessari per la sintesi dei prodotti di reazione.
Una reazione avviene con liberazione di energia (reazione esoergonica) se i legami che si spezzano sono più energetici dei legami che si formano. In tal caso possiamo affermare che i reagenti sono più energetici dei prodotti di reazione.
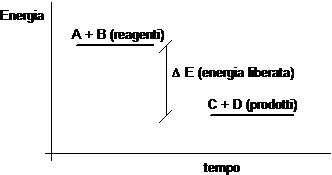
Se al contrario una reazione avviene con assorbimento di energia (reazione endoergonica) e i legami che si spezzano sono meno energetici dei legami che si formano, allora possiamo affermare che i reagenti sono meno energetici dei prodotti di reazione.
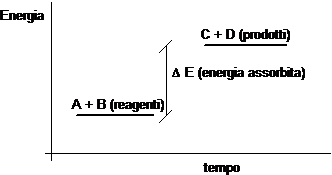
Le variazioni energetiche (E) associate alla rottura ed alla formazione dei legami chimici si misurano normalmente in chilocalorie su mole (kcal/mol) o chilojoule su mole (kj/mol)
Ricordiamo che una caloria è la quantità di calore necessaria per far aumentare la temperatura di 1 g di acqua, portandola da 14,5°C a 15,5°C e che 1 cal = 4,186 J
Un esempio di reazione esoergonica è la combustione del metano in presenza di ossigeno.
CH4 + 2O2 CO2 + 2H2O + 212,8 kcal
Ogni mole di metano (16 g) che brucia libera dunque 212,8 Kcal
Un esempio di reazione endoergonica è la scissione dell'acqua in idrogeno ed ossigeno
2H2O + 136,6 Kcal 2H2 + O2
Per spezzare una mole di acqua (18 g) è necessario dunque fornire 68,3 Kcal.
Come si è già avuto modo di dire la reattività di un elemento chimico dipende essenzialmente dalla sua configurazione elettronica superficiale, tanto che gli elettroni che si trovano nel livello energetico più esterno sono spesso detti elettroni di legame.
Esistono 2 modi fondamentali attraverso cui un atomo può utilizzare tali elettroni per legarsi con un altro atomo, dando luogo ad altrettanti tipi di legami: il legame ionico ed il legame covalente.
Poichè, come abbiamo già detto, gli elettroni coinvolti nei legami chimici sono quelli che occupano il livello energetico più superficiale (elettroni di valenza), introduciamo un metodo semplice per rappresentare i primi 8 elettroni, noto come configurazione di Lewis degli elementi.
Secondo tale metodo i 2 + 6 elettroni dei primi due sottolivelli (1 orbitale s e 3 orbitali p) del livello più esterno vengono rappresentati come punti o coppie di punti disposte ai quattro lati del simbolo chimico dell'elemento. Ogni lato rappresenta un orbitale e può contenere al massimo 2 elettroni. Per maggior chiarezza diamo la configurazione di Lewis degli elementi appartenenti al 3° periodo.
![]()
Le coppie di elettroni vengono più spesso rappresentate con una barretta.
Prendiamo in considerazione un elemento appartenente al primo gruppo, ad esempio il Sodio (Na). Il Sodio ha numero atomico Z = 11 e quindi oltre a possedere 11 protoni possiede 11 elettroni. Gli 11 elettroni sono sistemati: 2 a saturare il primo livello energetico; 2 + 6 = 8 a saturare il secondo livello energetico; 1 elettrone inizia il riempimento del terzo livello energetico.
Si noti che il Sodio presenta un elettrone in più rispetto al gas nobile che lo precede nella tabella periodica, il Neon. Come sappiamo la configurazione dei gas nobili è particolarmente stabile (regola dell'ottetto) ed il Sodio tenderà dunque a liberarsi del suo elettrone superficiale per assumere la configurazione elettronica stabile del Neon.
In tal modo però viene 'scoperta' una carica positiva del nucleo. Infatti il Sodio viene ad avere 11 protoni e 10 elettroni.
Il Sodio si trasforma in un atomo con una carica netta positiva o ione positivo Na+
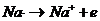
Si dicono ioni gli atomi elettricamente carichi, positivamente o negativamente. Uno ione positivo o catione si forma per perdita di uno o più elettroni.
Allo stesso modo il Calcio (Ca), che appartiene al secondo gruppo, presenta 2 elettroni in più del gas nobile che lo precede, l'Argon. Il Calcio ha un'elevata tendenza a perdere questi due elettroni per raggiungere la configurazione elettronica stabile dell'Argon.
In questo modo si trasforma in un catione con due cariche positive Ca++ o, il che è lo stesso, Ca2+ (calcio due più).
Prendiamo in considerazione ora un elemento del settimo gruppo come il Cloro con Z = 17.
Il Cloro sistema i suoi 17 elettroni: 2 nel 1° livello (saturandolo) , 8 nel 2° livello (saturandolo) ed i rimanenti 7 nel 3° livello.
Al Cloro manca un solo elettrone per raggiungere la configurazione stabile (8 elettroni) del gas nobile che lo segue (Ar) nella tabella periodica, l'Argon. Per il Cloro è infatti più semplice (energeticamente più vantaggioso) acquistare un elettrone, piuttosto che perderne 7 per raggiungere la configurazione del gas nobile che lo precede (Ne).
Acquistando 1 elettrone il Cloro si trasforma in uno ione negativo Cl-. Con un elettrone in più infatti il Cloro viene a possedere 18 elettroni contro i 17 protoni del suo nucleo, evidenziando in tal modo una carica netta negativa.
![]()
Gli ioni negativi o anioni sono atomi che hanno acquistato uno o più elettroni
Se dunque noi avviciniamo del Cloro gassoso Cl2 e del Sodio metallico Na, assisteremo ad una violenta reazione esoergonica. Il Sodio, che presenta una elevata tendenza a liberarsi del suo elettrone, lo cede al Cloro che presenta da parte sua una grande tendenza ad acquistarlo.
![]()
Ma lo ione Sodio Na+ e lo ione Cloro Cl- non rimangono a questo punto separati. Presentando due cariche di segno opposto essi si attirano formando una molecola, complessivamente neutra, la cui formula bruta è NaCl, il Cloruro di Sodio.
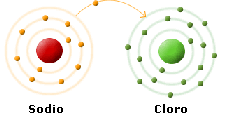
Si è dunque formato un legame chimico di tipo elettrostatico tra ioni aventi carica opposta: il legame ionico. I composti che presentano questo tipo di legame si dicono composti ionici.
Dire che entrambi gli atomi raggiungono in tal modo una configurazione più stabile significa affermare che diminuiscono il loro contenuto energetico. L'energia si libera in genere sotto forma di calore di reazione.
2Na + Cl2 2 NaCl + 196,53 kcal
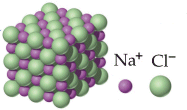
In realtà non esiste una singola molecola di Cloruro di Sodio, come abitualmente e convenzionalmente si scrive. Infatti l'attrazione tra cariche di segno opposto, come sono cationi e anioni, non si sviluppa solo in un'unica direzione, ma agisce uniformemente in tutte le direzioni (con simmetria sferica). Uno ione Na+ risulta infatti circondato da 6 ioni Cl- e viceversa., formando uno sconfinato reticolato cubico, in cui ioni di carica opposta si alternano ordinatamente nelle tre direzioni dello spazio. Tale disposizione ordinata è detta cristallina, poichè genera macroscopicamente un cristallo che conserva la geometria della sottostante struttura atomica.
Nei composti ionici quindi la formula bruta non descrive una struttura molecolare autonoma, ma indica il rapporto numerico esistente nel cristallo tra ioni positivi e negativi. Nel caso del Cloruro di Sodio, ad esempio, la formula bruta NaCl ci informa che il rapporto numerico tra ioni Na+ e Cl- all'interno del reticolo è di 1:1.
Se la reazione fosse avvenuta tra il Calcio ed il Cloro, il Calcio avrebbe ceduto due elettroni a 2 atomi di Cloro, ciascuno dei quali avrebbe acquistato un elettrone.
In tal caso affinchè il reticolato ionico sia nel complesso neutro è necessario che per ciascun ione Ca2+ siano presenti 2 ioni Cl-.
La formula CaCl2 indica dunque che nel reticolo cristallino del Cloruro di Calcio il rapporto tra ioni Calcio e ioni Cloro è 2:1.
Le sostanze ioniche, poste in acqua si dissociano negli ioni costituenti.
In acqua quindi le sostanze ioniche non sono presenti come molecole, ma come ioni
In tutte le soluzioni acquose che costituiscono gli esseri viventi e nelle cellule in particolare, si trovano ioni di interesse biologico quali appunto: K+, Na+, Ca2+, Mg2+, Cl- etc.
In generale gli ultimi elementi di ciascun periodo hanno tutti una grande tendenza ad acquistare elettroni, mentre i primi elementi di ciascun periodo presentano una forte tendenza a perdere elettroni. Quando atomi di questo tipo interagiscono tendono a scambiarsi elettroni per formare legami ionici.
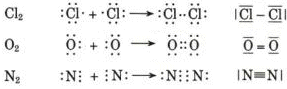
Ma come possiamo spiegare il legame esistente tra due atomi che, trovandosi alla fine di un periodo hanno entrambi una forte tendenza ad acquistare elettroni? Come spieghiamo ad esempio il legame che tiene uniti due atomi di Cloro nella molecola biatomica Cl2?
Quando due atomi di Cloro si avvicinano ciascuno dei due tende a strappare l'elettrone all'altro, senza peraltro riuscirvi.
![]()
Ma l'attrazione reciproca di ciascun nucleo sull'elettrone dell'altro atomo agisce come una forza di legame che mantiene i due atomi uniti. I due atomi di Cloro "condividono" una coppia di elettroni e tale "condivisione" costituisce il legame covalente. La condivisione avviene tramite sovrapposizione e "fusione" dei due orbitali atomici che contengono ciascuno un singolo elettrone con formazione di un unico orbitale molecolare di legame.
In questo modo ora i due elettroni non appartengono più all'uno o all'altro atomo, ma ruotano entrambi intorno all'intera struttura molecolare biatomica.
Si dice che i due elettroni sono stati messi in comune o in compartecipazione.
Ciascun nucleo 'vede' ora intorno a sè i 6 elettroni non condivisi più i 2 elettroni condivisi per un totale di 8 elettroni. La condivisione di una coppia di elettroni permette a ciascun atomo di Cloro di raggiungere la configurazione stabile dell'ottetto. Alla molecola biatomica del Cloro viene assegnata la seguente formula di struttura
Cl - Cl
dove il trattino indica i due elettroni condivisi e quindi il legame covalente tra i due atomi di idrogeno.
Prendiamo ora in considerazione la molecola biatomica dell'Ossigeno O2. L'Ossigeno presenta 8 elettroni di cui 6 nel livello energetico più esterno. Quando due atomi di ossigeno si avvicinano ciascuno cerca di strappare all'altro due elettroni, senza riuscirvi, per raggiungere la configurazione dell'ottetto.
Il risultato è che in questo caso vengono messe in comune 2 coppie di elettroni con sovrapposizione di 2 coppie di orbitali e formazione di 2 orbitali di legame, ciascuno contenente una coppia di elettroni. Ciascun atomo di ossigeno ora 'vede' intorno a sè 8 elettroni nel suo livello energetico più superficiale. La molecola di O2 è quindi tenuta insieme da un legame covalente doppio. La formula di struttura è
O = O
dove il doppio trattino indica i due legami.
Esistono anche legami covalenti tripli come nel caso dell'Azoto gassoso N2. Qui ciascun atomo di Azoto, possedendo solo 5 elettroni superficiali è costretto a condividerne 3 con un altro atomo di azoto per completare l'ottetto.
N N
I legami covalenti sono direzionali, nel senso che essi formano tra loro angoli ben determinati. Ad esempio l'angolo compreso tra i due legami Idrogeno-Ossigeno nell'acqua è di circa 105°.
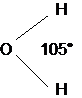
Inoltre mentre i legami semplici permettono la libera rotazione degli atomi intorno all'asse di legame, i legami doppi e tripli non permettono rotazioni. La possibilità o meno di effettuare delle torsioni interne alle molecole ha delle conseguenze notevoli soprattutto per le grosse molecole organiche. Le proteine, ad esempio, macromolecole formate da migliaia di atomi, sono in grado di assumere strutture e funzioni specifiche proprio tramite rotazioni interne attorno agli assi di legame.
Quando gli elettroni vengono condivisi da atomi del medesimo elemento, ciascun atomo li attrae con la medesima intensità. In questo caso gli elettroni condivisi (elettroni di legame) possono essere immaginati come una nuvola negativa che si dipone in maniera omogenea e simmetrica intorno ai due nuclei senza produrre alcun tipo di polarità sulla molecola. Si parla in questo caso di legame covalente puro.
Nella maggior parte dei casi però gli atomi che formano il legame covalente appartengono ad elementi diversi che presentano una diversa forza di attrazione sugli elettroni di legame.
Si definisce elettronegatività χ (chi) la forza con cui un atomo attira a sé gli elettroni condivisi. I valori di elettronegatività si trovano tabulati nella tabella periodica e presentano il valore minimo in basso a sinistra (Francio = 0.7) e crescono diagonalmente fino ad assumere il valore massimo in alto a destra (Fluoro = 4) In genere si usa la scala di elettronegatività di Pauling.
Dunque, quando si forma un legame covalente tra due atomi che presentano diversa elettronegatività la nube elettronica che costituisce il legame covalente risulta spostata verso l'atomo più elettronegativo. Quest'ultimo acquista pertanto una carica parzialmente negativa (indicata con -), mentre l'altro una carica parzialmente positiva (+).La distribuzione asimmetrica della nuvola elettronica produce dunque due poli aventi carica opposta (dipòlo) ed il legame viene perciò definito covalente polare.
E' ciò che accade, ad esempio nella molecola dell'acido Cloridrico (HCl) in cui l'Idrogeno condivide un elettrone con il Cloro. Il Cloro più elettronegativo presenta una parziale carica negativa e la molecola di HCl risulta polare
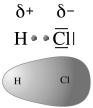
Maggiore è la differenza di elettronegatività (Δχ) tra i due elementi e maggiore sarà la polarità del legame (le cariche parziali saranno più vicine ad una intera carica).
Quando la differenza di elettronegatività tra i due elementi supera il valore critico di 1.9, si assume che l'elemento più elettronegativo sia in grado di strappare l'elettrone all'altro elemento ed il legame viene descritto come ionico.
Possiamo dunque descrivere il legame ionico come un caso limite del legame covalente polare per Δχ > 1.9
Prendiamo ora in considerazione la molecola dell'acqua H2O
Ciascun atomo di Idrogeno condivide il suo elettrone con uno dei due elettroni condivisi dall'Ossigeno
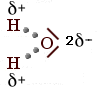
Si formano due legami covalenti. Ma le nuvole elettroniche ad essi associate vengono in questo caso attirate con maggior forza dal nucleo dell'ossigeno (più elettronegativo), il quale contiene ben 8 protoni contro il solo protone che costituisce ciascun nucleo di Idrogeno.
Ancora una volta possiamo rappresentarci la situazione immaginando che la nuvola elettronica negativa sia deformata, più densa sopra l'elemento più elettronegativo.
La carica che si forma alle estremità o poli della molecola sarebbe intera e non parziale solo se la differenza di elettronegatività tra i due elementi fosse talmente elevata da permettere all'elemento più elettronegativo di strappare l'elettrone di legame. In tal caso si formerebbero però due ioni ed il legame non verrebbe descritto più come covalente, ma come ionico.
Tutte le sostanze chimiche che al loro interno presentano dei dipoli si dicono polari, le altre apolari.
La presenza di un dipolo sulle molecole d'acqua può essere facilmente rilevata osservando che un sottile filo d'acqua che scende da un rubinetto viene deviato dalla verticale se gli viene avvicinato un bastoncino di plastica o vetro caricato elettricamente per strofinio.
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicail-legame-chimico93php, legame chimici definizione, cloruro di sodio legame Na Cl formula elettroni, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |