 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3731 | Gradito: |
Leggi anche appunti:Diffusione ed entropiaDiffusione ed entropia La diffusione è dunque un movimento spontaneo delle Legge di Charles o 1a legge di Gay-LussacLegge di Charles o 1a legge di Gay-Lussac (relazione tra V e T con P costante) Nel Il legame ionicoIl legame ionico E' un tipo di legame che può instaurarsi solo tra atomi |
 |
 |
Carbanioni in a al carbonile: gli enolati
Gli anioni stabilizzati dal gruppo carbonile rivestono particolare importanza in Chimica Organica. La forma in risonanza deriva formalmente per perdita di un protone da un enolo (alcol vinilico); pertanto questi ioni sono chiamati enolati.
Gli enolati sono nucleofili bidentati (hanno carattere nucleofilo sia sull'atomo di carbonio e che sull'atomo di ossigeno).
Tuttavia reagiscono solitamente come nucleofili al carbonio.

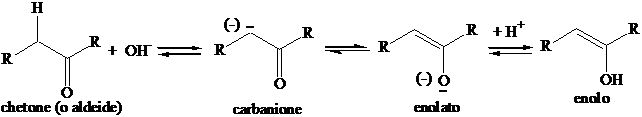
L'equilibrio è solitamente spostato verso la forma chetonica (alcolica), anche se sono note molte eccezioni. L'equilibrio si raggiunge velocemente anche in ambente acido.

Studia
all'università di Palermo. Nel e nel , prima
a Pisa
e poi a Torino,
è assistente di Raffaele Piria (1815-1865). Partecipa ai
moti siciliani del ,
in seguito ai quali viene condannato a morte. Fugge in Francia, poi in
Piemonte, dove ottiene la cattedra di chimica e fisica
al Collegio Nazionale di Alessandria. Qui, nel ,
scopre quella che è nota come reazione di Cannizzaro. Nello
stesso anno diventa professore di chimica all'università di Genova,
poi ottiene la cattedra di chimica organica e inorganica
al'Università di Palermo, quindi nel
all'Università di Roma. Nel 1860
scopre la struttura dell'acqua. La sua fama è legata anche al metodo per la
determinazione dei pesi atomici. Senatore per i suoi meriti scientifici,
diventa vicepresidente del Senato.

Stanislao Cannizzaro
(Palermo, 1826 - Roma, 1910
2) La condensazione aldolica
In ambiente basico lo ione enolato formatosi attacca l'atomo di carbonio carbonilico di una molecola di aldeide (o chetone), presente in grande eccesso. Si forma un aldolo. Se sono presenti 2 atomi di idrogeno in a si ha successiva eliminazione di acqua (condensazone) con formazione di un enone.
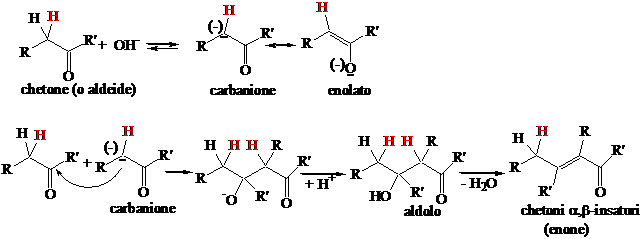
La reazione tra due diversi composti carbonilici porta alla formazione di 4 prodotti di condensazione (A-B, B-A, A-A, B-B)
Condensazione di Claisen-Schmidt: Se uno dei due composti carbonilici non fa idrogeni in a si ottengono solo 2 prodotti di condensazione (A-A e A-B). Se il composto carbonilico che non ha idrogeni in a è un'aldeide si ottiene solo il prodotto di condensazione misto (A-B), poiché lo ione enolato reagisce preferenzialmente con il carbonile aldeidico, più reattivo.
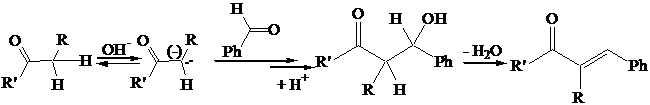
Se si tratta in ambiente basico una aldeide senza idrogeni in a si ha una reazione di dismutazione con formazione di acido e alcol attraverso lo scambio di ione idruro. La reazione fu scoperta da Cannizzaro e porta il suo nome.
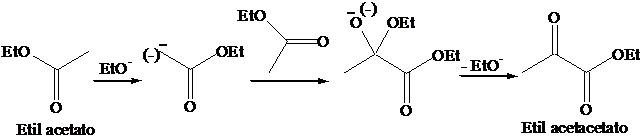
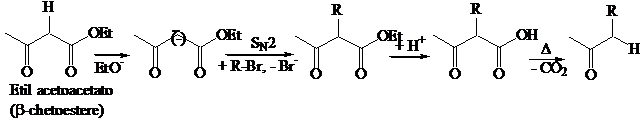
La decarbonilazione dei b-chetoacidi o degli acidi b-dicarbossilici è una reazione termica che avviene attraverso un meccanismo concertato.
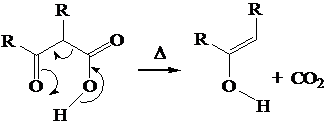
Gli enolati dei b-diesteri: la sintesi malonica degli acidi carbossilici
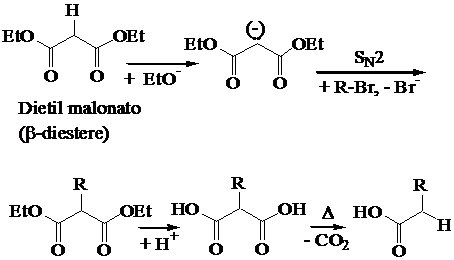
Nomi comuni e caratteristiche fisiche di alcuni acidi monocarbossilici
Formula |
Nome |
Acido |
Metil estere |
||
|
b.p. (°C) |
p.f. (°C) |
b.p. (°C) |
p.f. (°C) |
||
HCOOH |
Ac. formico |
100 |
8 |
34 |
-100 |
|
CH3COOH |
Ac. acetico |
117 |
16 |
57 |
-98 |
|
C2H5COOH |
Ac. propionico |
141 |
-23 |
79 |
-88 |
|
C2HCOOH |
Ac. acrilico |
|
|
|
|
|
C3H7COOH |
Ac. butirrico |
162 |
-5 |
102 |
C3H7COOH |
|
C4H9COOH |
Ac. valerianico (valerico) |
185 |
-18 |
128 |
|
|
C5H11COOH |
Ac. caprinico (caproico) |
202 |
-4 |
151 |
-71 |
|
C7H15COOH |
Ac. caprilico |
237 |
16 |
|
194 |
|
C9H19COOH |
Ac. caprico |
270 |
30 |
|
|
|
C10H21COOH |
Ac. undecanoico |
|
|
|
|
|
C11H223COOH |
Ac. laurico |
|
|
|
|
|
C12H25COOH |
Ac. tridecanoico |
|
42 |
|
|
|
C13H27COOH |
Ac. miristico |
|
53 |
|
|
|
C15H31COOH |
Ac. palmitico |
|
61 |
|
|
|
C15H29COOH |
Ac. palmitoleico (ins) |
|
|
|
|
|
C17H35COOH |
Ac. stearico |
|
|
|
|
|
C17H33COOH |
Ac. oleico (cis-9,10-ins.) |
|
|
|
|
|
C17H33COOH |
Ac. elaidico (trans-9,10-ins.) |
|
|
|
|
|
C17H31COOH |
Ac. linoleico (9,12-diins.) |
|
-5 |
|
-35 |
Nomi e caratteristiche fisiche di alcuni acidi di carbossilici
|
Formula |
Nome |
p.f. (°C) |
|
HOOC-COOH |
Ac. Ossalico |
|
|
HOOC-CH2-COOH |
Ac. Malonico |
|
|
HOOC-C2H4-COOH |
Ac. Succinico |
184 |
|
HOOC-C2H2-COOH |
Ac. Maleico (cis) |
|
|
HOOC-C2H2-COOH |
Ac. Fumarico (trans) |
300 (sublima) |
|
HOOC-C3H6-COOH |
Ac. Glutarico |
96 |
|
HOOC-C4H8-COOH |
Ac. Adipico |
|
|
HOOC-C6H12-COOH |
Ac. Sebacico |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ribosio |
Costituente acidi nucleici |
|
|
|
Aldosi |
|
|
|
|
Zuccheri semplici |
|
Glucosio |
Costituente polisaccaridi |
|
|
(Monosaccaridi) |
|
|
|
|
|
|
Chetosi |
Fruttosio |
Zucchero della frutta |
|
Carboidrati |
|
|
|
|
|
(Zuccheri) |
|
|
Lattosio |
Zucchero del latte |
|
|
|
Disaccaridi |
Maltosio |
Da fermentazione di amido |
|
|
|
|
Cellibosio |
Da ferment. di cellulosa |
|
|
Zuccheri complessi |
|
Saccarosio |
Da canna e bietola |
|
|
|
|
Amido |
(Amilosio, amilopectina) |
|
|
|
Polisaccaridi |
Glicogeno |
Cellule, sangue |
|
|
|
|
Cellulosa |
Funzione strutturale |
|
|
|
|
|
|
|
|
|
|
Fibrose |
Strutturale, trsporto, enzimi |
|
|
|
Semplici |
|
|
|
|
|
|
Globulari |
|
|
Amminoacidi |
Proteine |
|
|
|
|
Peptidi |
|
|
Glicoproteine |
Membrane cellulari |
|
|
|
Coniugate |
Lipoproteine |
Trasporto colesterolo |
|
|
|
|
Nucleoproteine |
Nei ribosomi |
|
|
|
|
Fosfoproteine |
Caseina |
|
|
|
|
|
|
|
|
|
Trigliceridi |
Esteri glicerina |
Grassi, oli |
|
|
Esterei |
Cere |
Ester alcoli catena lunga |
|
|
|
|
|
|
|
|
|
|
Fosfogliceridi |
|
Membrane cellulari |
|
Lipidi |
Fosfolipidi (esteri acido fosforico) |
Sfingolipidi |
|
Membrane, tessuti cerebrali e nervosi |
|
|
|
|
|
|
|
|
Steroidi |
Struttura |
tetraciclica |
Ormoni |
|
|
|
|
|
|
|
|
Terpeni |
Struttura |
isoprenica |
Oli essenziali, pigmenti |
|
|
|
|
|
|
|
|
|
|
|
|
|
Acidi nucleici |
Nucleosidi, nucleotidi |
DNA, RNA |
|
Materiale genetico |

Hermann Emil Fischer (1852, Euskirchen - 1919, Berlino) La
fama di Emil Fischer è legata al m monumentale lavoro sugli zuccheri,
intrapreso tra il1884 e il 1896. Attraverso una spettacolare serie di
trasformazioni riuscì a dimostrare la configurazione del glucosio. Partendo
dalla glicerina riuscì a sintetizzare glucosio, fruttosio e mannosio. In
seguito si dedicò allo studio delle proteine, dando un enorme contributo
alla conoscenza di queste molecole. La sua vita privata non fu felice. Nel
1888 sposò Agnes Gerlach, che morì dopo sette anni di matrimonio. Dei suoi
3 figli, uno morì nella Prima Guerra Mondiale, un altro si suicidò durante
il servizio militare. Fin da giovane soffrì di gastrite, che si trasformò
poi nel cancro che lo uccise nel 1919.

|
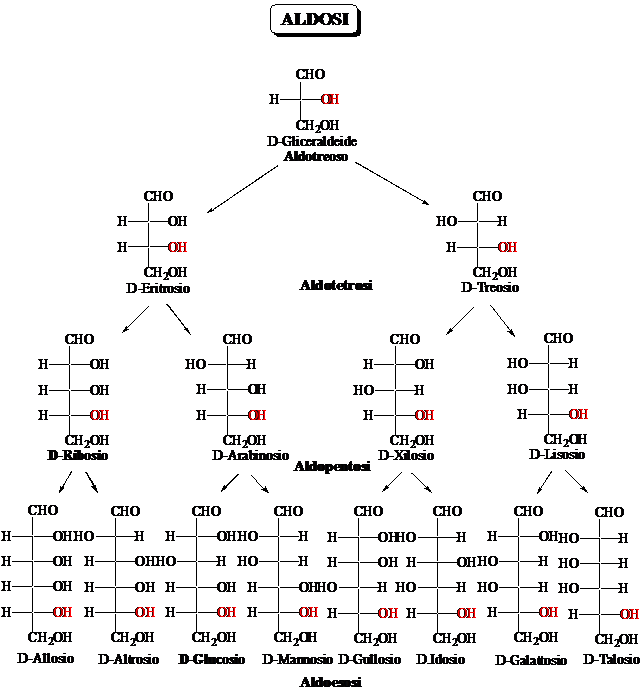
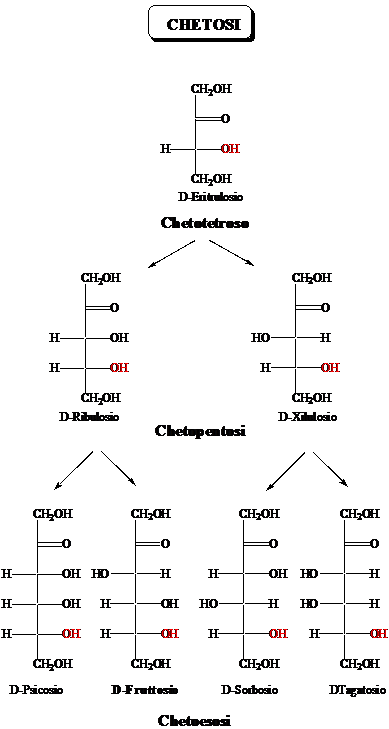
Come rappresentare gli zuccheri a catena aperta: le proiezioni di Fischer
La rappresentazione degli zuccheri secondo Fischer mostra la proiezione sul piano della molecola in conformazione eclissata. La catena degli atomi di carbonio è verticale. I legami CC, verticali, entrano dentro il foglio, mentre i legami C-H e C-OH, orizzontali, escono dal foglio. Nelle proiezioni di Fischer gli OH dei carboni di configurazione R stanno a destra (ovviamente, gli OH dei carboni di configurazione S stanno a sinistra

Scambiando due sostituenti tra loro si inverte la configurazione sul carbonio. Un numero pari di scambi corrisponde al ripristino della configurazione.
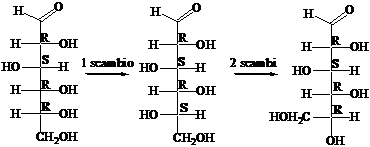
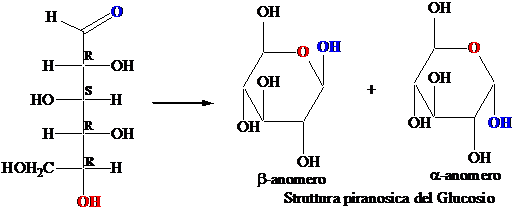
La ciclizzazione degli zuccheri avviene attraverso la formazione di un legame emiacetalico tra un OH e il gruppo carbonilico, portando a una struttura a 5 termini (furanosica) o a 6 termini (piranosica). La ciclizzazione avviene quando il gruppo OH è perpendicolare al piano del carbonile. Nella proiezione di Fischer questa conformazione corrisponde al legame OH rivolto in basso.
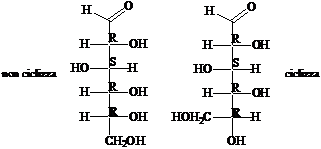
La ciclizzazione crea un nuovo stereocentro (il C carbonilico); si formano due diasteroisomeri chiamati anomeri. Nelle strutture di Haworth l'isomero con il gruppo OH rivolto in basso è chiamato anomero a, l'isomero con il gruppo OH rivolto in alto è chiamato anomero b I gruppi (OH o CH2OH) che nella proiezione di Fischer stanno a destra sono rivolti in basso nella struttura di Haworth.
La Gliceraldeide.
La Gliceraldeide è lo zucchero più semplice. Dei due possibili stereoisomeri d e l esiste in natura solo l'enantiomero d, che corrisponde alla configurazione R dell'atomo di carboniuo asimmetrico. Per ragioni storiche l'enantiomero di configurazione R viene chiamato D-gliceraldeide
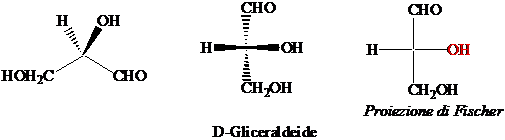
Gli zuccheri si rappresentano solitamente attraverso le proiezioni di Fischer, corrispondenti alla proiezione della molecola disposta in modo che i legami verticali vadano dentro al piano, quelli orizzontali escano dal piano. Solitamente, il gruppo CH2OH viene scritto in basso (quindi entra nel piano). Ne consegue che l'atomo di idrogeno e il gruppo OH escono dal piano. In questa rappresentazione gli atomi di carbonio di configurazione R hanno il gruppo OH a destra.
Tutti gli zuccheri appartengono alla serie D.
Gli zuccheri vengono sintetizzati partendo dalla D-glceraldeide per allungamento della catena tra il carbonile e il carbonio asimmetrico, conservando quindi la configurazione R su questo atomo. Ne deriva che tutti gli zuccheri naturali appartengono alla serie D. Ovviamente, questo non significa che tutti gli zuccheri siano destrogiri. Non esiste infatti nessuna relazione diretta tra configurazione e senso di rotazione del piano della luce polarizzata.

 |
| Appunti su: stereocentri del glucosio, ciclizzazione carbanioni, proiezione di haworth, https:wwwappuntimaniacomscientifichechimicacarbanioni-in-a-al-carbonile-g95php, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |