 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1997 | Gradito: |
Leggi anche appunti:Soluzioni non ideali: deviazioni dalla legge di Raoult e azeotropiSoluzioni non ideali: deviazioni dalla legge di Raoult e azeotropi La maggior Composti e legami ioniciComposti e legami ionici 1 Le soluzioni che contengono ioni conducono la corrente Processi di recupero o rimozione CromoProcessi di recupero o rimozione Cromo 1.1 La concia al cromo La |
 |
 |
(relazione tra V e T con P costante)
Nel 1787 il francese J.A.C. Charles dimostrò che gas diversi mantenuti a pressione costante subiscono la stessa dilatazione quando vengono portati da 0°C a 100°C.
|
|
Nel 1802 Gay-Lussac, riprendendo le esperienze di Charles, giunge a formulare una relazione che lega il Volume alla temperatura
dove
= è il coefficiente di espansione e vale 1/273
Vt = Volume alla temperatura di t°C
Vo = Volume alla temperatura di 0°C
In altre parole, mantenendo costante la pressione, ogni aumento di 1° della temperatura produce un aumento del volume pari ad 1/273 del volume che il gas occupava alla temperatura di 0°C.
Infatti
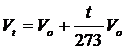
dove si osserva che il volume alla temperatura di t°C (Vt) è pari al volume alla temperatura di 0°C (Vo) aumentato di un valore pari a t/273 del volume Vo. Il volume a 0°C (Vo) varia di 1/273 per ogni variazione di 1°C. La relazione precedente può essere scritta
![]()
e ricordando che 273 + t = T
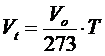
Poiché infine il volume a pressione costante (P = K) e alla temperatura di 0°C assume sempre lo stesso valore, il rapporto Vo/273 è una costante.
Se quindi esprimiamo la temperatura in gradi assoluti, la legge di Gay-Lussac afferma che il volume a t°C è direttamente proporzionale alla temperatura assoluta. Il valore della costante di proporzionalità dipende ovviamente dalla pressione alla quale facciamo l'esperimento e dalla quantità di gas che si prende in considerazione.
La relazione che lega il Volume alla Temperatura a Pressione costante è dunque di proporzionalità diretta ed è quindi rappresentabile tramite una retta di pendenza Vo/273.
Se in ascissa poniamo la temperatura centigrada la retta incontra l'asse delle ordinate in Vo. e quello delle ascisse in -273. Se in ascissa poniamo la temperatura assoluta la retta attraversa l'origine. La retta ottenuta è detta isobara.
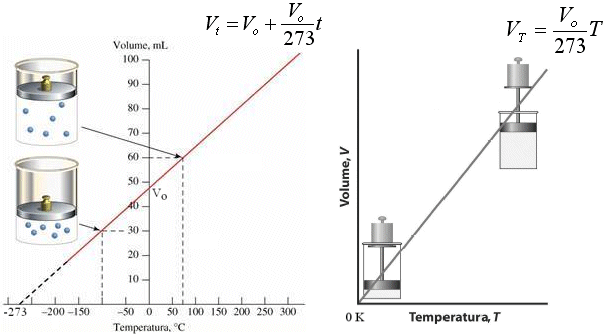
Naturalmente i valori espressi dalla retta hanno significato solo fino ad una certa temperatura, al di sotto della quale il gas si liquefa e diventa in pratica incomprimibile. Facendo comunque proseguire idealmente la retta (linea tratteggiata) si raggiunge lo zero assoluto (-273°C) al di sotto del quale si otterrebbe il risultato assurdo di un volume negativo della materia.
 |
| Appunti su: J a c Charles fisica, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |