 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2346 | Gradito: |
Leggi anche appunti:Processi di recupero o rimozione CromoProcessi di recupero o rimozione Cromo 1.1 La concia al cromo La Equilibri eterogeneiEquilibri eterogenei Fino ad ora abbiamo trattato soluzioni acquose, che Nomenclatura chimicaNomenclatura chimica Valenza: Termine obsoleto per indicare il numero di |
 |
 |
Nel 1889 il chimico svedese Svante Arrhenius propose la seguente relazione empirica per calcolare il valore della costante cinetica k di una reazione che decorra in un unico stadio (reazione elementare)
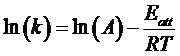
ed in forma esponenziale
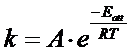
dove
A è una costante che dipende dalla natura dei reagenti
e = 2,718 è la base dei logaritmi naturali o neperiani
Eatt è l'energia di attivazione della reazione
R è la costante universale dei gas
T è la temperatura assoluta
La relazione di Arrhenius afferma che la costante cinetica k si ottiene come prodotto di due fattori:
Il fatto che nel fattore esponenziale la temperatura T e l'energia di attivazione Eatt siano presenti ad esponente ci suggerisce come piccole variazioni nel loro valore possano generare forti variazioni di k e quindi della velocità della reazione.
La velocità di una reazione risulta dunque essere estremamente sensibile alle variazioni sia di T che di Eatt
In particolare, a parità di altre condizioni, una reazione che presenta un'energia di attivazione molto elevata risulta essere estremamente lenta. In alcuni casi essa può essere talmente lenta da risultare impercettibile. Naturalmente un modo per accelerare una reazione è quello di aumentare la temperatura. A parità di altre condizioni un aumento di temperatura accelera infatti una reazione.
Si tenga comunque presente che l'aumento della velocità di reazione al crescere della temperatura è tanto più evidente:
quanto maggiore è l'energia di attivazione (le reazioni caratterizzate da un'elevata energia di attivazione risultano più sensibili alle variazioni di temperatura)
quanto minore è la temperatura (a bassa temperatura le razioni sono più sensibili alle variazioni di temperatura)..
In altre parole, un aumento di Temperatura ha un effetto maggior sulla velocità di reazione ad elevata Energia di Attivazione e a bassa Temperatura
Esempio
Calcoliamo l'aumento di velocità generato da un aumento di temperatura di 10°C a basse temperature (T = 300K) e ad alte temperature (T = 1000 K), per una reazione con Eatt = 50 kJ/mol,
Calcoliamo il rapporto delle costanti cinetiche per un aumento di 10° a bassa temperatura da 300K a 310K
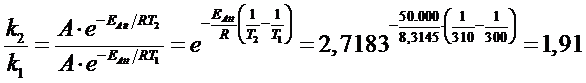
Calcoliamo il rapporto delle costanti cinetiche per un aumento di 10° ad alta temperatura da 1000K a 1010K
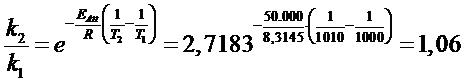
Mentre a basse temperature un aumento di 10°C produce quasi un raddoppio della velocità (1,91), ad alte temperature lo stesso aumento di temperatura produce un aumento di velocità del 6% (1,06)
Esempio
Calcoliamo l'aumento di velocità generato da un aumento di temperatura di 10°C ad alte temperature (T = 1000K), per una reazione con Eatt = 50 kJ/mol e per una reazione con energia di attivazione elevata pari a Eatt = 600 kJ/mol
Calcoliamo il rapporto delle costanti cinetiche per un aumento di 10° da 1000K a 1010K per la reazione con bassa Eatt = 50 kJ/mol
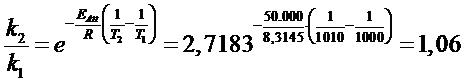
Calcoliamo il rapporto delle costanti cinetiche per un aumento di 10° da 1000K a 1010K per la reazione con alta Eatt = 600 kJ/mol
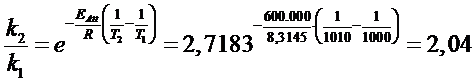
Mentre per la reazione con bassa Eatt un aumento di 10°C produce un aumento del 6% (1,06) della costante cinetica (e quindi della velocità), per la reazione ad alta Eatt lo stesso aumento di temperatura produce un raddoppio (100%) della velocità (2,04).
* * * * * * *
Un altro modo di aumentare la velocità di una reazione è quello di usare un catalizzatore. I catalizzatori sono sostanze che, aggiunte in piccole quantità ad una reazione chimica, la accelerano senza venir consumati durante la reazione stessa, diminuendo l'Eatt.
Esempio
Ad una reazione che a 303 K presenta Eatt = 30 kJ/mol, viene aggiunto un catalizzatore che ne dimezza l'energia di attivazione. Calcoliamo l'aumento di velocità.
Indichiamo con k* la costante cinetica della reazione catalizzata e con
![]() l'energia
di attivazione della reazione catalizzata
l'energia
di attivazione della reazione catalizzata
![]()
Scriviamo la relazione di Arrhenius per i due casi e dividiamo membro a membro
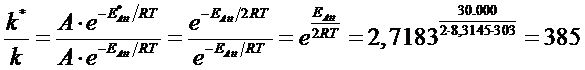
la reazione catalizzata risulta dunque 385 volte più veloce della reazione non catalizzata
 |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |