 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1589 | Gradito: |
Leggi anche appunti:Verifica sperimentale delle leggi di ohmVerifica sperimentale delle leggi di ohm Considerazioni teoriche: I conduttori La teoria del gatto di shrodingerLa Teoria del Gatto di Shrodinger Erwin Shrodinger ebbe difficoltà ad accettare Misure di potenza su linea trifase mediante inserzione BarbagelataMisure di potenza su linea trifase mediante inserzione Barbagelata Schema |
 |
 |

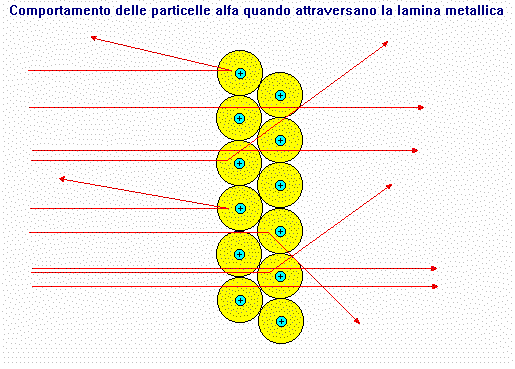
L'elettricità e le quattro forze. Da quando l'esperimento
determina la validità delle leggi della fisica, sappiamo che cariche elettriche
uguali si respingono e cariche elettriche diverse si attraggono.
Con buona pace di Hume e del suo
scetticismo, i fisici hanno dedotto tale legge dalla ripetuta abitudine della
materia a reiterare in modo costante i suoi comportamenti.Si era constatato
che, strofinando l'ambra con un panno, il panno stesso veniva attratto dalla
materia strofinata: ciò era possibile perché gli atomi superficiali dell'ambra
perdevano elettroni (più leggeri dei protoni). L'ambra risultava così a
prevalenza di cariche positive (i protoni erano la maggioranza), mentre il
panno, carico degli elettroni sottratti, risultava a prevalenza di cariche
negative.La legge dell'attrazione elettrica (da electrum=ambra) poneva e
pone tutt'ora un quesito fondamentale: come possono i protoni, che hanno carica
elettrica uguale, rimanere uniti tra loro così saldamente?
I fisici hanno dedotto dallo stato della materia l'esistenza di quattro forze determinanti:
1. La prima forza è la forza nucleare forte , è la forza che permette ai protoni di rimanere uniti tra loro, la sua azione incollante è la più forte delle quattro, in quanto riesce a tenere uniti l'uno contro l'altro protoni con la stessa carica;
2. La seconda forza è la forza nucleare debole , è responsabile del decadimento di alcune particelle nucleari (non tutti gli atomi sono stabili al loro interno, capita, per alcuni di essi, che perdano per strada qualche particella e che sprigionino così dell'energia, oltre a dare origine a nuove particelle), il decadimento di un atomo è detto radioattività;
3. La terza forza è la forza elettromagnetica, tiene uniti gli elettroni al nucleo ed è più debole della prima forza;
4. La quarta forza è la forza di gravità, è la più debole di tutte, in quanto per essere determinante necessita della presenza di grandi masse di materia.
I Quark. Non tutte le particelle che compongono l'atomo sono
particelle elementari, ciò vuol dire che alcune particelle sono a loro volta
composte da altre particelle più piccole.
In particolare il protone e il neutrone sono composti da tre particelle dette
quark.
Potrebbe essere interessante sapere che il nome di tali particelle è preso da
un passo del Finnegans Wake di James Joyce, e sarebbe la contrazione di question
mark, ovvero punto interrogativo.
I quark sono in tutto sei, essi si distinguono per massa e carica elettrica.
1. Quark Up (quark su), detto anche quark-u. Ha massa di 9 per 10 alla meno 30, ovvero 9 preceduto da 30 zeri, carica elettrica pari a due terzi di quella del protone.
2. Quark Down (quark giù), detto anche quark-d. Ha massa di 1.8 per 10 alla meno 29, carica elettrica pari a meno un terzo di quella del protone.
3. Quark Strange (quark strano!), detto anche quark-s. Ha massa di 3.5 per 10 alla meno 28, carica elettrica pari a meno un terzo di quella del protone.
4. Quark Charm (quark incanto!?), detto ache quark-c. Ha massa di 2.3 per 10 alla meno 27, carica elettrica pari a due terzi di quella del protone.
5. Quark Bottom (quark sotto), detto anche quark-b. Ha massa di 7.7 per 10 alla meno 27, carica elettrica pari a meno un terzo di quella del protone.
6. Quark Top (quark sopra), detto anche quark-t. Ha massa di 3.1 per 10 alla meno 25, carica elettrica pari a due terzi di quella del protone.
Il protone è costituito da 3 quark, 2 di
tipo up e 1 di tipo down, il neutrone da 1 di tipo up e 2 di tipo down. Se
qualcuno vorrà prendersi la briga di calcolare la somma delle rispettive
cariche dei quark, si accorgerà che nel caso del protone la carica risultante
equivale al valore intero della carica protonica, mentre per il neutrone, la
somma delle tre cariche darà come rislutato zero, ovvero l'annullamento della
carica.I quark vengono tenuti insieme tra loro dalla forza forte, la
stessa che lega tra loro protoni e neutroni.
I quark inoltre decadono, a causa della forza debole. Essi a volte si
traformano da up a down e viceversa, cambiando in questo modo anche i protoni,
i quali diventano neutroni e viceversa.
Il loro decadimento produce altre particelle, tra le quali i bosoni e gli
antineutrini (ciò è definito decadimento beta, comportamento radioattività
scoperto da Fermi nel 1933).L'esistenza dei quark che non appartengono alla
famiglia primaria degli up e dei down è stata dedotta da altri
processi di decadimento, i quark sembra si possano osservare sempre accoppiati,
ecco perché ad un quark up corrisponde sempre un quark down, ad
un strange un charm, e ad un bottom un top.
La speranza di venirne a capo, ovvero le stringhe. Cos'è la teoria delle stringhe se non un tentivo di venire a capo all'infinita suddivisione della materia in particelle?Questa teoria ancora in corso di sviluppo (per alcuni la vera rivoluzione scientifica del terzo millennio casualmente iniziata nel secondo), cerca di considerare le particelle da un nuovo punto di vista: per la teoria delle stringhe, le particelle non sarebbero oggetti puntiformi ma dei lacci, delle cordicelle vibranti.Quest'ipotesi nasce dall'esigenza di trovare una teoria elegante, ovvero una teoria che possa mettere un po' d'ordine nell'infinita parata di particelle e iterazioni che si sono trovate davanti i fisici nel corso del '900 e che spieghi ogni fenomeno fisico partendo da alcuni semplici assunti.Alcuni ipotizzano che le stringhe non siano nemmeno corde, ma tubicini, cavi al loro interno, attorno ai quali si trovino arrotolate su se stesse dimensioni spazio-temporali ignote e inaccessibili e che le stringhe possano essere sia di tipo aperto che chiuso (ad anello).In ogni caso, dimostrare la loro esistenza e le loro proprietà di base significherebbe semplificare di molto (almeno al livello teorico) la complessità dei modelli atomici e subatomici contemporanei, certamente una sfida affascinante.
In buona sostanza,alla luce delle conoscenze attuali,non commettiamo alcun errore se consideriamo finita tutta la realtà in cui ci troviamo. L'universo è finito, e così il numero dei granelli di sabbia,delle stelle e dei quark presenti in tutto lo spazio cosmico. Quando in fisica e in astronomia si parla di infinitamente piccolo e di infinitamente grande,almeno per adesso, si parla in realtà di piccolissimo e di grandissimo,ma non di infinito.
 |
| Appunti su: |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Chimica |  |