 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3670 | Gradito: |
Leggi anche appunti:DistillazioneDistillazione Ø Materiale occorrente ü Base I legami chimiciI legami chimici Obiettivi: verificare l'esistenza del legame ionico, La chimica e il metodo scientifico d'indagineLA CHIMICA E IL METODO SCIENTIFICO D'INDAGINE Noi, nella catena alimentare, |
 |
 |
La termodinamica è la disciplina che descrive le proprietà dei sistemi chimico-fisici dal punto di vista macroscopico e ne studia il comportamento; in particolare si occupa dei trasferimenti di energia che si producono nel corso delle trasformazioni e delle modalità con cui queste avvengono.
L'approccio termodinamico ha il vantaggio di essere indipendente da qualsiasi ipotesi sulla struttura della materia.
L'intera termodinamica si basa su pochi semplici principi, cioè su leggi ricavate sperimentalmente, che devono pertanto essere accettati come tali, finché l'esperienza non ne neghi la validità.
Tali principi possono essere ricondotti a tre osservazioni sperimentali fondamentali, che portano a definire tre grandezze, dette funzioni di stato: temperatura (T), energia interna (U) e entropia (S).
Ognuno di questi principi ha una propria espressione matematica e può essere formulato in modi diversi, con molteplici implicazioni. Essi possono essere così riassunti:
0) 'Se due corpi, A e B sono entrambi in equilibrio termico con un terzo corpo, C, essi sono in equilibrio termico anche fra loro.' Questo enunciato è noto come zeresimo principio della termodinamica e sta alla base del concetto di temperatura e della sua misurazione mediante il termometro.
1) 'L'energia dell'universo è costante.' È una delle possibili formulazioni del primo principio della termodinamica. Esso non è altro che l'espressione del concetto di conservazione dell'energia (Mayer, 1842). Si introduce con esso la funzione energia interna di un sistema. Consente di stabilire quali trasformazioni siano possibili.
2) 'È impossibile invertire completamente un qualsiasi processo naturale.' È questa una delle possibili formulazioni del secondo principio. Esso pone delle limitazioni alle trasformazioni di calore in lavoro (Carnot 1824) e introduce la funzione entropia. Consente di stabilire quali delle trasformazioni possibili siano spontanee.
Abbiamo già dato una definizione di sistema.
Sistema: Porzione delimitata dell'universo, alla quale ci riferiamo per le nostre osservazioni
Ambiente: Tutto ciò che circonda il sistema (è dall'ambiente che si effettano osservazioni sul sistema)
Sistema + Ambiente = Universo
Dal punto di vista termodinamico è utile distinguere tre diversi tipi di sistema in base ai suoi rapporti con l'ambiente.
Un sistema chiuso si dice adiabatico quanto non può scambiare calore con l'ambiente, altrimenti si dice diatermico.
Lo stato di un sistema è definito dalle sue proprietà
Si distinguono:
Può essere spesso conveniente esprimere le proprietà estensive in termini relativi. Ad esempio il volume specifico (rapporto tra volume e massa) oppure la concentrazione (rapporto tra moli e volume). In questo modo le proprietà estensive divengono proprietà intensive e si parla in questi casi di proprietà specifiche.
Le proprietà di un sistema, sia intensive che estensive, prendono il nome di funzioni di stato. Lo stato di un sistema è determinato dai valori delle funzioni di stato, che sono correlate fra loro da equazioni di stato (un esempio è l'equazione generale di stato dei gas ideali).
Le funzioni di stato dipendono esclusivamente dallo stato del sistema e sono indipendenti dal 'cammino' attraverso il quale tale stato è stato raggiunto.
Ciò significa che le loro variazioni sono esattamente definite dalla
differenza fra il valore che hanno nello stato finale e quello che hanno nello
stato iniziale.
I concetti fondamentali che si incontrano nella formulazione del 1° Principio sono Energia, Lavoro e Calore.
Energia: L'energia di un sistema è espressione della sua capacità di compiere Lavoro.
Lavoro: Dal punto di vista meccanico si definisce come lo scalare F·s (forza per spostamento) e può pertanto essere sempre ricondotto al caso in cui un corpo viene spostato contro una forza.
Calore: Un modo alternativo per scambiare
energia, diverso dal Lavoro.
Quando due corpi a differente T sono posti in contatto termico, vi è un
trasferimento di energia, un flusso di calore, da quello a T più elevata a
quello a T più bassa.
La termodinamica focalizza la propria attenzione sull'energia interna di un sistema, la somma delle energie di tutti i suoi componenti. Sarebbe oltremodo complicato quantificare in termini assoluti l'energia interna di un sistema, ma è relativamente facile quantificare la variazione di energia interna (ΔU) che si verifica quando un sistema passa da uno stato all'altro:
ΔU = Uf - Ui
in cui Uf è l'energia interna dello stato finale e Ui quella dello stato iniziale.
In un sistema chiuso vi sono due modi per variare l'energia interna:
I due modi sono perfettamente equivalenti, nel senso che lavoro e calore sono due forme di energia indistinguibili da parte del sistema.
Fissata una convenzione sui segni relativi ai flussi di energia dal sistema all'ambiente e viceversa, nel modo seguente:
+w = lavoro compiuto sul sistema
-w = lavoro compiuto dal sistema
+q = calore fornito al sistema
-q = calore ceduto dal sistema
possiamo scrivere che:
ΔU = Uf - Ui = q + w
Questa espressione può essere considerata una formulazione matematica del primo principio.
In un sistema isolato, che non può scambiare né lavoro, né calore con l'ambiente, la ΔU è inevitabilmente ZERO. Pertanto, un'implicazione del primo principio, ed anche una sua enunciazione generale, è la seguente: 'L'energia interna di un sistema isolato è costante'.
Si tenga presente che l'Universo è il più grande dei sistemi isolati.
Il primo principio può essere formulato anche come segue:
'Esiste una proprietà del sistema che si definisce Energia interna (U)
ed è tale che, se il sistema è chiuso, la si può variare scambiando lavoro e/o
calore con l'ambiente.'
I sistemi chiusi possono essere di due tipi: diatermici e adiabatici. I primi possono scambiare con l'ambiente lavoro e calore, i secondi sono termicamente isolati e possono scambiare lavoro con l'ambiente, ma non calore. Quando un sistema passa da uno stato ad un altro attraverso un processo adiabatico, la quantità di lavoro ceduto o assorbito è sempre la stessa, indipendentemente dalle modalità usate per compiere la trasformazione. Viceversa, in un processo non-adiabatico nel passaggio fra gli stessi stati iniziale e finale, la quantità di lavoro può non essere la stessa. In tal caso, la differenza fra lavoro (non-adiabatico) e la variazione di energia interna, si ritrova come calore.
|
Consideriamo ad esempio un gas ideale che passi dallo stato i(Po,Vo,T) allo stato f(P1,V1,T), espandendosi percorrendo (1) l'isoterma AB, oppure (2) l'isocora (V = costante) AC e successivamente l'isobara (P = costante) CB. |
|
Mentre la variazione dell'energia interna è sempre Uf-Ui, dipendendo solo dagli stati iniziale e finale, il lavoro compiuto è diverso nei due casi, essendo uguale all'area ABV1V0 nel primo caso (1) e uguale all'area CBV1V0 nel secondo caso (2).
In conclusione, il sistema, nelle varie trasformazioni, oltre al lavoro meccanico può scambiare con l'ambiente anche calore.
Così come un sistema può variare la propria energia interna per effetto del solo 'trasferimento' di lavoro, la stessa variazione si può ottenere senza compiere lavoro, mediante un trasferimento di calore. Il calore è in sostanza un meccanismo di trasferimento dell'energia, diverso dal lavoro.
Ma come può essere calcolata la quantità di calore trasferita?
È noto che trasferendo calore ad un corpo, ad esempio ponendolo in contatto con un corpo più caldo, la sua temperatura aumenta. Calore e temperatura sono tuttavia grandezze che hanno poco in comune se si esclude una qualche forma di proporzionalità diretta. Le loro unità di misura, joule e kelvin (o °C) rispettivamente, sono decisamente diverse. Una possibilità per esprimere la quantità di calore è quella di ricorrere alla definizione, ormai obsoleta, di caloria come quantità di energia necessaria per innalzare di 1 grado (da 15 a 16°C) la temperatura di 1 grammo di acqua.
Considerando l'equivalenza fra lavoro e calore, è tuttavia preferibile definire la quantità di calore come la quantità di lavoro necessaria per produrre la stessa variazione di energia interna.
Fu Joule a dimostrare, con i suoi noti esperimenti, che il lavoro meccanico (ad esempio il moto di una ruota a pale) poteva essere utilizzato direttamente per provocare un aumento di temperatura dell'acqua in un recipiente adiabatico, fissando così l'equivalenza tra energia meccanica ed energia termica e stabilendo il valore dell'equivalente meccanico della caloria. Si può dare infatti una definizione meccanica della quantità di calore in termini di lavoro necessario per produrre la stessa variazione dell'energia interna, apprezzabile ad esempio come aumento di temperatura prodotto in un sistema adiabatico.
1 caloria = 4.184 joule
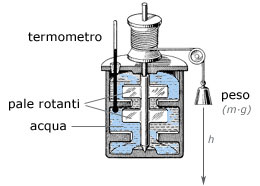
|
Joule dimostrò che il lavoro meccanico necessario per innalzare di 1°C
la temperatura di 1 grammo di acqua (1 caloria, appunto) equivale a circa
4.18 J. L'energia fornita al sistema era nota, essendo pari al lavoro
provocato dalla caduta del peso secondo gravità: m g h (con m, massa; g,
accelerazione di gravità; h, altezza). |
In un sistema chimico, se si escludono le celle galvaniche, l'unico modo di produrre lavoro è quello dovuto a variazioni di volume, che è detto lavoro di espansione.
A pressione costante, tale lavoro è PΔV, in cui P è la pressione esterna. Pertanto, possiamo scrivere:
ΔU = q - PΔV
con l'avvertenza che dovremo indicare con:
+PΔV il lavoro compiuto dal sistema,
-PΔV il lavoro compiuto sul sistema.
Se una trasformazione, e ci riferiamo in particolare ad una reazione chimica, avviene a volume costante (ΔV = 0), la relazione precedente diventa:
ΔU = q
Questo significa che se il sistema non può variare il proprio volume e non può compiere altre forme di lavoro, la variazione di energia interna è pari al calore scambiato con l'ambiente.
Se anche P = costante, l'energia interna si definisce entalpia, H, del sistema:
ΔH = q
'La variazione di entalpia si identifica con il calore che il sistema scambia a pressione costante'
Quando una reazione avviene con liberazione di calore, si dice esotermica e la variazione di entalpia è negativa; quando una reazione avviene con assorbimento di calore, si dice endotermica e la variazione di entalpia è positiva.
Nel caso di una reazione chimica, l'entalpia si definisce entalpia di reazione.
L'entalpia è una funzione di stato caratteristica della termodinamica chimica. Le espressioni matematiche che abbiamo appena esposto nel precedente paragrafo e il loro conseguente significato concettuale discendono dalla definizione che per motivi di convenienza si dà di questa 'nuova' funzione di stato. L'entalpia è infatti definita come:
H = U + PV
L'entalpia è dunque una funzione di
stato 'di comodo'. Se infatti in un sistema chiuso poniamo
determinate restrizioni, otteniamo una notevole semplificazione che
agevola la descrizione del comportamento termodinamico dei sistemi chimici. L'aver
introdotto la funzione di stato Entalpia, porta alla conclusione che 'in
un sistema chiuso, la variazione di Entalpia è pari alla quantità di calore
scambiato, poste due restrizioni: l'unica forma di lavoro possibile è il lavoro
di espansione e la Pressione è costante.'
Se la trasformazione di un sistema termodinamico avviene tra due stati di equilibrio infinitamente vicini, il primo principio si può scrivere:
dU = δq + δw
dU è una variazione infinitesima dell'energia interna;
δq e δw sono quantità infinitesime di calore e di lavoro.
Per queste
due grandezze si usa il simbolo δ anziché d per indicare la
differenza di comportamento.
Mentre il differenziale dell'energia interna dipende unicamente dagli stati
iniziale e finale, δq e δw dipendono, come già abbiamo
visto per w, anche dal 'percorso' della trasformazione. I
differenziali che non dipendono dal tipo di trasformazione si dicono
differenziali esatti; δq e δw non sono
quindi differenziali esatti.
La matematica ci insegna che è possibile rendere esatto un differenziale, moltiplicandolo per una opportuna funzione, detta fattore integrante. È sempre vantaggioso operare con differenziali esatti in quanto, se vogliamo passare da infinitesimi a quantità finite, per un differenziale esatto risulta sempre che:
![]()
per tutti i cammini di integrazione possibili, mentre per un differenziale non esatto:
![]()
a seconda del cammino di integrazione
Quando durante una trasformazione il sistema passa attraverso stati intermedi che differiscono da stati di equilibrio per quantità infinitesime, la trasformazione si dice reversibile. In pratica, per operare una trasformazione reversibile, si devono alterare le condizioni in modo sufficientemente lento da consentire al sistema di adattarsi alle nuove condizioni.
Se trasformiamo un sistema reversibilmente da uno stato iniziale A ad uno stato finale B, possiamo poi riportare il sistema dallo stato B a quello A attraverso la trasformazione inversa.
L'esperienza ci insegna che i processi naturali evolvono spontaneamente (nel tempo) in una determinata direzione. Quando accendete il gas del fornello, il metano brucia spontaneamente producendo CO2, acqua e calore; l'aroma del caffè che sale nella caffettiera ben presto profuma spontaneamente tutta la cucina e la vostra tazzina di caffè si raffredda spontaneamente, fino a raggiungere la temperatura ambiente, se tardate a sorseggiarlo. Le trasformazioni di questo tipo non possono mai essere invertite completamente e per questo motivo i processi naturali sono definiti irreversibili.
Dietro al concetto di irreversibilità vi è di fatto 'l'impossibilità di riportare un sistema, che ha subìto una trasformazione spontanea, dallo stato finale a quello iniziale, senza provocare mutamenti in qualche parte dell'universo.'
Questo punto è di fondamentale importanza e fa la differenza fra trasformazione reversibile e irreversibile. Un processo spontaneo può essere invertito intervenendo dall'esterno, ad esempio spendendo lavoro; tuttavia, in qualche modo si produce inevitabilmente una variazione in qualche altro sistema. Una trasformazione reversibile è quel processo ideale in cui le variazioni prodotte nel corso della trasformazione siano infinitesime e pertanto trascurabili. I processi reversibili sono quindi solo un'astrazione dei processi reali. I processi naturali, che avvengono invece a velocità finita (per quanto possano essere talvolta estremamente lenti, sono comunque lontani dall'equilibrio), sono irreversibili, nell'accezione che si deve attribuire al termine dal punto di vista termodinamico.
In alcune parti del nostro testo, come ad esempio nella trattazione del legame chimico, abbiamo asserito che uno dei 'motori' che spingono i sistemi ad evolvere verso uno stato stabile è la ricerca di uno stato di minima energia. Attribuire a questa tendenza la spontaneità di un processo non è del tutto corretto sotto l'aspetto termodinamico, a meno di non considerare, come faremo nel prossimo paragrafo, una particolare forma di energia.
Se è vero che due atomi che si legano a formare un composto, riducono la propria energia potenziale, è altrettanto vero che tale riduzione di energia si ritrova sotto forma di calore liberato nell'ambiente. Ed è naturale che sia così: nel rispetto del primo principio, l'energia totale resta costante.
Deve esserci quindi qualche altra causa che renda conto della direzione in cui avvengono i processi spontanei.
Il principio generale è in effetti la tendenza verso uno stato di massimo disordine.
Esiste una funzione di stato che può essere considerata una misura del disordine di un sistema: l'entropia (S). Tanto più l'entropia è grande, tanto più il sistema è disordinato. L'entropia sarà ad esempio molto più grande in un gas che in un cristallo.
Una delle possibili formulazioni del Secondo Principio è la seguente:
'In una trasformazione spontanea l'Entropia totale del sistema e dell'ambiente aumenta.'
o anche, il che è la stessa cosa:
'In ogni processo naturale l'Entropia dell'Universo aumenta.'
Entropia: il concetto statistico. Dal punto di vista della meccanica statistica, all'entropia si può attribuire un significato di probabilità, anche se non esattamente nel senso classico del termine, che il sistema si trovi in determinati stati tra tutti quelli disponibili. Vista in quest'ottica, ci possiamo aspettare che l'entropia di un sistema aumenti ogni volta che i suoi componenti hanno a disposizione un maggior numero di siti accessibili o, in generale, un maggior numero di gradi di libertà. Ad esempio, una maggior libertà di movimento (maggior energia cinetica) o più spazio (un maggior volume) a disposizione.
L'entropia in senso statistico venne matematicamente definita da Boltzmann tramite la relazione:
S = k ln ω
in cui,
k = costante di Boltzmann
ω = 'parametro di disordine', è indice della probabilità che il sistema si trovi in un dato stato fra tutti quelli accessibili.
Questa formulazione non è tuttavia ancora sufficiente a svincolarci dal concetto statistico classico del termine probabilità.
Di fatto,
ω è sempre > 1. Per cui, è necessario definire meglio il significato
del parametro ω.
Per farlo, abbiamo bisogno di un paio di termini accessori - microstato
e macrostato - e magari di un esempio pratico.
Iniziamo col
definire ω come 'il numero di microstati di un determinato
macrostato'.
Per microstato possiamo intendere una qualsiasi configurazione
equiprobabile degli elementi di un sistema.
Per macrostato intendiamo invece una categoria di configurazioni (un insieme di microstati) che rispondano a determinati requisiti.
Per semplicità, supponiamo di avere un sistema costituito da un recipiente contenente tre particelle, riconoscibili per il diverso colore: rosso, verde e blu.
Se suddividiamo idealmente il recipiente in due parti dello stesso volume, le tre particelle potranno distribuirsi in 23 = 8 configurazioni diverse: otto microstati, tutti equiprobabili.
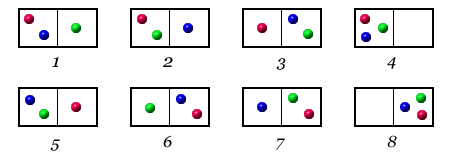
Questi microstati possono essere suddivisi in due categorie:
Poiché il Macrostato
2 si può realizzare attraverso sei microstati diversi, tutti
equiprobabili (contro i due del Macrostato 1), esso rappresenterà la
configurazione più probabile del sistema.
In base alla definizione di S, diremo che il Macrostato 2 ha
un'entropia più elevata del Macrostato 1.
L'esempio
delle tre particelle non rende piena giustizia al 'potere'
dell'entropia.
Già supponendo di avere 10 particelle, i microstati possibili salirebbero a 210
= 1024; resterebbero 2 i microstati del Macrostato 'tutte le particella da
un lato', mentre 20 dei 1024 rappresenterebbero il Macrostato
'distribuzione 9:1 e 1:9'. Il Macrostato '5 particelle su
ciascun lato' si realizzerebbe invece attraverso 252 microstati; quindi
una distribuzione esattamente uniforme avrebbe una probabilità 25 volte
maggiore di una distribuzione 9:1 e la probabilità di trovare tutte le
particelle da un lato sarebbe addirittura 126 volte minore.
Immaginate ora quale possa essere la situazione delle molecole dell'aria
contenuta in una comune stanza: circa 1027 molecole!
Quesiti:
. Perché le
molecole di un gas tendono ad occupare spontaneamente tutto lo spazio a loro
disposizione?
. Giocando ai dadi, qual è il macrostato più probabile? Perché?
Entropia: il concetto termodinamico. Dal punto di vista matematico, la variazione di entropia (S) in una trasformazione reversibile è legata alla variazione di calore dalla relazione:
![]()
La funzione 1/T (T = temperatura assoluta) è il fattore integrante che rende il differenziale δq/T un differenziale esatto, per cui S è una funzione di stato.
Ne segue che in una trasformazione ciclica reversibile, dato che gli stati iniziale e finale coincidono, la variazione di entropia è nulla.
In una qualsiasi trasformazione reversibile sarà invece:
![]()
Anche in una trasformazione irreversibile, la variazione di Entropia è la stessa (dipendendo solo dagli stati finale e iniziale), ma in questo caso, il calore scambiato con l'ambiente è minore che in una trasformazione reversibile: Nel caso di una trasformazione irreversibile, si dimostra infatti che la variazione di entropia è maggiore, ossia:
![]()
Possiamo concludere osservando che in una trasformazione a T costante, la variazione di entropia è sempre la stessa, ma il calore scambiato con l'ambiente è minore nel processo irreversibile che in quello reversibile.
È quindi
evidente che i due tipi di trasformazione hanno effetti diversi sullo stato
dell'ambiente.
Ogni volta che si fanno considerazioni termodinamiche che coinvolgono l'entropia è necessario tener conto non solo del sistema, ma anche di quello che accade nell'ambiente.
Una possibile formulazione del secondo principio della termodinamica è infatti la seguente:
'Nei processi reversibili la variazione complessiva di entropia del sistema e dell'ambiente è nulla; nei processi irreversibili è positiva.' Ovvero, 'In un processo spontaneo si ha sempre un aumento dell'entropia totale'.
Poiché i processi reversibili sono trasformazioni puramente ideali, l'entropia di un sistema isolato, tra cui l'universo, è destinata inevitabilmente ad aumentare.
A questo proposito è di fondamentale importanza tener presente che nel corso di un processo irreversibile, la qualità dell'energia si degrada e perde parte della propria capacità di produrre lavoro. In definitiva, l'entropia può essere vista come un indice dell'esaurirsi della idoneità di un sistema a produrre trasformazioni.
Valutare la spontaneità di una reazione attraverso l'esame della variazione di entropia che subiscono sistema ed ambiente nel corso di una trasformazione, può risultare poco pratico. L'ideale sarebbe poter focalizzare l'attenzione su una qualche proprietà esclusiva del sistema, in grado di informarci sulla direzione di un processo spontaneo. Questa opportunità esiste ed è possibile definendo una nuova funzione di stato, detta energia libera di Gibbs (G), in modo che:
G = H - TS
da cui si giunge alla relazione fondamentale, per una trasformazione finita, a T costante:
ΔG = ΔH - TΔS
A questa formulazione si può pervenire anche partendo dall'enunciato del 2° principio, attraverso un percorso che ha il pregio di mettere bene in evidenza il significato concettuale di ciascuna grandezza contenuta nella relazione ΔG = ΔH - TΔS.
Per una trasformazione che avviene a P e T costanti, la variazione di entropia ΔS dell'ambiente è uguale al calore liberato dal sistema, che, in queste condizioni termobariche, equivale alla variazione di entalpia:
![]()
(Il segno meno sta a indicare che il calore abbandona il sistema)
Essendo il criterio di spontaneità:
ΔStot = ΔSsis + ΔSamb > 0
sostituendo, si ottiene:
![]()
(i pedici sono ormai superflui poiché ci stiamo riferendo unicamente al sistema)
Ponendo -TΔStot = ΔG, si ottiene:
![]()
l'espressione fondamentale di delta G, la quale indica che il criterio di spontaneità impone che ΔG < 0
'A pressione e temperatura costanti, una trasformazione spontanea procede nella direzione che produce una riduzione dell'energia libera.'
L'aver fissato un unico parametro riferito al sistema in grado di indicarci la direzione di un processo spontaneo, ci consente di fare alcune considerazioni circa il procedere delle reazioni chimiche (a P e T costanti).
Innanzitutto possiamo osservare che:
Circa le condizioni che assicurano la spontaneità della reazione, possiamo concludere che:
Una reazione esotermica (ΔH negativa);
è spontanea se ΔS è positiva
può essere spontanea se ΔS è negativa, purché il valore assoluto di TΔS sia minore del valore assoluto di ΔH.
Una reazione endotermica (ΔH positiva)
non è spontanea se ΔS è negativa
può essere spontanea se TΔS > ΔH.
Oltre a fornire il criterio per la previsione dell'andamento naturale di una qualsiasi trasformazione, ΔG ha il significato di esprimere la massima quantità di lavoro utile che una trasformazione spontanea può produrre, a P e T costanti.
Infine, la relazione ΔG = ΔH - TΔS indica anche il tributo da pagare all'entropia nella trasformazione del calore in lavoro. Si tenga presente che si può ottenere lavoro solo da una trasformazione spontanea e quindi, in definitiva, da un processo termodinamicamente irreversibile.
Per poter confrontare le variazioni di energia coinvolte in reazioni diverse, è necessario standardizzare le condizioni della reazione, ossia fissare convenzionalmente le condizioni di riferimento. Esse sono 25°C (298.15 K) di temperatura, 1 bar di pressione e tutti i componenti nel loro stato standard.
Per una qualsiasi sostanza, lo stato standard è rappresentato dalla sostanza pura (a 25°C e 1 bar). Ad esempio un gas puro, un liquido puro, un solido puro.
Per una soluzione, lo stato standard è rappresentato da una attività unitaria del soluto. Tuttavia, come abbiamo già osservato, per soluzioni acquose diluite di sostanze che non siano elettroliti forti, l'attività si può considerare, con buona approssimazione, equivalente alla concentrazione molare. Per cui possiamo prendere come riferimento una concentrazione 1 molare.
In queste condizioni, le funzioni di stato sono definite standard e si indicano con il simbolo °, pertanto:
Qualora le sostanze siano presenti in quantità diverse dai valori standard di riferimento, saranno necessari i seguenti aggiustamenti:
Per un gas ideale alla pressione di P bar:
G = G° + RT ln (P/P°)
Per un solido o un liquido puri:
G = G°
Per una soluzione ideale:
G = G° + RT ln[soluto]
Agli elementi nei loro stati stabili, a 25°C e 1 bar, si attribuisce convenzionalmente ΔG° = 0
Nel caso dei sistemi biologici, si usa riferirsi a pH 7. Tale condizione si indica ponendo un 'primo' ad apice della funzione di stato: ad esempio ΔG°'
Esiste anche un terzo principio della termodinamica, che può essere formulato come segue:
'Tutte le sostanze pure, nella loro forma cristallina perfetta, hanno entropia nulla allo zero assoluto.'
In questa enunciazione, il terzo principio ha un significato essenzialmente convenzionale. Dal punto di vista chimico, la sua importanza consiste nel fatto che in base ad esso è possibile determinare le entropie assolute delle sostanze in qualsiasi condizione di T e di P. La conoscenza di tali valori è estremamente utile in molti calcoli termodinamici.
 |
| Appunti su: termodinamica chimica medica riassunto, https:wwwappuntimaniacomscientifichechimicatermodinamica-chimica33php, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |