 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6937 | Gradito: |
Leggi anche appunti:Il 1918 la scoperta della sintesi dell'ammoniacaIl 1918 la scoperta della sintesi dell'ammoniaca Il 1918 lo studioso tedesco Teoria di Lewis del legame covalenteTeoria di Lewis del legame covalente L'ipotesi del legame covalente come doppietto Forze di London o interazioni dipolo istantaneo-dipolo indotto (effetto di dispersione)Forze di London o interazioni dipolo istantaneo-dipolo indotto (effetto di dispersione) Se |
 |
 |
La convenzione introdotta da Lewis per rappresentare gli elettroni di valenza degli elementi viene utilizzata anche per rappresentare intere molecole. Per scrivere la struttura di Lewis di una molecola è necessario conoscere la sua formula molecolare e la connettività.
La formula molecolare e la connettività sono determinate sperimentalmente e devono essere note. La connettività o costituzione è l'ordine con cui gli atomi di una molecola sono connessi.
Ad esempio il nitrito di metile ha formula molecolare CH3NO2 e la sua connettività è C-O-N-O con tutti gli idrogeni legati al carbonio.
Vediamo di seguito i 6 passaggi necessari per scrivere correttamente una struttura di Lewis molecolare. Useremo il nitrito di metile CH3NO2.
Determinare il numero degli elettroni di valenza della molecola.
Per una molecola neutra, il numero di elettroni di valenza è uguale alla somma degli elettroni di valenza degli atomi coinvolti (elettroni superficiali che compaiono nella struttura di Lewis dell'elemento). Si ricordi che il numero di elettroni superficiali coincide in genere con il numero d'ordine del gruppo chimico al quale l'elemento appartiene. Così l'Ossigeno (VI gruppo A) possiede 6 elettroni di valenza, l'Azoto (V gruppo A) ne possiede 5, il Carbonio 4 (IV gruppo A) e l'Idrogeno 1 elettrone di valenza (I gruppo A).
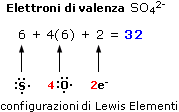
Per una molecola elettricamente carica il numero di elettroni di valenza è uguale al numero di elettroni di valenza degli atomi, al quale va sommato il numero delle cariche negative o sottratto il numero delle cariche positive. Ad esempio l'anione solfato SO42- possiede 32 elettroni di valenza (6 per l'atomo di Zolfo, 6 per ogni atomo di ossigeno e 2 per le due cariche negative dell'anione).
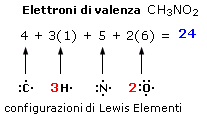
Il nitrito di metile (CH3NO2) presenta 24 elettroni di valenza. Ogni idrogeno contribuisce infatti con 1 elettrone di valenza, il carbonio con 4, l'azoto con 5 ed ogni atomo di ossigeno con 6 per un totale di 24 elettroni.
Costruire un primo schema di legame, rispettando la connettività e collegando gli atomi con un legame covalente semplice.
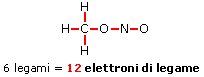
Determinare gli elettroni residui da posizionare. Sottrarre gli elettroni di legame dagli elettroni di valenza, ottenendo in tal modo il numero di elettroni che devono ancora essere posizionati. Nel nitrito di metile CH3NO2, gli elettroni di legame sono 12, mentre quelli di valenza sono 24 e devono pertanto essere ancora posizionati 24 - 12 = 12 elettroni.
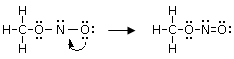
Aggiungere gli elettroni residui come coppie di elettroni di non-legame (elettroni non condivisi o coppie solitarie o lone pairs) in modo che il maggior numero di atomi presenti 8 elettroni (ovviamente non l'idrogeno), iniziando con gli atomi più elettronegativi.
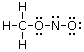
Spostare coppie solitarie per completare l'ottetto. Se un atomo non ha l'ottetto completo, usare una coppia di elettroni solitari dell'atomo adiacente che possiede il maggior numero di doppietti non condivisi, per formare un doppio o un triplo legame. Nella struttura precedente si osserva, ad esempio, che l'azoto ha solo 6 elettroni (4 condivisi con i due atomi di Ossigeno e 2 non condivisi). Trasferiamo dunque un doppietto solitario dall'Ossigeno terminale (che ha 3 doppietti non condivisi, contro i 2 doppietti dell'ossigeno centrale), per formare un doppio legame N=O.
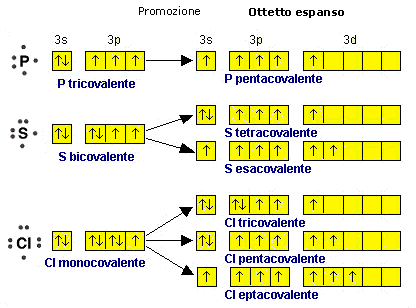
La regola per la quale ogni atomo legato deve avere non più di 8 elettroni superficiali (regola dell'ottetto) vale rigorosamente solo per gli elementi non metallici del secondo periodo chimico (C N O F) i quali, non possedendo orbitali d, non sono in grado di trasferirvi elettroni (promozione elettronica) per aumentare il numero dei loro legami. I primi elementi del secondo periodo possono avere meno di otto elettroni nel loro stato legato (4 per il Berillio e 6 per il Boro = ottetto incompleto). Gli elementi non metallici dei periodi superiori al secondo possono invece avere più di 8 elettroni superficiali (ottetto espanso) nel loro stato legato. In particolare quelli del gruppo V-A, come il Fosforo, possono avere 10 elettroni superficiali, mentre quelli del gruppo VI-A come lo Zolfo possono arrivare a 12 e quelli del gruppo VII-A, come il Cloro ne possono avere 14.
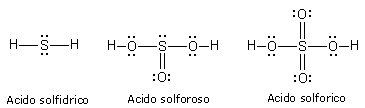
Ad esempio Lo Zolfo completa l'ottetto nell'acido solfidrico, mentre arriva a 10 elettroni nell'acido solforoso e a 12 elettroni nell'acido solforico
Calcolare la carica formale di ciascun atomo. La carica atomica formale viene definita come la carica che un atomo avrebbe se tutti i suoi legami venissero considerati come covalenti puri. La carica formale di ciascun atomo e' data dunque dalla differenza tra gli elettroni di valenza dell'atomo isolato e gli elettroni di valenza dell'atomo legato nella molecola. Per determinare gli elettroni di valenza dell'atomo legato (elettroni che l'atomo possiede nella molecola) è necessario assegnargli un elettrone per ogni coppia di elettroni di legame ed entrambi gli elettroni di ogni sua coppia solitaria. Si confrontano poi gli elettroni di valenza dell'atomo legato con gli elettroni di valenza dell'atomo isolato neutro. Ogni elettrone in eccesso rappresenta una carica formale negativa. Ogni elettrone in difetto una carica formale positiva.
carica formale = elettroni di valenza atomo isolato - elettroni di valenza atomo legato
carica formale = elettroni di valenza - [½ elettroni di legame + elettroni solitari]
Naturalmente la somma delle cariche formali di tutti gli atomi di una molecola o ione deve essere uguale alla carica elettrica complessiva della molecola.
Per calcolare la carica formale sostituiamo i trattini che rappresentano i legami con coppie di puntini (i due elettroni condivisi) e successivamente contiamo gli elettroni intorno ai singoli atomi confrontandoli con i rispettivi elettroni di valenza degli atomi isolati
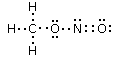
Intorno a ciascun atomo di ossigeno vi sono 6 elettroni. Poiché l'atomo di ossigeno isolato possiede 6 elettroni superficiali, i due atomi di ossigeno presentano carica formale nulla (6-6=0)
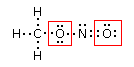
Intorno all'atomo di carbonio vi sono 4 elettroni, mentre intorno all'atomo di azoto vi sono 5 elettroni. Poiché gli atomi di carbonio e di azoto isolati possiedono rispettivamente 4 e 5 elettroni superficiali, la loro carica formale è nulla.
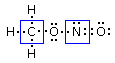
Esaminiamo ora il nitrometano, un composto che presenta la medesima formula molecolare del nitrito di metile CH3NO2, ma diversa connettività o costituzione (nitrometano e nitrito di metile sono due isomeri costituzionali). Nel nitrometano il carbonio si lega direttamente al'azoto il quale si lega ai due atomi di ossigeno. Il primo schema di legame è dunque il seguente
Abbiamo posizionato 6 legami per un totale di 12 elettroni. Gli elettroni di valenza sono sempre 24, come per il nitrito di metile (gli atomi sono gli stessi) e ci rimangono dunque altri 12 elettroni da posizionare. Assegnamo 3 doppietti solitari a ciascun atomo di ossigeno (più elettronegativo dell'azoto) in modo da raggiungere una configurazione ad 8 elettroni
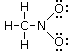
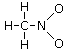
In questo modo l'azoto non presenta tuttavia l'ottetto completo (ha solo 3 legami per un totale di 6 elettroni) e quindi trasferiamo un doppietto solitario di uno dei due atomi di Ossigeno per formare un doppio legame N=O
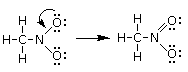
Calcoliamo ora la carica formale di ciascun atomo. Sostituiamo i trattini che rappresentano i legami con coppie di puntini (i due elettroni condivisi) e successivamente contiamo gli elettroni intorno ai singoli atomi (elettroni di valenza degli atomi legati)
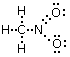
L'atomo di ossigeno con il doppio legame presenta 6 elettroni, di cui 2 elettroni per i due legami e 4 per i due doppietti solitari). Avendo l'ossigeno isolato 6 elettroni di valenza la sua carica formale è nulla. L'atomo di ossigeno con il legame semplice presenta invece 7 elettroni, di cui 1 elettrone per il legame e 6 per i tre doppietti solitari. Avendo dunque un elettrone in più rispetto ai 6 elettroni di valenza di un atomo di ossigeno isolato, la sua carica formale è -1.

L'atomo di Azoto presenta 4 elettroni (metà degli 8 elettroni che formano i suoi 4 legami) Avendo dunque un elettrone in meno rispetto ai 5 elettroni di valenza di un atomo di Azoto isolato, la sua carica formale è +1.

L'atomo di Carbonio presenta 4 elettroni (metà degli 8 elettroni che formano i suoi 4 legami) Avendo dunque il medesimo numero di elettroni di un atomo di carbonio isolato, la sua carica formale è nulla.

La formula di Lewis del nitrometano sarà pertanto
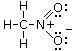
Si rammenti che una formula di Lewis non è completa se non presenta le corrette cariche formali.
 |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |