 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6078 | Gradito: |
Leggi anche appunti:I GasI Gas Materiale: 2 compresse effervescenti, un cilindro da 100 ml con Numero di ossidazione (nox) o stato di ossidazione (stox)Numero di ossidazione (nox) o stato di ossidazione (stox) Si definisce numero D - Composti binari dell'idrogeno (idracidi ed idruri)D - Composti binari dell'idrogeno (idracidi ed idruri) Idruri Gli |
 |
 |
In generale, l'interazione attrattiva totale fra molecole neutre, polari o apolari, denominata attrazione di van der Waals, dipende dal contributo delle interazioni descritte precedentemente, dipolare (di orientazione), di induzione e di dispersione. Dato che nella fase fluida tutte tre dipendono dall'inverso della sesta potenza della distanza si può esprimere unitariamente l'energia di attrazione come
![]()
dove la costante di proporzionalità A dipende dalla natura delle molecole interagenti.
Le forze di attrazione di van der Waals prevalgono alle distanze intermolecolari maggiori. Esse hanno un range compreso fra qualche Ǻ ed un centinaio di Ǻ.
A distanze inferiori di qualche Ǻ entrano tuttavia in gioco forze repulsive. L'effetto repulsivo a corto raggio, chiamata repulsione sterica o repulsione di van der Waals, si genera tra i nuclei che, a distanze piccole, non sono più ben schermati dagli elettroni, e fra gli elettroni stessi, soggetti a una forza repulsiva che si genera quando due o più di essi tendono ad occupare gli stessi numeri quantici, in opposizione al principio di Pauli.
Tali forze repulsive, caratterizzate da un raggio d'azione molto breve, crescono rapidamente all'avvicinarsi delle molecole. Il calcolo delle interazioni tra coppie di molecole a brevi distanze presenta notevoli difficoltà. Per esse non esiste infatti un'equazione ricavata teoricamente che le descriva e ci si affida quindi ad alcune funzioni potenziali empiriche. E' richiesto solo che esse tendano a zero per r che tende all'infinito più velocemente del termine r6.
Una drastica approssimazione, che in qualche caso si adotta per semplificare la trattazione, consiste nell'assumere per le repulsioni a corto raggio la forma
E = 0 per r >
per r ≤
note come repulsioni a sfera rigida (hard-sphere).
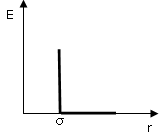
dove σ, detto diametro di collisione, è il diametro della sfera che approssima l'atomo o la molecola. È la distanza di massimo avvicinamento di due molecole e dunque la distanza che separa i due nuclei quando le molecole urtano ed al di sotto della quale la repulsione diventa infinita (impenetrabilità).
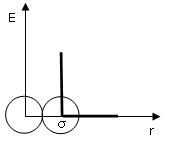
Per determinare si utilizza spesso la somma dei raggi di van der Waals delle molecole interagenti.
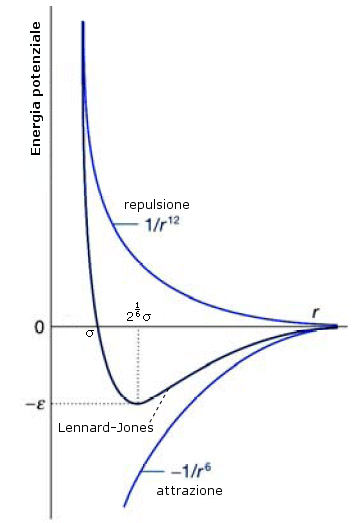
Una approssimazione migliore e molto utilizzata rispetto al modello a sfera rigida è quella di Lennard-Jones in cui la parte repulsiva ha una dipendenza da r12
![]()
dove la costante di proporzionalità B dipende, ancora una volta, dalla natura delle molecole. La repulsione cresce inversamente alla distanza r fra gli atomi elevata alla dodicesima potenza, cioè molto bruscamente. Non esistono argomenti teorici in favore dell'esponente 12, che è stato scelto solo per convenienza di calcolo (essendo il quadrato del termine r6).
Per ottenere l'energia netta dell'interazione intermolecolare si sommano le energie di repulsione e di attrazione viste precedentemente
![]()
Questa relazione si scrive solitamente nella forma del potenziale di Lennard-Jones
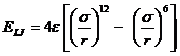
in cui compaiono i parametri σ e ε, il cui valore dipende dal tipo di atomi.
Il primo (σ) ha le dimensioni di una lunghezza ed è la distanza alla quale il potenziale si annulla.
Il secondo (ε) ha le dimensioni di un'energia e rappresenta la profondità della buca di potenziale e dunque l'energia di interazione intermolecolare.
I due parametri possono essere messi in relazione rispettivamente con il diametro atomico e con la massima energia di attrazione tra una coppia di molecole. Se A e B sono molecole diverse, si definisce
![]()
![]()
Il potenziale di Lennard-Jones è particolarmente adatto per simulazioni di gas nobili
 |
| Appunti su: potenziale di lennard jones, forze repulsive a corto raggio, raggio van der waals, gas di van der waals, |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |