 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 4316 | Gradito: |
Leggi anche appunti:Reattività degli addotti MX2(N,N'-C12H6N2O2); M = Co,Fe, X = Cl; M = Ni, X = BrReattività degli addotti MX2(N,N'-C12H6N2O2); M = Co,Fe, X = Cl; M = Ni, X = Br. 1.1.1. Reazione La velocita' di reazioneLA VELOCITA' DI REAZIONE Abbiamo appena parlato di enzimi, e del fatto che La cellula eucariote animaleLa cellula eucariote animale La cellula eucariote animale è formata da una |
 |
 |
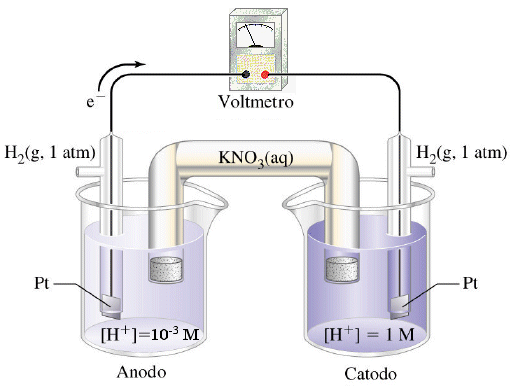
Se dunque una medesima semicella può presentare potenziali diversi in funzione della sua concentrazione, sarà possibile costruire una pila che utilizzi due semielementi identici (stessa coppia redox) che differiscano tra loro solo per la concentrazione. Tali celle sono dette pile a concentrazione.
Consideriamo ad esempio i seguenti due elettrodi
Pt│H2(g, 1 atm)│H+ (aq, 1 M)
Pt│H2(g, 1 atm)│H+ (aq, 10-3 M)
Il primo è l'elettrodo standard ad idrogeno e presenta quindi, per definizione, potenziale pari a 0 V
Il secondo, più diluito, con una [H+] = 10-3 M e dunque un pH = 3, presenta potenziale pari a
![]()
Se colleghiamo i due elettrodi otteniamo una pila a concentrazione in cui l'elettrodo più diluito farà da anodo (potenziale inferiore E = -0,177 V) e l'elettrodo più concentrato fungerà da catodo (potenziale più elevato E = 0 V).
La forza elettromotrice della pila sarà
fem .= Ecat - Ean = 0 - (- 0,177) = 0,177 V
(-) Pt(s)│H2(g, 1 atm)│H+ (aq, 10-3 M) || H+ (aq, 1 M) │H2(g, 1 atm)│ Pt(s) (+)
anodo ponte catodo
Si noti come all'anodo la semireazione di ossidazione faccia aumentare la concentrazione degli ioni H+
Anodo H2 → 2H+ + 2e
mentre al catodo la semireazione di riduzione faccia diminuire la concentrazione degli ioni H+
Catodo 2H+ + 2e → H2
La pila lavora fino a quando le concentrazioni degli ioni H+ nelle due semicelle non saranno uguali. A questo punto anche i potenziali delle due semicelle avranno lo stesso valore e la differenza di potenziale sarà nulla (pila scarica).
Se applichiamo l'equazione di Nernst all'intera pila possiamo infine verificare come la fem (ΔE) di una pila a concentrazione non dipenda dal potenziale standard E° delle due semicelle (e quindi non dipende dalla coppia redox scelta), ma solo dal rapporto delle concentrazioni
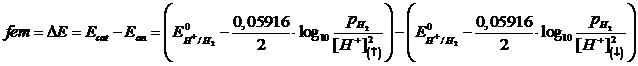
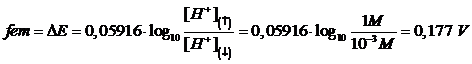
dove i pedici (↑) e (↓) indicano rispettivamente la soluzione più concentrata e quella più diluita La relazione è indipendente dagli E° che, essendo uguali per i due semielementi, si elidono.
Nell'esempio appena visto, gli ioni H+ rappresentavano la specie ossidata della coppia redox H+/H2 e l'elettrodo più concentrato presenta il potenziale maggiore e funge da catodo.
È semplice tuttavia verificare che in una pila a concentrazione:
- se cambiano le concentrazioni della specie ossidata la semicella più concentrata funge da catodo
- se cambiano le concentrazioni della specie ridotta la semicella più concentrata funge da anodo
Esempio
Calcolare la forza elettromotrice della pila a concentrazione che utilizza i seguenti due elettrodi
Pt(s)│Cl2(g, 1 atm)│Cl- (aq, 10-1M)
Pt(s)│Cl2(g, 1 atm)│Cl- (aq, 10-3M)
e scrivere il diagramma di cella
Applichiamo l'equazione di Nernst al primo elettrodo (più concentrato)
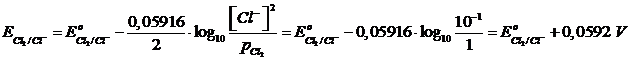
Applichiamo l'equazione di Nernst al secondo elettrodo (più diluito)
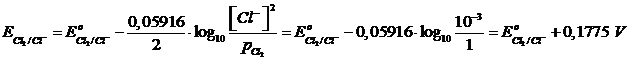
Il secondo elettrodo aumenta il suo potenziale in misura maggiore del primo (0,1775 V contro 0,0592 V) rispetto al potenziale standard E° (che ovviamente è uguale in entrambi gli elettrodi).
Il secondo elettrodo fungerà quindi da catodo (potenziale più elevato), mentre il primo fungerà da anodo (potenziale più basso) e la fem della pila sarà fem = 0,1775 - 0,0592 = 0,1183 V
Il diagramma di cella è
(-) Pt(s)│Cl2(g, 1 atm)│Cl- (aq, 10-1M) || Cl- (aq, 10-3M) │Cl2(g, 1 atm)│ Pt(s) (+)
anodo ponte catodo
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicapile-a-concentrazione13php, pile concentrazione, pila a concentrazione, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |