 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2050 | Gradito: |
Leggi anche appunti:I legami chimiciI legami chimici Obiettivi: verificare l'esistenza del legame ionico, Legge delle proporzioni definite e costanti (Proust 1799)Legge delle proporzioni definite e costanti (Proust 1799) 'In un determinato La chimica organica: gli idrocarburiLA CHIMICA ORGANICA: GLI IDROCARBURI La chimica organica si occupa |
 |
 |
Nella seconda metà dell'Ottocento la scoperta di nuovi elementi chimici e lo studio delle loro proprietà, sia fisiche che chimiche, rese evidente l'esistenza di regolarità all'interno dei diversi tipi di atomi.
Vi furono molti tentativi di classificare e raggruppare gli elementi in funzione delle loro caratteristiche.
Il risultato di maggior rilievo in questa direzione fu senz'altro quello conseguito dal russo D.I. Mendeleev che nel 1869 propose una tavola periodica degli elementi ordinati secondo il peso atomico relativo crescente in periodi (righe orizzontali) e gruppi (colonne verticali). All'interno di uno stesso gruppo venivano collocati gli elementi che presentavano caratteristiche chimiche analoghe.
Fatto notevole della tabella periodica è che alcune caselle lasciate vuote da Mendeleev poiché non esisteva alcun elemento con le caratteristiche previste per quella posizione, vennero in seguito occupate quando l'elemento in questione venne scoperto.
Oggi sappiamo che gli elementi non vanno ordinati secondo il peso atomico crescente, ma secondo il numero crescente di protoni che presentano nel loro nucleo.
Il numero di protoni del nucleo è detto numero atomico Z ed ogni elemento differisce dagli altri per avere un diverso numero atomico che, per gli elementi naturali, può assumere i valori da 1 (Idrogeno) a 92 (Uranio). La classificazione secondo il peso atomico crescente coincide, per la maggior parte degli elementi, con la classificazione effettuata secondo il numero atomico crescente.
Esistono tuttavia 4 coppie di elementi adiacenti (Ar/K Co/Ni Te/I Th/Pa (Torio/Proattinio)) che, se classificati secondo il peso atomico crescente, non si incolonnano correttamente.
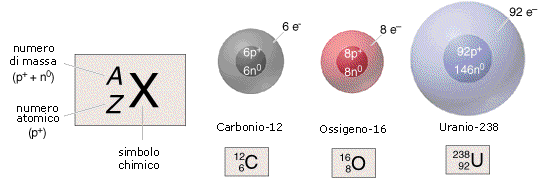
Ogni atomo è poi caratterizzato dal numero dei neutroni N del suo nucleo. Protoni e neutroni vengono anche complessivamente indicati con il termine di nucleoni. Il numero di nucleoni di un atomo costituisce il suo numero di massa A (la massa di un atomo è data essenzialmente dal suo nucleo e quindi da protoni e neutroni, in quanto gli elettroni sono circa 3 ordini di grandezza meno massicci di un nucleone). Tra A, Z ed N esiste la seguente ovvia relazione
A = Z + N
Quando ci si riferisce alla composizione nucleare di un atomo, si
preferisce indicare quest'ultimo con il termine di nuclìde. Ciascun nuclide viene univocamente individuato dal valore
di Z ed A. Un nuclide di un elemento viene rappresentato ponendo il numero
atomico Z in basso a sinistra del simbolo dell'elemento ed il numero di massa A (Z + N) in alto a
sinistra. Ad esempio il simbolo ![]() (leggi: carbonio
sei-quattordici) rappresenta l'isotopo del Carbonio che possiede 6 protoni e 8
neutroni (N = A - Z = 14 - 6 = 8). Visto che il simbolo dell'elemento è in
corrispondenza biunivoca con il numero atomico Z quest'ultimo può essere
sottointeso e così si può ad esempio scrivere 12C o C-12 per indicare l'isotopo sei-dodici del
Carbonio.
(leggi: carbonio
sei-quattordici) rappresenta l'isotopo del Carbonio che possiede 6 protoni e 8
neutroni (N = A - Z = 14 - 6 = 8). Visto che il simbolo dell'elemento è in
corrispondenza biunivoca con il numero atomico Z quest'ultimo può essere
sottointeso e così si può ad esempio scrivere 12C o C-12 per indicare l'isotopo sei-dodici del
Carbonio.
Un nuclide di un generico elemento X viene dunque rappresentato
![]() o semplicemente
o semplicemente ![]()
Gli isotopi sono nuclidi di un medesimo
elemento chimico (stesso Z) che differiscono per il numero dei neutroni N (ad esempio ![]() (Pròzio)
(Pròzio) ![]() (Deuterio)
(Deuterio) ![]() (Trizio))
(Trizio))
Il termine isotopo deriva da un termine greco che significa "stesso posto", in quanto tutti gli isotopi di un medesimo elemento, avendo lo stesso numero atomico Z, occupano lo stesso posto, la stessa casella, nella tabella periodica.
Nuclidi con lo
stesso numero di massa A sono detti isòbari
( ad esempio ![]() )
)
Nuclidi con lo
stesso numero neutroni N sono detti isòtoni
( ad esempio ![]() )
)
La tabella periodica riporta in ciascuna casella sia il valore del numero atomico Z dell'elemento che il valore del suo peso atomico relativo.
In realtà il peso atomico è la media ponderata (pesata) delle masse dei suoi isotopi. Ogni elemento chimico è presente in natura sotto forma di una miscela dei suoi isotopi, i quali sono però più o meno abbondanti e contribuiscono pertanto in maniera diversa al peso atomico dell'elemento, in proporzione alla loro diffusione percentuale.
Prendiamo ad
esempio i due isotopi più diffusi del Cloro, il Cloro-35 (![]() ) ed il Cloro-37 (
) ed il Cloro-37 (![]() ). Se essi fossero presenti in natura con le medesime
percentuali, il peso atomico relativo medio del Cloro sarebbe di 36 u. In
realtà su 100 atomi di Cloro, 75 sono di Cloro-35 e 25 sono di Cloro-37. Per
calcolare il peso atomico medio dobbiamo dunque calcolare non una media
semplice, ma una media che tenga conto della loro diversa frequenza, del loro
diverso 'peso' (inteso come importanza), appunto una media ponderata o pesata.
). Se essi fossero presenti in natura con le medesime
percentuali, il peso atomico relativo medio del Cloro sarebbe di 36 u. In
realtà su 100 atomi di Cloro, 75 sono di Cloro-35 e 25 sono di Cloro-37. Per
calcolare il peso atomico medio dobbiamo dunque calcolare non una media
semplice, ma una media che tenga conto della loro diversa frequenza, del loro
diverso 'peso' (inteso come importanza), appunto una media ponderata o pesata.
![]()
I pesi atomici relativi che compaiono nella tabella periodica possono essere utilizzati per determinare i pesi molecolari relativi (nel caso di formule minime si parla di peso-formula).
Per determinare il peso molecolare relativo di una sostanza è sufficiente sommare i pesi atomici di tutti gli elementi che compaiono nella formula, ciascuno moltiplicato per il rispettivo indice.
Ad esempio il peso molecolare dell'acido solforico H2SO4 è pari a
![]()
 |
| Appunti su: la scoperta del numero di massa, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |