 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3349 | Gradito: |
Leggi anche appunti:L'impressionismo - paul gauguin, paul cezanneL'Impressionismo Nella seconda metÓ dell'Ottocento era ancora molto LA GHISA - Produzione della ghisa, Tipi particolari di ghisa, Destinazione e impiego della ghisaLA GHISA La ghisa comune contiene una percentuale di carbonio che varia dal Numero di ossidazione (nox) o stato di ossidazione (stox)Numero di ossidazione (nox) o stato di ossidazione (stox) Si definisce numero |
 |
 |
Si determina la velocitÓ all'inizio della reazione dalla misura della variazione di concentrazione in un breve intervallo di tempo, viniz = DA / Dt. Dato che la concentrazione in questo piccolo intervallo di tempo varia di poco si pu˛ considerare approssimativamente uguale a quella iniziale e dunque la legge di velocitÓ si scrive cosý
![]()
Ripetendo l'esperimento con una diversa concentrazione iniziale [A]0' ámantenendo invariata la concentrazione iniziale di B si ha
![]()
Dal rapporto tra le due misure si ottiene
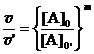
da cui si determina l'ordine di reazione di A:
![]()
Lo stesso procedimento si ripete per determinare l'ordine n di B.
Esempio 1
Per la reazione in fase gassosa fra ossido di azoto NO e idrogeno H2 si hanno le seguenti misure, della velocitÓ iniziale di reazione con concentrazioni (pressioni parziali) diverse di NO e la medesima concentrazione (pressione parziale) di H2.
|
NO |
piniz |
v iniz Dp/Dt |
|
|
torr |
1.50 torr/s |
|
|
torr |
0.25 torr/s |
L'ordine di reazione m rispetto a NO sarÓ
![]()
Mantenendo invece costante la concentrazione iniziale di NO ed eseguendo la misura della velocitÓ con concentrazioni (pressioni parziali) diverse di H2 si ottengono le seguenti misure
|
H2 |
piniz |
v iniz Dp/Dt |
|
|
torr |
1.60 torr/s |
|
|
torr |
0.79 torr/s |
L'ordine di reazione n rispetto ad H2 sarÓ
![]()
Esempio 2
La velocitÓ della reazione 2NO(g) +O2(g) → 2NO2(g) Ŕ stata misurata a 25░C a varie concentrazioni iniziali di NO e O2. Sono stati ottenuti i seguenti risultati riguardanti la velocitÓ iniziale
|
N. Esperimento |
Concentrazione iniziale (mol dm-3) |
VelocitÓ iniziale (mol dm-3 s-1) |
|
|
NO |
O2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Trovare l'ordine di reazione rispetto a ciascun reagente e la costante di velocitÓ specifica
Per calcolare l'ordine della rezione rispetto ad NO dobbiamo individuare due concentrazioni iniziali di NO diverse in corrispondenza delle quali la concentrazione di O2 rimane costante. I valori delle righe 2 e 4 fanno al caso nostro.
Scriviamo la relazione per il calcolo dell'ordine e sostituiamo i valori
![]()
Per calcolare l'ordine della rezione rispetto ad O2 dobbiamo individuare due concentrazioni iniziali di O2 diverse in corrispondenza delle quali la concentrazione di NO rimane costante. I valori delle righe 1 e 3 fanno al caso nostro.
Scriviamo la relazione per il calcolo dell'ordine e sostituiamo i valori
![]()
La velocitÓ di reazione Ŕ dunque
v = k [NO]2[O2]
La costante di velocitÓ specifica si pu˛ calcolare esplicitandola dalla reazione precedente e sostituendo opportunamente i valori di concentrazione e velocitÓ scelti da una riga qualsiasi della tabella dei dati forniti dal problema
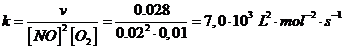
 |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |