 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2077 | Gradito: |
Leggi anche appunti:Le forme piranosiche del GlucosioLe forme piranosiche del Glucosio Formazione di un legame emiacetalico Forze di Debye o interazioni dipolo permanente-dipolo indotto (effetto di induzione)Forze di Debye o interazioni dipolo permanente-dipolo indotto (effetto di induzione) Le Il modello di Bohr-Sommerfeld: numero quantico secondario lIl modello di Bohr-Sommerfeld: numero quantico secondario l Tra le ipotesi |
 |
 |
Nel rappresentare le reazioni abbiamo finora usato una sola freccia → che indica la direzione da reagenti a prodotti, come se le reazioni potessero andare solo in quella direzione, cioè come se esse fossero tutte irreversibili; in effetti quasi tutte le reazioni chimiche sono reversibili e dovremo perciò usare una doppia freccia e scrivere
![]()
Questo comporta che dai prodotti si possa ottenere i reagenti; in realtà avremo, quando il sistema si sarà stabilizzato, quando cioè sarà all'equilibrio, una situazione in cui saranno presenti tutti i componenti, ognuno con una concentrazione che non cambia nel tempo (sempre che non cambino i parametri: pressione p, numero di moli dei singoli componenti ni, temperatura T).
Nella figura 21.1 vengono evidenziate le variazioni delle concentrazioni nel tempo, sia che si parta dai reagenti, sia che si parta dai prodotti. Notare che le concentrazioni di partenza possono essere casuali: quando si crea un sistema di reazione, non è necessario che le quantità dei componenti rispettino esattamente i coefficienti stechiometrici. La reazione procede comunque, in base ai coefficienti stechiometrici propri della reazione.
Per esempio: se ho una reazione del tipo:
2 A + B D C
e se il mio sistema è formato da 1 mole di A e 10 moli di B, la reazione procede comunque ma, supponendo che reagiscano quasi tutte le moli di A (cioè che l'equilibrio sia spostato quasi completamente a destra), alla fine della reazione avrò circa 0,5 moli di C e resteranno ancora circa 9,5 moli di B.
|
Fig.21.1 Grafico C/t, Concentrazione contro tempo, che rappresenta la variazione di concentrazione di ogni singolo componente in un sistema chiuso in cui avviene la reazione sopra indicata. Se si parte da A (verde) e B (viola), questi avranno una certa concentrazione a t=0, mentre C (rosso) e D (azzurro) hanno concentrazione nulla; mano a mano che la reazione procede le concentrazioni di A e B diminuiscono e contemporaneamente quelle di C e D aumentano fino a raggiungere un valore limite. Viceversa se si parte da C e D. Sia che si parta dai reagenti A e B, sia dai reagenti C e D, le concentrazioni finali sono le stesse e corrispondono alla situazione di equilibrio. |
|
Questa situazione si chiama di equilibrio dinamico: si può considerare raggiunto quando la velocità di reazione diretta è eguale a quella della reazione inversa: per questo si chiama 'dinamico', perché, anche quando l'equilibrio è raggiunto, le reazioni diretta e inversa continuano ad avvenire, ma senza modificare le concentrazioni delle specie presenti.
La posizione dell'equilibrio, cioè le mutue concentrazioni dei componenti, dipende da vari fattori, ma, a parità di questi, non cambia, sia che si parta dai reagenti sia dai prodotti: il risultato finale, nelle stesse condizioni, è lo stesso, anche se la velocità di raggiungimento può essere diversa, ma questo è solo un problema cinetico.
Poiché all'equilibrio le concentrazioni dei componenti sono costanti, sarà costante anche un loro rapporto, che esprime la legge dell'azione di massa (nel senso che se modifico la concentrazione di un componente, automaticamente si modificano le altre in modo che il rapporto generale Kc resti costante).

Per convenzione scriviamo al numeratore i prodotti della reazione così come noi l'abbiamo scritta: se considerassimo la reazione inversa, avremmo al numeratore A e B, al denominatore C e D.
Gli esponenti sono i rispettivi coefficienti stechiometrici (ricordiamo che essi non sono necessariamente eguali a quelli che compaiono nella velocità di reazione, anche se è possibile trovare fra questi e quelli una relazione, purché si conosca il meccanismo di reazione).
La costante Kc viene chiamata costante di equilibrio che è una costante termodinamica; dipende solo dalle sostanze in equilibrio e dalla T del sistema; il simbolo 'c' è dovuto al fatto che essa è espressa mediante le concentrazioni (mol dm-3).
Il valore di Kc è ovviamente costante, ma esso rappresenta la costante di equilibrio solo quando il sistema è effettivamente all'equilibrio; prima del raggiungimento esprime la legge dell'azione di massa.
Queste espressioni dell'azione di massa ci permettono di calcolare come variano le concentrazioni degli altri componenti del sistema se variamo la concentrazione (o la pressione pi o il numero di moli ni) di uno di essi (sempre però a T costante).
La K perciò potrà avere delle dimensioni, che dipendono dalla somma algebrica degli esponenti o essere adimensionale se (a+b) = (c+d).
Quest'ultima condizione significa che non c'è variazione del numero di moli nel corso della reazione.
Quando si tratta di gas, si usano spesso le pressioni parziali anziché le concentrazioni (basta ricordare che, per la legge di Dalton sulle miscele gassose ideali, la pi è proporzionale a ni); otterremo, in questo caso, una Kp.
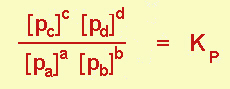
Kp = Kc solo quando le K sono adimensionali, quando cioè non c'è variazione del numero di moli.
Sarà così, per esempio per la reazione di dissociazione dell'acido iodidrico in fase gassosa 2 HI D H2 + I2, mentre per la reazione di sintesi dell'ammoniaca N2 + 3 H2 D 2 NH3 sarà
Kp ≠ Kc
Infatti, poiché la concentrazione, per definizione è ni/V, dalla legge generale dei gas avremo che ni/V = pi/RT, e se sostituiamo nella Kc avremo:
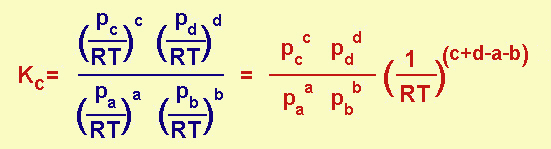
cioè la Kc è uguale alla Kp moltiplicata per un fattore (1/RT) elevato ad un esponente che rappresenta la variazione del numero di moli caratteristico del processo.
Analogamente potremmo definire una Kn.
Solo se Δn = O allora Kp = Kc = Kn.
La K, pur rappresentando la stessa situazione reale, può assumere valori diversi se scriviamo la reazione in modo diverso, perciò è molto importante sapere 'come' è scritta la reazione, per dare il giusto valore e il giusto significato alla costante di equilibrio.
Un esempio: consideriamo la stessa reazione scritta in 3 modi diversi:
I) N2 + 3 H2 D 2 NH3
II) 1/2 N2 + 3/2 H2 D NH3
III) 2 NH3 D N2 + 3 H2
|
|
|
Le tre K sono legate tra loro: KI = KII 2 = KIII -1 Di solito si può dedurre di quale reazione si tratti in base alle dimensioni della K relativa (purché Δn ≠O). |
Fig.21.2 Tre espressioni diverse della K e relative dimensioni, in funzione del diverso modo di scrittura della reazione
In realtà le relazioni che esprimono le K e la legge dell'azione di massa (espresse considerando le concentrazioni o le pressioni parziali) sono perfettamente valide solo per sostanze ideali: occorerebbe utilizzare le 'attività' al posto delle pressioni o delle concentrazioni, che corrispondono a concentrazioni o pressioni 'efficaci'.
L'attività è legata alla concentrazione o alla pressione ideali mediante un coefficiente di attività moltiplicativo.
Ma in prima approssimazione consideriamo che il sistema sia ideale.
Se, quando il sistema è in equilibrio, si cerca di modificare qualcosa dall'esterno, il sistema reagisce cercando di minimizzare l'effetto provocato.
Questo è detto principio dell'equilibrio mobile o principio di Le Chatelier (Henry Louis Le Chatelier, Francia, 1850-1936).
La posizione dell'equilibrio si sposta nella direzione che tende a ristabilire le condizioni iniziali.
Per esempio, se si impone dall'esterno un aumento di pressione, l'equilibrio si sposta verso una situazione di minore pressione (la pressione è però ininfluente se non c'è variazione del numero di moli); nel caso della reazione I di formazione dell'ammoniaca, vista sopra, poiché i reagenti comportano un numero maggiore di moli rispetto al prodotto (con rapporto 2/1) l'equilibrio si sposterà verso destra.
Oppure, se si cerca di aumentare la T, la posizione dell'equilibrio andrà nella direzione che comporta un assorbimento di calore.
Negli equilibri in sistemi omogenei (quelli fin qui considerati), occorre tener conto di tutti i componenti, mentre nei sistemi eterogenei si considera che i componenti in fase condensata (solida o liquida) abbiano 'attività' costante (non 'nulla' o eguale a 1!); perciò questa attività può venire conglobata nella K di equilibrio.
Consideriamo per esempio la reazione di equilibrio:
CaCO3 D CaO + CO2
la costante Kp è semplicemente Kp = pCO2
dato che le 'attività' di CaCO3 e di CaO, essendo solidi (e purché presenti), sono costanti.
Molte reazioni di equilibrio sono reazioni di dissociazione; possiamo ragionare definendo il grado di dissociazione x, come il rapporto tra numero di molecole dissociate e numero di molecole iniziali.
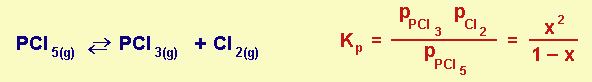
Fig.21.3 Equilibrio di dissociazione gassosa e relativa K di equilibrio espressa anche mediante il grado di dissociazione
Si può perciò calcolare la situazione della reazione di dissociazione purché si conosca la K, oppure si può determinare la K se si conosce il grado di dissociazione.
Un esempio numerico: se abbiamo 1 mole iniziale di pentacloruro di fosforo e questo, a una certa T, ha un grado di dissociazione x del 30% (0,3), all'equilibrio avremo:
0,3 moli (x) di tricloruro; 0,3 moli di cloro; 0,7 moli (1-x) di pentacloruro. La K avrà perciò il valore 0,32/0,7.
In base al principio di Le Chatelier un aumento del volume del recipiente (o una diminuzione della p) favorisce la dissociazione del pentacloruro di fosforo.
In una reazione come la dissociazione dell'acido iodidrico 2 HI D H2 + I2, dato che non c'è variazione del numero di moli nella dissociazione, una variazione di p o di V sarebbe ininfluente.
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |