 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2784 | Gradito: |
Leggi anche appunti:Transizioni di fase: Equazione di Clausius-ClapeyronTransizioni di fase: Equazione di Clausius-Clapeyron Per un generico passaggio Malattie geneticheMalattie genetiche Le malattie genetiche sono causate da alterazioni nel Gli atomi e particelle subatomicheGLI ATOMI E PARTICELLE SUBATOMICHE · Già il filosofo |
 |
 |
Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi.
È attraverso questo tipo di legame che si formano le molecole, aggregati atomici stabili, capaci di esistere come unità indipendenti in tutti gli stati di aggregazione della materia.
Prendiamo la molecola più semplice, quella dell'idrogeno (H2) e usiamola come modello per descrivere la formazione del legame covalente. L'idrogeno (configurazione elettronica 1s) è costituito da un protone e un unico elettrone.
|
|
Energia
potenziale (Ep) in funzione della distanza internucleare nella formazione
della molecola di idrogeno. |
|
Ogni trattino che compare in una formula di struttura rappresenta una coppia di elettroni: questa può essere una coppia di legame, quando è in compartecipazione tra due atomi, o un doppietto solitario. |
Quello che avviene nella formazione della molecola di idrogeno può essere esteso, con le opportune precisazioni, a molte altre molecole biatomiche. Gli alogeni ad esempio, che hanno configurazione elettronica esterna ns2 np5, possono mettere in compartecipazione l'elettrone spaiato di uno degli orbitali p e raggiungere la configurazione elettronica stabile del gas nobile successivo.
|
|
|
Formazione del legame covalente nelle molecole del fluoro e del cloro. |
|
Nella
molecola F2, entrambi gli atomi raggiungono la configurazione
elettronica del neon; |
Il legame covalente non è esclusivo di molecole formate da atomi uguali (omonucleari). Idrogeno e fluoro, ad esempio, possono mettere in compartecipazione una coppia di elettroni (1s dell'H e 2p del F), raggiungendo entrambi la configurazione elettronica stabile dell'He e del Ne, rispettivamente.
![]()
Inoltre, come vedremo più avanti, la configurazione elettronica otteziale può essere raggiunta attraverso la formazione di legami multipli (doppi o tripli) o di più di un legame semplice.
Quando ad essere legati sono due atomi uguali, la coppia di elettroni risulta equamente condivisa fra di essi: si parla in questo caso di legame covalente puro o omopolare. Quando invece il legame si stabilisce fra due atomi diversi, la coppia elettronica risulta spostata (mediamente nel tempo) verso quello che ha maggior affinità elettronica e maggior potenziale di ionizzazione. In tal caso il legame è definito eteropolare.
È possibile avere tutta una gamma di polarità del legame covalente, che va dal legame omopolare fino al massimo grado del legame ionico (CsF). Il legame ionico in effetti può essere considerato un caso limite del legame eteropolare, che si realizza quando la coppia di elettroni è trasferita completamente ad uno dei due atomi.
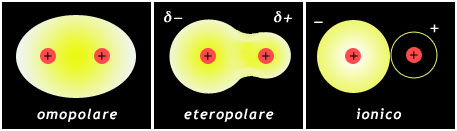
Rappresentazione schematica del legame omopolare, eteropolare e ionico
Nel caso del legame eteropolare, una molecola biatomica si comporta come un dipolo elettrico, in quanto il baricentro delle cariche negative non coincide con quello delle cariche positive. La molecola è polare e presenta un'estremità con parziale carica negativa e un'estremità con parziale carica positiva, come è indicato nella Fig. 4.4, al centro.
Per dipolo si intende un sistema costituito da due cariche elettriche dello stesso valore assoluto e di segno contrario, poste a distanza r fra di loro. Ogni dipolo è caratterizzato da un momento dipolare, definito da μ = qr, dove q indica l'intensità della carica. Il momento dipolare è una grandezza vettoriale, il cui verso è per convenzione dalla carica negativa a quella positiva.
Nel caso delle molecole poliatomiche, per valutarne la polarità occorre considerare la geometria molecolare.
|
|
|
Confronto della polarità dell'anidride carbonica e dell'acqua. |
|
La molecola della CO2, nonostante i legami C-O siano polari, ha μ = 0 D (non è quindi polare). Poiché la sua struttura è lineare, i due dipoli presenti nella molecola, avendo verso opposto, si annullano a vicenda. Nell'acqua il momento dipolare risultante è invece diverso da zero, poiché la molecola ha struttura 'angolare'. |
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicalegame-covalente33php, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |