 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 1806 | Gradito: |
Leggi anche appunti:Esperimento di chimica:le reazioniESPERIMENTO DI CHIMICA:LE REAZIONI QUANDO PUO' AVVENIRE UNA REAZIONE? Innanzitutto Polimeri sintetici e naturaliPolimeri sintetici e naturali Il Nylon ed il Dacron vengono preparati mediante Legge di conservazione della massa di LAVOISIERLegge di conservazione della massa di LAVOISIER In una reazione chimica |
 |
 |
LE PROTEINE
La TLC, appena descritta, permette l'analisi qualitativa e quantitativa di sostanze organiche, quali oli, cere presenti nell'estratto del campione, o proteine. Possiamo porre maggiore attenzione proprio su queste ultime. Le proteine, infatti, sono tra i composti organici più complessi e sono i costituenti fondamentali di tutte le cellule animali e vegetali. Dal punto di vista chimico, una proteina è un polimero (o anche una macromolecola) costituito da amminoacidi, che possono legarsi originando infinite combinazioni. Le proteine quindi sono biopolimeri a peso molecolare definito. In base agli amminoacidi che si legano tra di loro possiamo classificare le proteine in:
Peptidi, se c'e un'unione di pochi amminoacidi;
Polipeptidi, se ci sono fino a 50 amminoacidi legati insieme;
Proteine, se ci sono più di 50 amminoacidi.
Nel nostro organismo gli amminoacidi occorrenti per sintetizzare le proteine provengono dagli alimenti o vengono elaborati dalle cellule. Tuttavia, alcuni di essi non vengono sintetizzati dalla cellula, e perciò sono introdotti dall'esterno, e si definiscono essenziali.
Gli amminoacidi sono composti bifunzionali poiché contengono 2 funzioni: una amminica primaria -NH2 ed una carbossilica -COOH. Un esempio può essere:
![]() R O
R O
![]()
![]()
![]() H2N - CH - C
H2N - CH - C
OH
Nella formula si distingue una parte comune ed un gruppo -R (catena laterale o residuo), che diversifica i vari amminoacidi; tranne un caso, in cui R = H (glicina), tutti hanno il carbonio in posizione α (Cα) chirale e quindi possono esistere in 2 forme enantiomere D e L. Una seconda classificazione degli amminoacidi può essere fatta a seconda della natura del gruppo - R, e cioè se questo è apolare, polare neutro, acido e basico. Gli amminoacidi più importanti sono 20 in tutto, e tra questi ci sono anche quelli essenziali, che si incastrano tra di loro per formare le varie catene.
Una delle più importanti caratteristiche reazioni degli aminoacidi è quella fra il gruppo carbossilico e il gruppo amminico di due amminoacidi, uguali o diversi, che si uniscono per formare un legame ammidico, chiamato anche peptidico.
![]() Legame ammidico o
peptidico
Legame ammidico o
peptidico
![]()
![]()
![]()
![]()
![]()
![]()
![]() R O R' O O
R O R' O O
![]()
![]()
![]()
![]()
![]() H2N - CH - C + H2N - CH - C H2N - CH
- C - NH- CH - C
H2N - CH - C + H2N - CH - C H2N - CH
- C - NH- CH - C
OH OH R R'
Questo dimero prende il nome di dipeptide e per convenzione, si scrive ponendo a sinistra l'amminoacido con la funzione amminica libera, detto amminoacido azoto-terminale, e a destra quello con la funzione carbossilica libera, detto amminoacido carbossi-terminale. Per quanto riguarda il nome dei peptidi, si costruisce sostituendo la desinenza -ina di ogni amminoacido, salvo quella del C-terminale, con la desinenza -il. Se ad esempio si legano insieme l'alanina e la lisina, il peptide si potrà chiamare, o alanil-lisina, o lisil-alanina, ma potremmo avere le combinazioni alanil-alanina, o lisil-lisina. Quando più di 50 amminoacidi si uniscono insieme, si parla di proteine. Ognuna di esse ha una particolare struttura tridimensionale più o meno complessa. Possiamo quindi distinguere:
Struttura primaria: Essa è la struttura delle catene , mai ramificate, dovute al legame peptidico, delle proteine. Grazie a questa struttura calcoliamo il PM della proteina.
Struttura secondaria: Essa si ha se prendiamo in considerazione il legame peptidico-amminico. In alcuni punti la catena si ripiega perché si formano dei legami ah H tra il - CO di un tratto con il - NH più lontano. Ce ne sono 2 tipi:
a)disposizione ad α-elica;
b)disposizione a β-foglietto o a fisarmonica.
Struttura terziaria: Essa si ha quando nei ripiegamenti si trovano dei R' che posti a distanze lontane per effetto della loro natura si creano interazioni e si trovano ravvicinati e quindi legati. E' più facile che venga spezzata una struttura terziaria rispetto ad una secondaria.
Struttura quaternaria: Essa si ha quando più proteine si legano insieme con legami non covalenti.
Riguardo la struttura terziaria possiamo dire, che siccome, questo tipo di struttura presenta interazioni di gruppi R, ci sono dei legami deboli. Se noi diamo calore, questi legami deboli si spezzano e quindi, per effetto di questa rottura, la proteina assume diversa forma e avviene la denaturazione, perdendo cosi la sua funzione.
- Gli enzimi -
Gli enzimi sono stati scoperti dai lieviti (dal greco en zime = dai lieviti); essi sono delle proteine, più precisamente dei catalizzatori biologici, poiché interessano la vita dell'organismo. La loro funzione è quella di accelerare la velocità una reazione chimica. Fanno si che si ottenga la stessa quantità del prodotto, solo a temperature più basse. Per indicare l'efficienza di un catalizzatore di usa il numero di turnover, cioè il numero di molecole di sostanza chimica convertite in prodotto, in un secondo, da ogni molecola di enzima, quando esso opera al meglio delle sue possibilità.
Per quanto riguarda la nomenclatura degli enzimi, una volta essi mantenevano la desinenza -ina relativa alla proteina da cui derivavano gli enzimi, poi si passò all'aggiunta della desinenza -asi alla sostanza su cui l'enzima opera, e quindi al substrato (esempio: L'ureasi e l'enzima che opera sul substrato urea). Infine si passò ad una nomenclatura sistematica fatta dall'UIB, secondo cui ogni enzima è individuato da quattro numeri, dei quali il primo indica la reazione su cui l'enzima è specializzato, mentre gli altri tre forniscono dettagli sull'attività di cui l'enzima è capace.
In alcuni casi gli enzimi sono inattivi, senza la presenza di altre particelle a basso PM, chiamate cofattori. Essi possono essere ioni metallici o molecole organiche. La parte proteica che costituisce l'enzima prende il nome di apoenzima, mentre si chiama proteina enzimatica coniugata o oloenzima l'insieme del cofattore e la proteina enzimatica.
![]() Proteina enzimatica o
apoenzima
Proteina enzimatica o
apoenzima
ioni metallici molecole organiche o coenzimi
![]() Proteina enzimatica
coniugata +
Proteina enzimatica
coniugata +
o oloenzima Cofattore
I cofattori organici sono chiamati anche coenzimi, e più importanti sono il NAD+, il FAD, l'ATP.
Le dimensioni della molecola enzimatica (E) sono molto superiori a quelle della molecola del substrato (S). Questo rapporto dimensionale lascia intendere che ci sono solo alcune regioni dell'enzima che sono interessate all'attività catalitica: queste regioni, sono dette siti attivi (SA) o siti catalitici. Essi quindi sono delle zone ben precise tali da generare delle insenature riconoscibili nel substrato. Il sito attivo può essere generato da aminoacidi vicini o distanti tra di loro. Il meccanismo per l'inserimento del substrato nell'enzima è basato su questa reazione:
![]()
![]()
![]() E
+ S E - S E + P
E
+ S E - S E + P
In cui l'enzima si lega prima al substrato, formando il complesso intermedio E-S; successivamente il substrato si trasforma in Prodotto e lascia libero l'enzima per una nuova operazione catalitica. Questo meccanismo ha portato alla realizzazione di 2 modelli:
Modello di Fischer (o a chiave serratura). Qui l'enzima ha una configurazione già perfettamente complementare al substrato ed il riconoscimento è specifico.
Modello dell'adattamento indotto. Qui l'avvicinamento del substrato all'enzima modifica la struttura di quest'ultimo e migliora la reciproca aderenza. A catalisi avvenuta l'enzima riacquista la conformazione iniziale.
Una caratteristica degli enzimi è quella di possedere alta specificità, vale a dire la capacità di riconoscere un solo substrato un gruppo ristretto di substrati simili. Gli enzimi sono altamente asimterici, molti di loro riconoscono come substrato solo una fra 2 strutture enantiomere. Questo prende il nome di stereospecificità.
Abbiamo detto che gli enzimi influenzano la velocità di 1 reazione chimica, in quanto sono dei catalizzatori, e la accelerano. La velocità di reazione enzimatica è influenzata da 4 fattori:
Concentrazione del substrato; è regolata dalle legge:
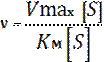
In cui Vmax è la velocità massima, che dapprima da segno di proporzionalità diretta con la concentrazione del substrato, successivamente diventa un valore costante. KM invece si chiama costante di Michaelis e corrisponde alla concentrazione del substrato a metà della velocità massima.
Concentrazione dell'enzima; in quanto si osserva graficamente che c'e proporzionalità diretta tra velocità di reazione enzimatica e concentrazione dell'enzima.
pH dell'ambiente di reazione. Ogni enzima è stabile da un intervallo di pH che va da 4 a 9, al di fuori del quale si denatura. Se il pH assume dei valori diversi da questi, allora si dissociano i residui amminoacilici del sito attivo e quindi la sua forma. e si verifica la dissociazione dei gruppi funzionali del substrato e quindi il suo riconoscimento col sito attivo.
temperatura. Quest'ultimo fattore poiché una reazione enzimatica è influenzata dalla temperatura proprio come ogni altra reazione chimica. Un' aumento di temperatura fa crescere esponenzialmente la sua velocità fino ad un determinato valore, oltre il quale la parte proteica dell'enzima si denatura. Abbassando la temperatura rallentiamo la velocità di reazione degli enzimi.
Per questo esistono dei composti chimici, chiamati inibitori, che sono capaci di rallentare la velocità di una reazione enzimatica o, a volte, di impedire la reazione stessa: essi possono reagire
In maniera irreversibile:
![]()
![]() E + I + S E - I + S
E + I + S E - I + S
![]() E - I X E + P
E - I X E + P
Si forma il complesso stabile enzima-inibitore, non trasformandosi in prodotto, e quindi il substrato non interagisce con l'enzima
In maniera reversibile:
a) Competitiva (competizione tra inibitore e substrato)
![]()
 I
I
![]()
X
E - I
b) Non competitiva (competizione tra inibitore ed enzima libero o inibitore e complesso E-S)
![]()
![]() I I
I I
![]()
![]()
![]()
![]() Trasformazione
Trasformazione
più lenta
![]()
![]() E - I + S E - S - I
E - I + S E - S - I
 |
| Appunti su: |
|
| Appunti Ingegneria tecnico |  |
| Tesine Geografia |  |
| Lezioni Biologia |  |