 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6278 | Gradito: |
Leggi anche appunti:Le sostanzeLE SOSTANZE 1. LE SOSTANZE PURE I metodi per separare i componenti Gli elementi e la tavola periodicaGli elementi e la tavola periodica Oggi si conoscono 109 elementi: 91 di questi sono Uso dell'equazione cinetica integrataUso dell'equazione cinetica integrata Se si possiedono una serie di misure |
 |
 |
L'isomeria configurazionale è una forma di isomeria spaziale (stereoisomeria) che si divide in enantiomeria e diastereoisomeria. Sono enantiomeri gli isomeri configurazionali chirali. Si definisce chirale (dal greco =cheir = mano) una molecola che non è sovrapponibile alla sua immagine speculare. Sono diastereoisomeri gli isomeri configurazionali achirali, che non sono uno l'immagine speculare dell'altro.
Alcuni autori definiscono diastereoisomeri tutti gli stereoisomeri che non sono enantiomeri, comprendendo quindi tra i diastereoisomeri anche i conformeri
Gli isomeri configurazionali, pur mantenendo la medesima connettività (i collegamenti tra i singoli atomi rimangono i medesimi), possono essere trasformati l'uno nell'altro solo rompendo legami chimici e scambiando di posizione i gruppi legati ad un medesimo atomo.
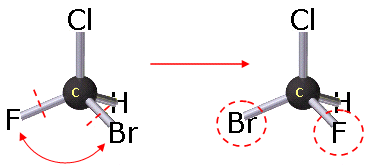
Isomeri
configurazionali - la connettività si conserva (il Fluoro, il Bromo, il Cloro e
l'Idrogeno sono legati al Carbonio in entrambi gli isomeri), ma per
trasformare un isomero nell'altro è necessario rompere i legami C-F e C-Br
e scambiare di posizione gli atomi di Fluoro e Bromo
L'isomeria geometrica è una forma di isomeria configurazionale che deriva dalla presenza nella molecola di un elemento di rigidità (doppio legame Carbonio-Carbonio, anello ciclico) che impedisce alla molecola di ruotare liberamente e completamente attorno ad un legame Carbonio-Carbonio. Gli isomeri geometrici hanno proprietà fisiche diverse (punto di fusione, punto di ebollizione, densità, indice di rifrazione diversi) e sono quindi fisicamente separabili. Gli isomeri geometrici sono diastereoisomeri.
Ricordiamo che vengono definiti diastereoisomeri gli isomeri configurazionali che non sono uno l'immagine speculare dell'altro.
Il doppio legame carbonio-carbonio (legame e legame ) oltre a conferire allo scheletro molecolare una disposizione planare, impedisce ad esempio alla molecola di ruotare attorno all'asse del legame. Si dice che non vi è libera rotazione attorno ad un doppio legame. Da ciò deriva l'esistenza di forme isomere che differiscono, per la posizione spaziale statica (configurazione) di due sostituenti, a seconda che questi ultimi si dispongano dalla stessa parte (isomero cis) o su lati opposti (isomero trans) rispetto al doppio legame. Prendiamo ad esempio in considerazione i seguenti 2 isomeri geometrici del 2-butene.
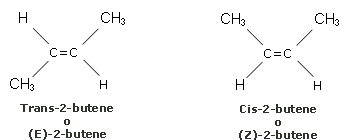
Ciascun composto ha formula grezza C4H8, ma la disposizione dei gruppi rispetto ai due atomi di carbonio legati con doppio legame è diversa. In particolare nell'isomero cis i due gruppi metilici si trovano dallo stesso lato rispetto al doppio legame, mentre nell'isomero trans si trovano su lati opposti. La stessa situazione si ripete ovviamente anche per gli atomi di idrogeno.
Si noti che il butene presenta altri due isomeri (non geometrici): un isomero di posizione (1-butene) ed uno di catena (isobutene)
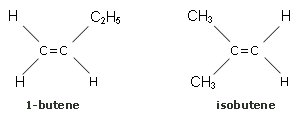
Entrambi questi isomeri non sono isomeri geometrici. Infatti, l'isomeria geometrica non può esistere se uno dei due atomi impegnati nel doppio legame è legato a due gruppi uguali:
|
|
|
Gli isomeri geometrici presentano due diverse configurazioni e non è possibile passare dall'una all'altra senza rompere il doppio legame.
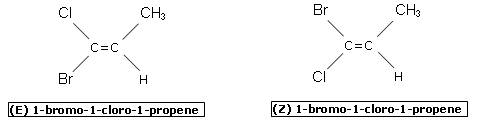
Esistono alcuni isomeri geometrici che non possono essere classificati usando il metodo cis/trans, ad esempio quelli che presentano i due atomi di carbonio impegnati nel doppio legame legati a 4 sostituenti diversi. Prendiamo ad esempio in considerazione i due isomeri del 1-bromo-1-cloro-1-propene.
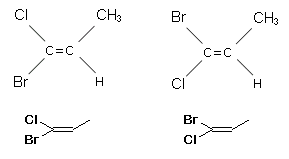
Quale dei due alogeni, il bromo o il cloro, deve essere considerato in posizione trans rispetto al metile e quale in posizione cis?
Per superare questa difficoltà la IUPAC ha introdotto un metodo differente di nomenclatura per gli isomeri geometrici degli alcheni, che utilizza gli stereodescrittori E/Z. Il metodo prevede di assegnare a ciascuno sostituente un ordine di priorità utilizzando le regole di Cahn-Ingold-Prelog. (regole CIP)
Secondo il metodo E/Z:
1) Le due estremità del doppio legame vengono considerate separatamente
2) utilizzando le regole di Cahn-Ingold-Prelog si individua il gruppo a maggior priorità tra i due gruppi di destra ed il gruppo a maggior priorità tra i due gruppi di sinistra (ovviamente affinché ci possa essere isomeria geometrica i due gruppi ad ogni estremità devono essere tra loro differenti
3) Il prefisso (E) (entgegen = opposti) viene assegnato allo stereoisomero in cui i due gruppi a maggior priorità si trovano ai lati opposti rispetto al doppio legame
4) Il prefizzo (Z) (zusammen = insieme) viene assegnato allo stereoisomero in cui i due gruppi a priorità più elevata si trovano dallo stesso lato del doppio legame.
1. La priorità viene attribuita sulla base del numero atomico. Più elevato è il numero atomico più alta è la priorità del sostituente. Per esempio: 17Cl > 8O > 7N > 6C > 1H
2. A parità di numero atomico (isotopi), la priorità spetta all'isotopo con massa atomica maggiore. Così il trizio, l'isotopo dell'idrogeno con massa di 3 uma, ha priorità più alta del deuterio che ha massa atomica di 2 uma. L'idrogeno, che ha numero atomico 1 e massa atomica di 1 uma, ha la più bassa priorità non soltanto rispetto ai suoi isotopi, ma anche rispetto a tutti gli altri elementi della tavola periodica.
3. Se l'applicazione delle due regole precedenti non permette di assegnare la priorità, significa che i due atomi confrontati sono uguali ed è allora necessario esaminare e confrontare ordinatamente gli altri atomi a cui sono necessariamente legati (se non fossero legati ad altri atomi i due sostituenti sarebbero uguali e non vi sarebbe stereoisomeria). Si procede pertanto, sempre applicando le regole precedenti, al confronto degli atomi successivi in entrambe le catene fino al punto in cui si individua una differenza di priorità.
per esempio.
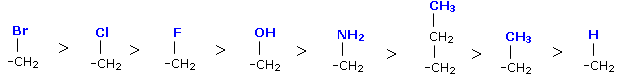
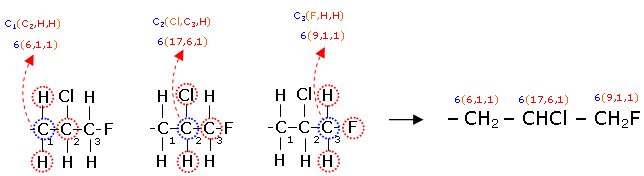
Quando si analizzano catene di atomi può essere utile, per facilitarne il confronto, associare a ciascun atomo della catena il suo numero atomico seguito, in parentesi, dai numeri atomici decrescenti dei 3 atomi che gli sono legati.
Ad esempio analizzando la catena -CH2-CHCl-CH2F possiamo scrivere
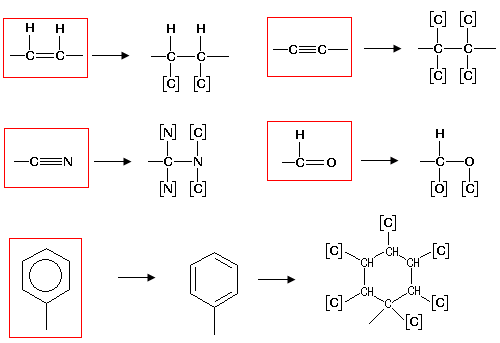
4. I legami multipli vengono tutti trasformati in altrettanti legami semplici, ai quali si unisce una replica dell'atomo precedentemente collegato (solitamente racchiuso in parentesi quadre).
5. Se due sostituenti hanno la stessa costituzione e si differenziano solo per la configurazione (disposizione spaziale degli atomi) si applicano le seguenti regole di priorità:
Come esempio di applicazione delle regole CIP assegnamo la priorità alle seguenti coppie di sostituenti
1° Esempio Sostituente I -CH2-CHCl-CH3 Sostituente II -CH2-CH2-CH2Br
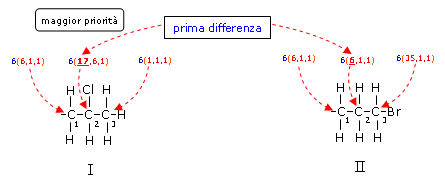
Associamo a ciascun atomo della catena il suo numero atomico (in blu) seguito in parentesi dai numeri atomici decrescenti dei 3 atomi che gli sono legati (in rosso). Il carbonio C1 è uguale nelle due catene → = . Passiamo a confrontare l'atomo successivo. Il carbonio C2 presenta la prima differenza → > , grazie all'atomo di Cloro di numero atomico 17. Possiamo interrompere il confronto ed assegnare la priorità al Sostituente I. Si noti come l'atomo C3 avrebbe assegnato la priorità al Sostituente II per la presenza di un atomo di Br, ma si trova oltre la posizione in cui è stata individuata la prima differenza di priorità.
2° Esempio
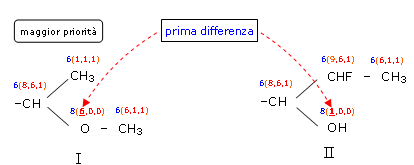
Il primo atomo di carbonio è uguale nei due sostituenti → = . Passiamo a confrontare l'atomo successivo. Qui la catena si ramifica e dobbiamo così confrontare quattro gruppi. Se confrontiamo i gruppi della catena superiore troviamo una differenza → < che assegnerebbe la priorità al Sostituente II. Ma se confrontiamo i gruppi della catena inferiore troviamo una differenza nella stessa posizione → > che assegnerebbe la priorità al Sostituente I. In questo caso si considera prevalente la differenza tra i due gruppi della catena inferiore, infatti la ramificazione inferiore inizia con un atomo di Ossigeno (numero atomico 8) che è prioritario rispetto all'atomo di carbonio (numero atomico 6) con cui inizia la ramificazione superiore. La priorità si assegna dunque al Sostituente I.
Nel caso invece i due sostituenti da confrontare fossero stati i seguenti
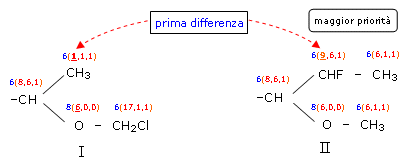
la catena inferiore, pur essendo prioritaria in quanto inizia con un atomo a maggior numero atomico, non avrebbe avuto effetto sull'assegnazione della priorità, poichè il primo atomo con cui inizia la ramificazione non presenta differenze → = Prevale invece la differenza trovata sul primo atomo della ramificazione superiore → < che assegna la priorità al Sostituente II. Si noti come il secondo gruppo della ramificazione inferiore avrebbe assegnato la priorità al sostituente I → > , ma si trova oltre la posizione in cui è stata individuata la prima differenza di priorità.
Si noti infine che tutti gli elementi, ad eccezione dell'Idrogeno, vengono considerati tetravalenti. Quando il numero di legami effettivi è minore di 4 vengono introdotti dei legami virtuali con atomi fantasma (phantom atoms) di numero atomico zero. Si veda nell'esempio precedente il valore assegnato all'atomo di ossigeno.
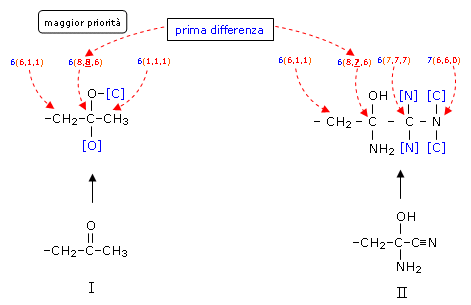
3° Esempio
I due sostituenti contengono doppi e tripli legami. Prima di confrontarli è necessario sostituire tutti i legami multipli con altrettanti legami semplici. Vengono introdotti, racchiusi in parentesi quadre, atomi fittizi per saturare i legami semplici che sostituiscono i legami doppi e tripli. La prima differenza viene trovata sul secondo atomo di carbonio della catena e permette di assegnare la priorità al Sostituente I
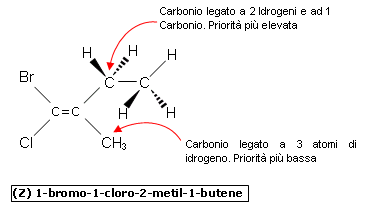
Applicando le regole CIP (Cahn Ingold Prelog) all'1-bromo-1-cloro-1-propene, troviamo che il Bromo, avendo più elevato numero atomico, ha priorità sul Cloro, ed il Carbonio ha priorità sull'Idrogeno (per lo stesso motivo). Per cui
Nell'1-bromo-1-cloro-2-metil-1-butene, dobbiamo confrontare, all'estremità destra del doppio legame un gruppo metile ( -CH3) con un gruppo etile (-CH2CH3). Abbiamo visto che il gruppo etile ha priorità sul metile. Poiché infine il Bromo ha priorità sul Cloro e si trova dalla stessa parte del gruppo etile, il composto prenderà il prefisso (Z)
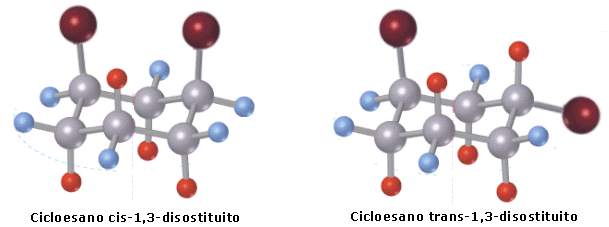
Il fenomeno della isomeria geometrica si ritrova in tutte le classi di composti che contengono un doppio legame. Esistono tuttavia esempi di isomeria geometrica anche in composti privi di doppi legami. È il caso ad esempio dei cicloalcani disostituiti, in cui i due gruppi sostituenti possono trovarsi dalla stessa parte (cis) o da parti opposte (trans) rispetto al piano dell'anello.
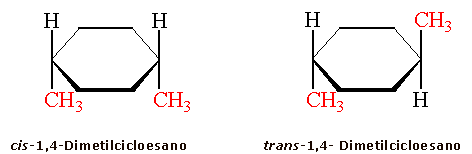
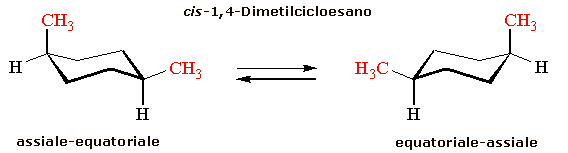
Ad esempio il cicloesano, nella sua conformazione più stabile (a sedia), può legare 2 sostituenti entrambi in posizione assiale (o equatoriale) formando un isomero cis, oppure uno in posizione assiale ed uno in posizione equatoriale, formando un isomero trans
Esistono due possibili conformazioni a sedia del trans-1,4-dimetilcicloesano: diassiale e diequatoriale in rapida interconversione (ring flip)
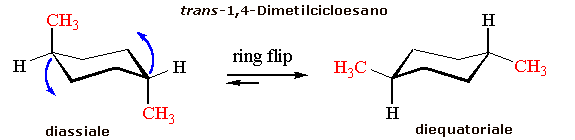
La conformazione diequatoriale è ovviamente più stabile poiché non produce tensioni steriche connesse alle interazioni 1,3 diassiali. Circa il 99% delle molecole all'equilibrio si trovano in conformazione diequatoriale.
Ovviamente anche il cis-1,4-dimetilcicloesano presenta due conformeri, ma essi presentano sempre un metile equatoriale ed uno assiale e quindi risultano perfettamente equivalenti dal punto di vista energetico
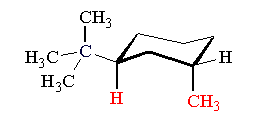
Nel caso di cicloesani disostituiti con gruppi diversi, il conformero trans più stabile risulta quello con il gruppo sostituente più ingombrante in posizione equatoriale (i due conformeri cis sono ovviamente sempre equivalenti). Ad esempio il trans-1,3-isobutil-metil-cicloesano si presenta con due conformeri di cui il più stabile porta il gruppo isobutilico (più ingombrante) in posizione equatoriale.
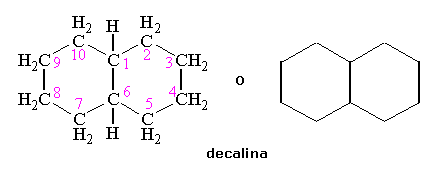
Esistono esempi di isomeria cis-trans anche nei composti policiclici. La decalina, ad esempio è costituita da due anelli di cicloesano in conformazione a sedia unite tramite due atomi di carbonio, che condividono, chiamati atomi di carbonio testa di ponte (bridgehead carbons, C1 e C6).
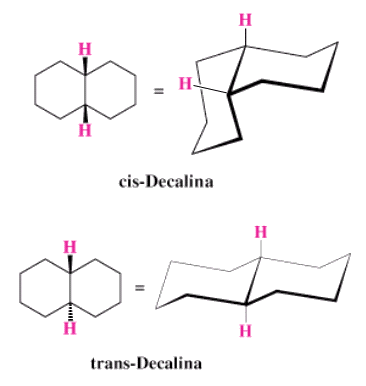
I due atomi di idrogeno legati agli atomi di carbonio testa di ponte possono trovarsi dallo stesso lato del piano molecolare (cis-decalina) o da lati opposti (trans-decalina)
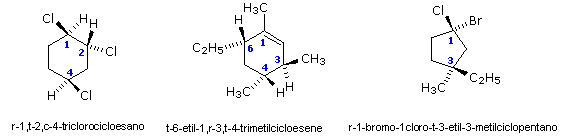
Se un anello presenta più di due sostituenti uguali, la disposizione spaziale relativa può essere espressa identificando il primo sostituente con la lettera r seguita dalla sua posizione sull'anello. La configurazione relativa degli altri rispetto al primo sarà c (cis) o t (trans). Quando due sostituenti diversi sono sono legati ad una medesima posizione, allora si sceglie come gruppo di riferimento quello che presenta la numerazione più bassa
Enantiomeria e Diastereoisomeria
L'enantiomeria o isomeria ottica è una forma di isomeria configurazionale che deriva dalla presenza di molecole chirali. Si definisce chirale (dal greco =cheir = mano) una molecola che non è sovrapponibile alla sua immagine speculare.
I call any geometric figure, or group of points, chiral and say it has chirality, if its image in a plane mirror, ideally ralized, cannot be brought to coincide with itself
Sir W. Thompson (Lord Kelvin) 1893
Se una molecola è chirale, allora la sua immagine speculare non è ad essa sovrapponibile e le due molecole costituiscono una coppia di stereoisomeri detti enantiomeri. Si noti che se l'immagine speculare di una molecola fosse ad essa sovrapponibile, non si tratterebbe di un nuovo stereoisomero, ma della medesima molecola.
Il concetto di chiralità può essere descritto in modo più rigoroso sulla base delle caratteristiche di simmetria della molecola, argomento sul quale torneremo brevemente più avanti.
Tutti gli isomeri configurazionali che non sono enantiomeri sono, per definizione, diastereoisomeri.
Si definiscono pertanto diastereoisomeri, gli isomeri configurazionali che non sono l'immagine speculare l'uno dell'altro (ed ovviamente non sono neppure sovrapponibili, altrimenti sarebbero il medesimo composto).
 |
| Appunti su: priorita maggiore doppio o triplo configurazione, difluoro cicloesano, cis decalina, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |