 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 7034 | Gradito: |
Leggi anche appunti:Composti organici naturaliComposti organici naturali Si tratta di una categoria molto vasta di Il numero quantico magnetico mIl numero quantico magnetico m Il numero dei sottolivelli prodotto dall'introduzione D - Composti binari dell'idrogeno (idracidi ed idruri)D - Composti binari dell'idrogeno (idracidi ed idruri) Idruri Gli |
 |
 |
L'ingegneria genetica (più propriamente tecnologie del DNA ricombinante) è un insieme di tecniche (biotecnologia) che ha l'obiettivo di inserire, eliminare, inattivare o modificare geni all'interno di un organismo, producendo organismi geneticamente modificati (OGM).
Il termine 'OGM' è improprio da un punto di vista biologico in quanto tutti gli organismi caratterizzati da riproduzione sessuata sono, a rigor di termini, geneticamente modificati (nessun individuo è uguale ai propri genitori e nemmeno ai propri fratelli).
La definizione adottata dalla Direttiva europea 2001/18, che regola il rilascio ambientale degli OGM, è la seguente: «un organismo, il cui materiale genetico è stato modificato in modo diverso da quanto avviene in natura con l'accoppiamento e/o la ricombinazione genica naturale». Tale modifica viene definita con il termine di "transgenesi" e l'organismo da esso derivato viene detto transgenico o ricombinante.
Tutto ciò che viene invece ottenuto con programmi di miglioramento genetico convenzionale (incrocio e selezione) «inclusa la mutagenesi (mutazioni indotte dall'esposizione a radiazioni o ad mutageni chimici.) e la fusione cellulare di cellule vegetali di organismi che possono scambiare materiale genetico anche con metodi di riproduzione tradizionali» è escluso dalla definizione di OGM, pur comportando modificazioni del genoma spesso di gran lunga superiori. Tali organismi mutati, non essendo classificati come OGM sono ammessi all'uso anche in agricoltura biologica e molte di queste cultivar (varietà vegetali) sono attualmente presenti sul mercato ed apprezzate dai consumatori. Il popolare grano duro italiano (varietà Creso), ad esempio è una mutazione ottenuta nel 1974 irraggiando la varietà "Cappelli" con raggi gamma provenienti da scorie di reattori nucleari.
Si tenga quindi presente che modificazioni del patrimonio genetico di piante ed animali erano state ottenute anche precedentemente l'avvento delle tecniche di ingegneria genetica. Ma con il termine OGM si intende fare una distinzione tra gli organismi il cui patrimonio genetico è stato modificato tramite l'uso di tecniche di miglioramento genetico classico, considerate 'naturali', da quelli modificati tramite la tecnica del DNA ricombinante, che consentono l'inserimento mirato di sequenze geniche che conducono al fenotipo desiderato.
La maggior parte dei risultati finora conseguiti attraverso l'utilizzo delle tecniche de DNA ricombinante sono stati ottenuti attraverso l'isolamento di geni e la successiva introduzione in un ospite eterologo, anche appartenente ad una specie differente (una sorta di trapianto genico), al fine di conferire caratteristiche nuove alle cellule riceventi. L'obiettivo è quello di esprimere una proteina nuova all'interno di un organismo diverso da quello di origine allo scopo di conferirgli caratteristiche utili.
Attualmente le applicazioni più promettenti si hanno in campo agroalimentare, biomedico ed ambientale.
Applicazioni agroalimentari
piante resistenti agli erbicidi
piante resistenti ai parassiti
piante resistenti alla siccità
frutti che si conservano più a lungo
alimenti arricchiti dal punto di vista nutrizionale (vitamina A nel riso, acidi grassi nella soia).
Applicazioni biomediche ed ambientali
Sintesi di molecole (microrganismi in grado di sintetizzare farmaci, ormoni, vaccini, enzimi, antibiotici etc)
depurazione (batteri che degradano idrocarburi, piante capaci di stoccare metalli pesanti)
Terapia genica (sostituzione geni alterati, introduzione di geni in cellule malate che blocchino il malfunzionamento, introduzioni di geni in cellule tumorali che ne inducano la morte)
test DNA o DNA fingerprinting (letteralmente impronta digitale del DNA, individuazione e confronto DNA per test di paternità, casi di omicidio)
Le tecnologie del DNA ricombinante si avvalgono di tre strumenti molecolari fondamentali:
i vettori genici particolari molecole di DNA in grado di ospitare un gene estraneo e di introdurlo in un genoma.
gli enzimi di restrizione in grado di 'ritagliare' un frammento di DNA contenente il gene e di 'aprire' i vettori genici in modo tale che entrambi, vettore ed inserto genico, presentino le estremità complementari e facilmente ricomponibili
le DNA-ligasi, enzimi in grado di ricomporre i frammenti in modo tale che il gene si integri nel vettore genico.
Gli enzimi di restrizione sono delle endonucleasi, enzimi della famiglia delle nucleasi, che i batteri utilizzano per difendersi dai virus che li infettano, facendo a pezzi il DNA virale. Le nucleasi si distinguono in endonucleasi, che tagliano il filamento di DNA in un punto interno dividendolo in due frammenti ed esonucleasi, che degradano il DNA asportandone nucleotidi alle estremità.
Gli enzimi di restrizione presentano la notevole peculiarità di tagliare il DNA solo in corrispondenza di particolari sequenze di basi (in genere 4, 6 o 8 basi) che essi riconoscono (siti di restrizione).
I siti di restrizione sono quasi tutti palindromi, cioè la successione delle loro basi presenta una sequenza ad essa complementare che risulta uguale se letta al contrario. Ad esempio la successione ACTAGT ha come complementare la successione TGATCA (che è uguale alla precedente letta al contrario). Per convenzione le sequenze di riconoscimento sono scritte da sinistra a destra in direzione 5' → 3'. Quindi ACTAGT rappresenta la sequenza 5'- ACTAGT -3'.
(Una frase è palindrome quando è uguale se letta nei due sensi: "i topi non avevano nipoti")
In un filamento di DNA si trovano naturalmente numerosi siti di riconoscimento per una particolare endonucleasi. In questo modo le endonucleasi tagliano il DNA in molti segmenti, detti frammenti di restrizione.
Gli enzimi di restrizione possono tagliare il DNA in due modi. Alcuni enzimi tagliano il DNA lasciandone le estremità piatte, altri lasciando le estremità sfalsate (alcuni con il filamento 5' più lungo del filamento 3', altri viceversa).
Gli enzimi di restrizione che generano estremità sfalsate sono quelli comunemente usati in ingegneria genetica. Infatti tutte le estremità generate dagli enzimi che operano un taglio sfalsato, siano esse sporgenti in 5' o in 3', sono "coesive" (o adesive o appiccicose, sticky ends), cioè possono formare ponti idrogeno tra le due code a filamento singolo complementari. Nel caso l'enzima di restrizione produca estremità piatte è possibile aggiungere una "coda" (tailing) sfalsata, usando l'enzima terminal transferasi, che aggiunge nucleotidi alle estremità 3' del DNA, generando estremità coesive.
Le estremità coesive facilitano la reazione di ricomposizione della DNA ligasi.
In questo modo, mescolando frammenti di restrizione, anche provenienti da DNA diverso, tagliati con la medesima endonucleasi, i frammenti aderiscono spontaneamente con le loro estremità coesive per un tempo sufficientemente lungo da rendere efficace l'azione di saldatura (formazione dei legami fosfo-diestere) della DNA-ligasi.
L'enzima di restrizione EcoRI (leggi "Eco erre primo"), ad esempio, si lega a sequenze specifiche di DNA in doppia elica GAATTC. Taglia (idrolizza) in modo sfalsato i legami fosfodiestere tra Guanina ed Adenina su entrambi i filamenti (il taglio produce gruppi 3'-OH e 5'-fosfato), generando frammenti di DNA che hanno quattro basi sporgenti in singolo filamento alle estremità 5' (estremità 5' sporgenti).
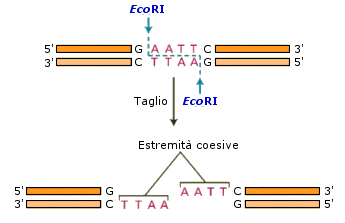
La nomenclatura degli enzimi di restrizione prevede:
Ad esempio:
Pst I Providencia stuarti (I enzima isolato)
Eco RI Escherichia coli Ry13 (I enzima isolato)
Eco RII Escherichia coli R245 (II enzima isolato)
Gli enzimi di restrizione non sono l'unico modo per ottenere un inserto genico da inserire in un vettore. Attraverso l'enzima trascrittasi inversa (o retrotrascrittasi) è possibile catalizzare la trascrizione dell'mRNA in DNA. Dopo che è avvenuta la sintesi di un filamento singolo di DNA si assembla il secondo filamento di DNA, usando il primo come stampo. Il DNA che si forma in questo modo è detto cDNA (DNA complementare). Questa tecnica è utile quando si vuole far esprimere un gene umano ad un batterio. I geni umani sono infatti costituiti di sequenze codificanti (esoni) e sequenze non codificanti (introni) ed i batteri non possiedono le strutture adatte per eliminare gli introni prima di sintetizzare la proteina corrispondente. La molecola di mRNA che si è formata a partire dal gene ha già eliminato gli introni (splicing). Ricostruendo quindi il gene a partire dall'mRNA si ottiene una sequenza genica 'pulita' che i batteri potranno poi trasformare nella proteina corrispondente.
I vettori genici sono delle sequenze di DNA di diversa natura nelle quali sia possibile inserire delle altre sequenze nucleotidiche (gene esogeno) e che siano in grado di integrarsi con il DNA-bersaglio introducendovi il gene esogeno. Attualmente sono disponibili diversi tipi di vettori genici, la cui scelta dipende dalla natura (animale, vegetale, procariote) della cellula bersaglio che deve ricombinare il suo DNA e dalle dimensioni dell'inserto genico che devono ospitare.
|
VETTORI GENICI |
DIMENSIONI DELL'INSERTO |
|
Plasmide |
0 -10 kbp |
|
Fago λ |
10 -20 kbp |
|
Cosmide |
30 -45 kbp |
|
Fago P1 |
70 - 100 kbp |
|
PAC (cromosomi artificiali P1 ) |
130 - 150 Kbp |
|
BAC (cromosomi batterici artificiali) |
0 - 300 Kbp |
|
YAC (cromosomi artificiali di lievito) |
0,2 - 2 Mbp |
|
MAC (cromosomi artificiali di mammifero) |
> 1 Mbp |
I vettori più usati per i batteri (E.coli) sono i plasmidi e i derivati da virus batteriofagi.
Nel caso di vegetali si utilizza un batterio parassita endocellulare di molte specie di piante, l'Agrobacterium tumefaciens, il cui plasmide Ti è in grado di inserirsi nel genoma della cellula vegetale.
Per il lievito (Saccharomyces cerevisiae), un eucariote unicellulare, si utilizza il suo plasmide naturale 2 μm (lunghezza della sua circonferenza) ed una serie di vettori ingegnerizzati da esso derivati.
Infine, per ricombinare cellule animali si utilizzano prevalentemente vettori di natura virale.
|
CELLULA OSPITE |
VETTORI GENICI COMPATIBILI |
|
Batterio |
Plasmidi, fago λ, fago M13, fago P1, PAC, BAC, YAC |
|
Lievito |
Plasmide 2 μm, Plasmidi "navetta" (shuttle), vettori ARS, YAC |
|
Cellule animali |
Vettori derivati da virus |
|
Cellule vegetali |
Plasmidi derivati dal batterio Agrobacterium tumefaciens |
Caratteristiche di un vettore genico
In generale, per svolgere la sua funzione, un vettore deve possedere le seguenti proprietà:
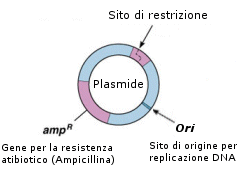
. Un segmento di DNA che lo renda capace di replicarsi nella cellula ospite (replicon) o di integrarsi al suo genoma. Il DNA del replicone interagisce con gli enzimi coinvolti nell'avvio della replicazione del DNA. Un replicone è un'unità genetica composta da un'origine di replicazione del DNA (ori) e dagli elementi di controllo ad essa associati. Si può anche definire come il più piccolo pezzo di DNA in grado di replicarsi nell'ospite mantenendo un numero stabile di copie. Nei plasmidi, un "replicone" è lungo in media 500 bp.
. Uno o più marcatori genetici, la cui presenza permetta di selezionare le cellule che ospitano il plasmide. I marcatori genetici possono essere resistenze ad antibiotici o marcatori nutrizionali.
. Singoli siti di taglio per il più alto numero possibile di enzimi di restrizione. I vettori sintetici (ingegnerizzati) più recenti presentano un unica regione (sito di policlonaggio o polylinker) che riunisce i siti di riconoscimento per gli enzimi di restrizione più comuni. Questi siti devono stare al di fuori delle regioni essenziali (replicone e marcatore).
Non è essenziale, ma può essere molto utile inserire nel vettore degli elementi di controllo dell'espressione genica. Uno dei più usati è l'operone lac che in E.coli controlla la sintesi degli enzimi necessari all'utilizzo del lattosio da parte del batterio. L'operone è formato da più geni che interagiscono. Uno di questi, il promotore Plac, attiva i geni a valle in presenza di lattosio. È dunque sufficiente inserire il gene di interesse a valle del promotore Plac per avere a disposizione un meccanismo semplice di controllo della sua espressione. In presenza di lattosio (o di molecole analoghe che non possono essere metabolizzate da E. coli) la cellula sintetizza la proteina codificata dal gene che ci interessa, mentre in assenza di lattosio il gene di interesse non si esprime. Vettori che contengono regioni per il controllo dell'espressione sono detti vettori d'espressione.
L'operone lac è anche un buon esempio di marcatore nutrizionale utilizzabile, assieme ad una resistenza ad un antibiotico, per selezionare le cellule che ospitano il plasmide ricombinante. L'operone lac contiene infatti la sequenza-bersaglio dell'enzima di restrizione e quindi se il plasmide riceve l'inserto del DNA donatore, questo si inserisce all'interno dell'operone e la funzione di digestione del lattosio viene persa.
Le cellule trasformate dal plasmide ricombinato acquistano la resistenza all'antibiotico, ma non la capacità di digerire il lattosio (infatti il gene LacZ viene interrotto dall'inserzione del DNA fagico),
le cellule che si trasformano col plasmide non ricombinato acquistano entrambe le proprietà,
le cellule che non acquistano alcun plasmide restano sensibili all'antibiotico.
I primi vettori genici individuati ed utilizzati sono stati i plasmidi.
I plasmidi sono brevi sequenze anulari di DNA batterico extracromosomiche. Tutti i batteri possiedono un unico filamento di DNA chiuso ad anello, detto cromosoma batterico. Alcuni batteri possiedono inoltre alcuni filamenti anulari più piccoli, contenenti qualche decina di geni, detti plasmidi, che sono in grado di duplicarsi indipendentemente dal cromosoma batterico.
Se sottoposti a stress ambientale (carenza alimentare, antibiotici) i batteri effettuano un processo di coniugazione, attraverso il quale una cellula donatrice (F+) trasferisce copia di uno o più plasmidi ad una cellula ricevente (F-). Durante il processo di coniugazione due batteri si uniscono attraverso un ponte citoplasmatico (pilo sessuale). Nella cellula donatrice il plasmide inizia a replicarsi a partire da un punto, detto 'sito di origine della replicazione' (ori). Il filamento di DNA che viene sostituito dal nuovo filamento penetra attraverso il pilo nella cellula ricevente.
La cellula ricevente duplica a sua volta il monofilamento ricevuto rigenerando il plasmide completo. I geni trasferiti sono successivamente integrati nel cromosoma batterico.
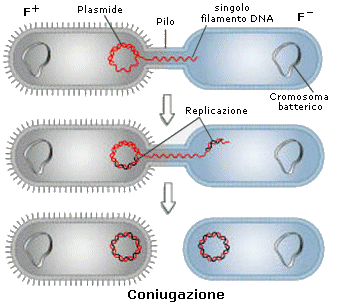
I batteri si riproducono asessualmente per mitosi. Ciò significa che gli individui di ogni nuova generazione sono geneticamente identici a quelli della generazione precedente. Questa uniformità genetica è evidentemente controproducente. La probabilità di adattarsi alle variazioni ambientali è tanto più elevata quanto maggiore è la variabilità genetica all'interno di una popolazione. I batteri risolvono questo problema tramite la coniugazione, un fenomeno attraverso il quale ricombinano il loro patrimonio genetico, creando nuova variabilità ed aumentando le probabilità di sopravvivenza.
La coniugazione batterica è un fenomeno di sessualità.
Da un punto di vista biologico infatti riproduzione e sessualità sono fenomeni diversi. La riproduzione genera nuovi individui. La sessualità genera variabilità genetica. Negli organismi superiori, dove avviene una riproduzione sessuata, i due processi avvengono contemporaneamente. La formazione dei gameti necessari alla riproduzione avviene infatti attraverso processi sessuali di rimescolamento dei caratteri genetici (crossino-over, assortimento indipendente degli omologhi) che garantisce una elevata variabilità genetica.
Per questa loro capacità di entrare in un batterio ed integrarsi con il cromosoma batterico, i plasmidi sono dei vettori ideali per inserire geni esogeni e farli esprimere ai batteri. È in questo modo, ad esempio, che per la prima volta si è riusciti a far sintetizzare a Escherichia coli insulina umana.
Tra i diversi tipi di plasmidi che i batteri sono in grado di trasferire, sono particolarmente importanti ed utilizzati nelle tecniche del DNA ricombinante i plasmidi R, che contengono geni che conferiscono al batterio la resistenza agli antibiotici. Questa caratteristica è utilizzabile per discriminare facilmente i batteri che hanno ricevuto il plasmide con il gene esogeno da quelli che non l'hanno ricevuto. È infatti sufficiente trattare la popolazione batterica con l'antibiotico di cui il plasmide porta il fattore di resistenza: solo i batteri ricombinanti ovviamente sopravviveranno. Attualmente si utilizzano plasmidi che portano geni per la resistenza alla ampicillina (amp) o alla canamicina (kan).
Per essere utilizzato come vettore genico un plasmide deve poi possedere un unico sito di attacco per l'enzima di restrizione che si vuole usare. In questo modo, trattato con l'enzima di restrizione, il plasmide si aprirà in un solo punto, dove poi si salderà il gene esogeno.
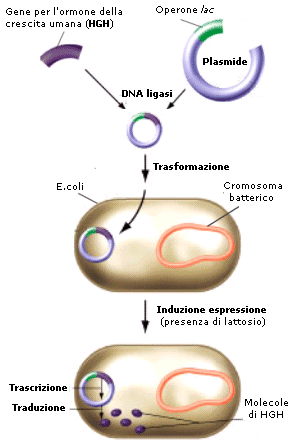
Tra tutti i vari vettori disponibili, i plasmidi hanno acquistato un posto privilegiato per la loro affidabilità e facilità di manipolazione. Semplicemente, lavorano meglio degli altri vettori se il DNA da clonare non è di grandi dimensioni
In sintesi dunque le fasi per la produzione di un plasmide ricombinante sono:
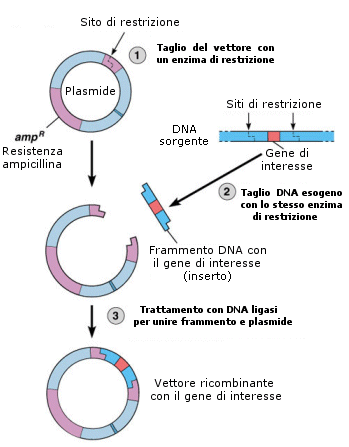
È possibile anche utilizzare plasmidi con due siti di riconoscimento per enzimi di restrizione diversi ed utilizzare gli stessi due enzimi per tagliare il frammento di DNA bersaglio da inserire. Si ottengono frammenti con estremità coesive differenti. Il vantaggio di questa strategia è che, siccome solo le estremità "sorelle" sono compatibili tra loro, l'inserto di DNA si lega al vettore in un solo modo (clonazione direzionale), permettendo di conoscere in anticipo l'orientamento dell'inserto. Inoltre il vettore tagliato con due enzimi diversi non circolarizza (non si richiude prima di aver saldato l'inserto), perché le due estremità non sono compatibili.
Il plasmide ricombinante a questo punto è pronto per essere introdotto nelle cellule batteriche. Il trasferimento di un plasmide ricombinante avviene sfruttando in genere il fenomeno della trasformazione batterica.
La trasformazione batterica è un processo naturale, attraverso il quale alcuni procarioti (detti competenti) sono in grado di ricevere del DNA esterno in grado di produrre nuove caratteristiche. Questo fenomeno fu scoperto nel 1928 da Frederick Griffith. Prima dell'avvento degli antibiotici, i pazienti affetti da polmonite venivano trattati con antisieri preparati iniettando cellule morte del batterio agente della malattia (Streptococcus pneumoniae). Il medico inglese Frederick Griffith nel tentativo di preparare antisieri più efficaci si imbatté in risultati inattesi. Streptococcus pneumoniae è un batterio la cui parete è rivestita da una spessa capsula. Gli zuccheri della capsula provocano la risposta immunitaria dell'ospite. Un sierotipo è un ceppo batterico con proprietà immunologiche particolari, che gli sono conferite dalla mistura di zuccheri della capsula. Griffith dimostrò che i batteri avirulenti, a contatto con i batteri virulenti morti, ne acquisivano sempre il sierotipo. Il processo di conversione dei batteri avirulenti innocui in cellule virulenti fu chiamato trasformazione. Gli esperimenti di Griffith hanno un'importanza storica notevole, perché portarono Osvald Avery (Columbia University, New York) ad indagare quale fosse il principio trasformante, che permetteva ai batteri avirulenti di acquistare le proprietà delle cellule morte. Nel 1944 Avery, MacLeod e McCarty dimostrarono che il principio trasformante era il DNA. La cellula ricevente assorbe dall'ambiente un frammento "nudo" di DNA rilasciato da una cellula donatrice. Tuttavia la rigida parete cellulare dei batteri è di grande ostacolo al passaggio delle macromolecole di DNA. Pochi generi di batteri (Streptococcus, Neisseria, Hemophilus) presentano lo stato di competenza alla trasformazione in modo naturale durante una fase del loro ciclo vitale, in cui riformano la parete cellulare. Questi batteri possiedono una competenza naturale alla trasformazione e non richiedono nessun trattamento particolare per indurre la loro capacità di assumere il DNA. Virtualmente, tutti i batteri hanno la capacità di assumere DNA "nudo" dall'ambiente, posto che acquistino una "competenza" alla trasformazione. La maggioranza dei batteri non è naturalmente competente alla trasformazione, per cui è necessario indurre uno stato di competenza artificiale. Oggi sono state sviluppate alcune tecniche chimiche e fisiche, per quanto molto empiriche, in grado di rendere competenti anche batteri che non lo sono naturalmente. I batteri gram-negativi diventano competenti se trattati con agenti chimici o fisici. I batteri gram-positivi non possiedono la membrana esterna propria degli organismi gram-negativi. Tuttavia l'ingresso del DNA è impedito dalla presenza di uno strato rigido esterno di mureina o peptidoglicani, che è molto più spesso del suo equivalente nei batteri gram-negativi. Questo strato deve essere preventivamente idrolizzato con lisozima, quindi i protoplasti (cioè i batteri senza parete cellulare) si possono trasformare.
Un limite all'utilizzo del plasmide come vettore è dato dalla dimensione del frammento del DNA che esso può effettivamente contenere ed al fatto che non può essere utilizzato per trasformare cellule animali. Sono stati quindi sviluppati altri sistemi vettore.
Un'importante famiglia di vettori genici è costituita dai vettori virali. I virus sono costituiti da un involucro di proteine (capside) di ridottissime dimensioni al cui interno è racchiuso il DNA virale contenente solo le informazioni essenziali e quindi non possono riprodursi da soli. Per farlo devono penetrare all'interno di una cellula ed utilizzarne le strutture di sintesi. Quando un virus infetta una cellula, integra il suo DNA con il genoma cellulare. In questo modo la cellula esprime le informazioni virali e sintetizza centinaia di copie del virus. Durante questo processo possono avvenire scambi tra il DNA virale ed il DNA cellulare. In laboratorio è possibile pilotare questo fenomeno di ricombinazione tra i due genomi, al fine di trasferire geni particolarmente interessanti nelle cellule. Per far ciò, si sostituiscono alcuni geni del virus con geni utili, di qualunque provenienza, ed un gene marcatore per verificare l'avvenuto trasferimento. Il virus modificato è ancora in grado di infettare la cellula, ma, anziché sfruttarla e distruggerla, la arricchisce delle nuove caratteristiche desiderate. Ogni virus utilizza le proteine del suo capside per riconoscere ed infettare un particolare tipo di cellula.
I vettori virali sono utilizzati soprattutto per introdurre geni esogeni nei batteri (in alternativa ai plasmidi) e nelle cellule eucarioti animali.
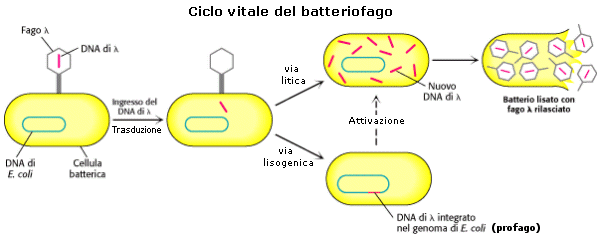
I virus che infettano i batteri sono detti batteriofagi
o fagi. Quando un fago infetta un
batterio può acquisirne frammenti di DNA che vengono ceduti alla cellula batterica
ricevente durante il successivo processo di infezione. Il trasferimento di
materiale genetico da un batterio ad un altro tramite fagi è noto come trasduzione. La trasduzione è dunque
una sorta di trasformazione batterica mediata da virus. I biologi molecolari
sfruttano dunque questa capacità dei virus per utilizzarli come vettori genici.
Alcuni fagi (Lambda ed M13) sono stati adattati alle esigenze dei biologi
molecolari che ne hanno opportunamente modificato il DNA per dotarlo di
specifici siti di restrizione ed hanno eliminato quella parte del genoma non
indispensabile per la replicazione. Il DNA
virale di un fago, una volta penetrato in una cellula batterica, può integrarsi
nel cromosoma batterico e rimanere in fase latente (profago) per molto tempo
senza interferire sulla vita della cellula (ciclo lisogenico o lisogeno) oppure può attivarsi ed utilizzare le
strutture della cellula batterica per riprodursi e distruggere la cellula
ospite (ciclo litico).
I fagi che causano la morte dei batteri per lisi cellulare sono detti virulenti (solo ciclo litico), mentre i fagi che riescono a stabilire un rapporto di simbiosi con l'ospite si dicono temperati (alternanza ciclo litico e lisogenico), come ad esempio il fago λ, ampiamente utilizzato come vettore genico. Vi sono due modalità di trasduzione. Nel corso del ciclo litico di molti virus il DNA della cellula ospite si frammenta e quando vengono assemblate le nuove particelle virali, alcuni di questi frammenti di DNA, spezzati a caso, possono essere erroneamente racchiusi all'interno del capside al posto del DNA virale (trasduzione generalizzata).
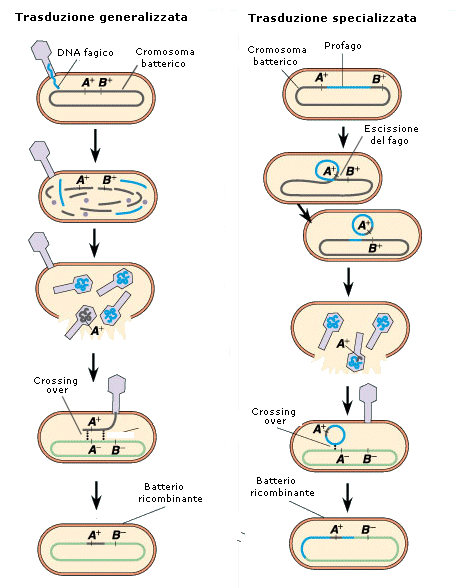
Nel corso del ciclo lisogenico il profago può staccarsi dal cromosoma batterico in cui si era integrato (escissione) portandosi via un frammento di DNA batterico ad esso adiacente (trasduzione specializzata).
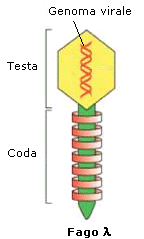 Il fago è utilizzato per
clonare frammenti di DNA lunghi fino a 25 kbp. Normalmente il genoma
del fago è lungo 49 kbp ma viene ridotto eliminando la porzione centrale con
enzimi di restrizione che lasciano estremità coesive, lo stesso enzima con cui si
taglia il frammento da clonare che vi si lega. Il profago integrato nel genoma
si libera in seguito a danni del DNA. Prolifera a spese dell'ospite e lisa la
cellula infetta liberando circa 100 virioni
Il fago è utilizzato per
clonare frammenti di DNA lunghi fino a 25 kbp. Normalmente il genoma
del fago è lungo 49 kbp ma viene ridotto eliminando la porzione centrale con
enzimi di restrizione che lasciano estremità coesive, lo stesso enzima con cui si
taglia il frammento da clonare che vi si lega. Il profago integrato nel genoma
si libera in seguito a danni del DNA. Prolifera a spese dell'ospite e lisa la
cellula infetta liberando circa 100 virioni
Il DNA del fago isolato dalle particelle virali è una molecola lineare con estremità 5'-sporgenti di 12 nucleotidi, dette terminali coesivi (cos). Le estremità cos circolarizzano subito dopo l'infezione della cellula ospite, grazie alla DNA ligasi di E. coli. Oltre ad essere importanti per la sopravvivenza di all'interno di E. coli, le estremità cos giocano un ruolo importante per l'impacchettamento del DNA nei virioni e per lo sviluppo di vettori artificiali, i cosmidi, che possono trasportare inserti di DNA di grandi dimensioni (30-45 kbp).
I cosmidi sono ibridi tra plasmidi (replicone, resistenza ad antibiotici) e le estremità cos del fago . La capacità massima degli inserti (45 kbp) è limitata dalle dimensioni della testa di
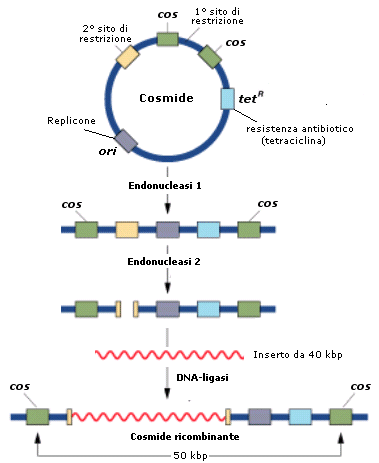
Il cosmide ricombinante viene poi impacchettato in particelle fagiche in vitro, posto che vengano forniti i precursori delle teste, le code e le proteine per il montaggio. Il cosmide ricombinante viene successivamente introdotto nel batterio per trasduzione.
I vettori navetta sono vettori ingegnerizzati compatibili con cellule diverse, ad esempio batteri/lieviti o batteri/animali. In genere è fornito di due siti di replicazione, ognuno dei quali è riconosciuto e funziona su di un ospite cellulare diverso. Un vettore di questo tipo consente ad esempio la manipolazione del vettore nelle cellule batteriche ed il successivo trasferimento nelle cellule umane dove poter effettuare le analisi di interesse.
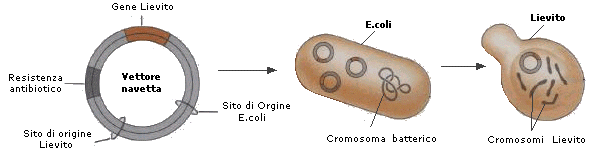
Il lievito Saccharomyces cerevisiae rappresenta per gli eucarioti ciò che E.coli è per i procarioti. S.cerevisiae possiede un plasmide naturale di 2 μm di circonferenza (Plasmide 2 μm) che può essere utilizzato come vettore genico. Questo plasmide è stato variamente manipolato per ottenere vettori artificiali di lievito. Ad esempio, l'aggiunta al plasmide di un centromero proveniente da un cromosoma del lievito stesso garantisce che, durante la divisione cellulare del lievito i plasmidi in esso inseriti vengano ripartiti equamente in tutte le cellule che si formano (il fuso riconosce il centromero e tratta i plasmidi come cromosomi).
Se oltre al centromero si aggiungono al plasmide, dopo averlo aperto, anche dei telomeri si ottiene un vettore chiamato Cromosoma artificiale di lievito (YAR).
Se questo vettore contiene le origini di replicazione del lievito (sequenze di replicazione autonome, ARS), durante la divisione cellulare si comporta come un piccolo cromosoma di lievito.
Oggi sono stati messi a punto cromosomi artificiali anche per batteri e mammiferi che contengono gli elementi genetici utili per la stabilità e la funzionalità del cromosoma (telomeri, centromeri) . Con essi è possibile utilizzare i batteri per clonare grossi pezzi di DNA (200-500 kbp).
Sono cromosomi artificiali:
YAC, cromosomi di lievito (Yeast Artificial Chromosomes)
BAC, cromosomi batterici
MAC, cromosomi di mammifero
PAC, cromosomi P1
Le cellule vegetali sono particolarmente resistenti alla trasformazione perché sono rivestite esternamente da una spessa parete cellulare. La principale tecnica di modificazione genetica di vegetali è legata all'attitudine naturale del batterio Agrobacterium tumefaciens di infettare piante e causare una crescita paragonabile a quella tumorale negli animali, formando una moltiplicazione incontrollata delle cellule infettate entro cui il batterio si può riprodurre. A. tumefaciens contiene un plasmide (plasmide Ti, Tumor inducing) che può essere trasferito all'interno della pianta infettata ed integrare nel genoma della stessa la regione T-DNA (DNA che induce il tumore). Questo gene produce la proliferazione cellulare, che ospita il batterio e ne fornisce nutrienti per la crescita.
I biologi molecolari sono in grado di creare una popolazione di Agrobacterium che abbia nel T-DNA, al posto dei geni che causano il tumore, il gene che si desidera trasferire nella pianta. Il batterio modificato viene poi utilizzato per infettare alcuni frammenti di tessuto vegetale. Le cellule che ricevono il plasmide T iniziano a dividersi producendo calli (masserelle di cellule indifferenziate) visibili ad occhio nudo. Frammentando il callo e trattandolo con una miscela calibrata di ormoni vegetali si rigenerano le pianticelle che possiedono il gene nuovo (transgeniche). Questo sistema rapido, semplice ed efficiente, funziona tuttavia solo con piante dicotiledoni (es. pisello, fava, soia, lenticchie, ecc.) e non con le monocotiledoni, famiglia che comprende i cereali e quindi molto importante dal punto di vista economico.
Per introdurre geni esogeni in piante monocotiledoni si utilizzano il metodo biobalistico o il metodo dei protoplasti.
Il metodo biobalistico (anche
detto gene gun, pistola a
geni), permette di 'sparare' ad altissima velocità microproiettili
di oro o tungsteno ricoperti di DNA all'interno delle cellule vegetali. Tale
metodo è ampiamente usato, ad esempio per la produzione del più comune cereale
OGM, il mais BT.
Con il metodo dei protoplasti le cellule vegetali sono trattate con enzimi litici (cellulasi) che sciolgono la parete cellulare, trasformando le cellule in protoplasti. Questi sono più facili da trasformare, potendo assorbire DNA nudo, soprattutto se vengono stimolati elettricamente (elettroporazione).
Gli animali possono essere geneticamente modificati in modo del tutto naturale attraverso le infezioni virali. La modificazione genetica, in ogni caso, avviene solo se il virus penetra nella cellula bersaglio, senza risposta del sistema immunitario ed il suo genoma penetra fino al nucleo di essa.
La proprietà dei virus di integrarsi con il genoma della cellula animale (provirus) sono sfruttate dai ricercatori per progettare vettori in grado di modificare in modo controllato il genoma delle cellule animali. In medicina, questa proprietà ha aperto la strada alla Terapia genica che consentirebbe di sostituire frammenti di genoma mutato nei pazienti, agendo proprio sulle cellule adulte che hanno subito mutazioni. Le mutazioni prodotte dalla terapia genica sono dunque totalmente a carico della linea somatica e non di quella germinale.
Naturalmente durante le operazioni di transgenesi alcune cellule possono non introdurre i vettori. Bisognerà perciò eseguire una selezione che dovrà eliminare le cellule che non hanno introdotto il vettore. Sarà sufficiente trattare le cellule con l'antibiotico, il cui fattore di resistenza è presente nel vettore utilizzato. Le cellule che hanno incorporato il vettore, cresceranno nel terreno contenente l'antibiotico, mentre le altre moriranno.
Se il DNA bersaglio è già stato selezionato tra i frammenti di restrizione prima di essere integrato nel vettore o si possiede già il filamento di cDNA, le tecniche di clonazione e selezione sono relativamente semplici e si parla di clonazione mirata.
In genere è sufficiente analizzare pochi cloni ricombinanti per individuare il clone giusto che contiene il DNA bersaglio.
Se invece viene isolato e frammentato con enzimi di restrizione l'intero genoma di una cellula ed i diversi frammenti ottenuti vengono integrati ognuno in un vettore e successivamente clonati (clonazione a raffica o shotgun), si ottiene una popolazione complessa di batteri ricombinanti, ciascuno dei quali contiene un inserto diverso di DNA.
L'insieme delle colonie batteriche contenenti ognuno un diverso frammento di DNA costituisce una libreria genomica o genoteca.
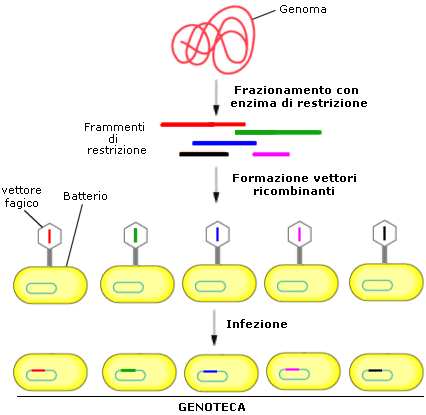
Se ora si vuole individuare all'interno della genoteca la colonia batterica che contiene un particolare frammento genico sarà necessario usare una sonda che la riconosca e ce la renda evidente. Una sonda è costituita da una breve sequenza di una ventina di basi complementare al DNA di interesse, marcata mediante l'impiego di isotopi radioattivi o di un composto fluorescente. Una sonda viene in genere costruita tramite trascrizione inversa a partire dall'mRNA con formazione di cDNA (DNA complementare) oppure, conoscendo la sequenza amminoacidica della proteina codificata dal gene che ci interessa, è possibile assemblare direttamente un breve filamento di DNA sintetico.
Il processo di appaiamento della sonda al DNA di interesse è detto ibridazione.
In generale si forma DNA ibrido quando si appaiano filamenti di DNA (o di DNA ed RNA) di provenienza diversa.
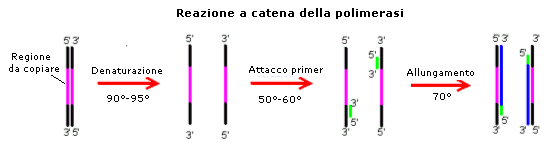
La clonazione del DNA tramite proliferazione di un batterio nel quale è stato introdotto un vettore ricombinante (plasmide o fago) contenente il segmento genico di interesse non è l'unica modalità per ottenere un numero elevato di segmenti di DNA identici (amplificazione DNA). Il metodo più rapido ed economico per ottenere molte copie di una sequenza di DNA è infatti la reazione a catena della polimerasi (PCR). Si tratta di un sistema in vitro, che non prevede cioè l'uso di cellule ed è basato sull'attività dell'enzima DNA-polimerasi. Le DNA-polimerasi sono enzimi in grado di legare in successione ordinata i nucleotidi e di costruire quindi filamenti di DNA complementari ad un primo filamento che fa da stampo. Le DNA-polimerasi utilizzate attualmente sono tutte estratte da batteri che vivono in condizioni di temperatura estreme, in modo da essere termostabili. La 'Taq-polimerasi' ad esempio, è in grado di lavorare ad alte temperature, fino anche a 92°C, temperatura alla quale avviene il processo di denaturazione del DNA. In passato questa DNA-polimerasi veniva estratta da Thermophilus aquaticus, un batterio che vive nelle acque termali calde. Attualmente viene invece prodotta in batteri geneticamente modificati per l'espressione e la sintesi dell'enzima.
La PCR prevede che il DNA venga riscaldato per dividere i due filamenti della doppia elica (denaturazione), premessa indispensabile per poterlo copiare. Se la polimerasi usata non fosse termoresistente, ad ogni ciclo si dovrebbe aggiungere nuovo enzima per sostituire quello inattivato dal calore. Il campione di DNA da amplificare viene posto in una soluzione contenente DNA polimerasi, nucleotidi (dNTP, desossinucleotidi trifosfati) e primer.
Un primer è un breve frammento di DNA a singola elica, un oligonucleotide di circa 20 basi, complementare alla porzione iniziale della sequenza di DNA che si vuole amplificare. Esso fornisce alla polimerasi un punto di innesco per la sintesi del nuovo filamento di DNA. Sono necessari due diversi primer, uno per ogni filamento, poiché dovranno posizionarsi all'estremità 3' di ogni filamento (la polimerasi allunga il nuovo filamento solo in direzione 5' → 3'). Il primer è aggiunto in grande eccesso al DNA affinché le due eliche parentali non si riappaino. La provetta con la miscela di reagenti è posta nella apparecchiatura per PCR, capace di cicli successivi di riscaldamento e raffreddamento a temperature specifiche per ogni reazione. Le fasi della PCR si possono così riassumere:
Il ciclo si ripete in genere per 20-30 volte e termina con un raffreddamento a 4°C per bloccare ogni reazione.
Ad ogni ciclo il numero di molecole aumenta esponenzialmente. Dopo n cicli si formano 2n molecole di DNA.
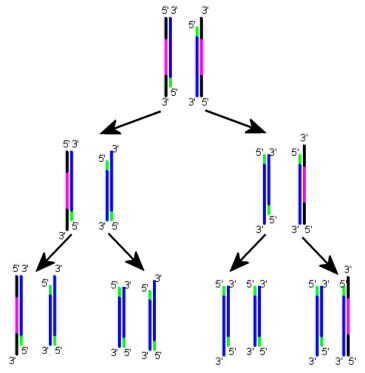
La PCR risulta più rapida rispetto alla clonazione in vivo del DNA, ma a differenza di questa necessita della conoscenza delle sequenze nucleotidiche di ciascuna estremità del segmento di DNA che si vuole copiare.
I siti di restrizione sono localizzati in punti differenti nel genoma di ogni individuo. Gli enzimi di restrizione tagliano perciò il DNA, producendo dei frammenti di restrizione che presentano lunghezze variabili da individuo ad individuo. Questa diversa distribuzione di frequenza della lunghezza dei frammenti in ciascun individuo è nota come polimorfismo della lunghezza dei frammenti di restrizione (RFLP Restriction Fragments Length Polymorphism). Si chiamano infatti polimorfismi le differenze ereditarie che si trovano tra gli individui in una popolazione.
Questa caratteristica può essere utilizzata per distinguere il DNA di un individuo da quello di qualsiasi altro. La distribuzione di frequenza delle lunghezze dei frammenti di restrizione è infatti caratteristica di ogni genoma.
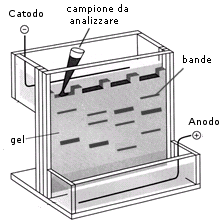
Per separare i frammenti di diversa lunghezza e visualizzarne la distribuzione di frequenza si usano tecniche di elettroforesi.
L'elettroforesi è un metodo di separazione basato sulla diversa velocità di migrazione di particelle elettricamente cariche, depositate su di un opportuno supporto (carta o gel) se sottoposte ad un campo elettrico. L'elettroforesi è ad esempio impiegata nei comuni esami di laboratorio per quantificare le diverse classi di proteine del sangue.
Nel caso dei frammenti di restrizione, questi vengono depositati all'estremità di una lastra di gel. Poiché gli acidi nucleici hanno cariche negative, i frammenti migreranno verso il polo positivo. La velocità di migrazione dei frammenti di DNA è inversamente proporzionale al logaritmo della loro lunghezza. Al termine della corsa elettroforetica, DNA di lunghezza diversa sono risolti in bande di diverso peso molecolare (una sorta di codice a barre), che si possono visualizzare con sonde radioattive o fluorescenti.
In origine la tecnica RFLP fu messa a punto e viene ancora utilizzata per evidenziare un polimorfismo consistente nella presenza o assenza di un sito di restrizione, dovuto a mutazioni che vanno a colpire il sito di restrizione stesso facendolo scomparire se esiste, o creandone uno nuovo. Ad esempio, se l'allele di un difetto genetico genera rispetto a quello sano frammenti di restrizione diversi, è possibile usare questa tecnica per evidenziarne la presenza in un genoma.
Oggi però il termine ha acquisito un significato più ampio, poiché sono stati evidenziati dei tratti di DNA in cui, pur non essendovi mutazioni nei siti di restrizione, vi sono tuttavia polimorfismi di lunghezza dei frammenti.
Queste regioni altamente polimorfiche del genoma umano possono essere utilizzate per confrontare due campioni di DNA e verificare se provengono dal medesimo individuo (test legali e giudiziari in casi di delitti) o da individui imparentati (test di paternità)
L'impiego di enzimi di restrizione su DNA appartenenti a individui diversi determina infatti miscele di sequenze di DNA di lunghezze diverse e quindi tracciati elettroforetici diversi. Si parla di impronte digitali genetiche o DNA fingerprinting. L'analisi del DNA ricavato da sangue o altri tessuti consente di dirimere questioni legali, consentendo di attribuire ad una persona campioni biologici quali sangue, pelle, sperma, capelli e così via.
Nell'uomo, le regioni del DNA usate comunemente per ottenere il profilo genetico di un individuo si trovano su cromosomi 1, 2, 4, 5, 10 e 17 e sono costituite da regioni ripetitive o DNA in tandem o STR (Short Tandem Repeats) (microsatelliti e minisatelliti). Per sequenze ripetute in tandem si intende una stessa sequenza ripetuta molte volte di seguito, per esempio: ATGCC ATGCC ATGCC ATGCC , dove ATGCC è ripetuta in tandem quattro volte.
Si tratta di regioni altamente polimorfiche in lunghezza e amplificabili a partire da primer di circa 20 bp tramite PCR.
I microsatelliti consistono in sequenze ripetute in tandem in cui la sequenza ripetuta ha una lunghezza da 2 a 6 paia di basi, mentre nei minisatelliti l'unità ripetuta è composta da 10 a 200 paia di basi.
Dato che si conosce la sequenza amplificata e la natura della ripetizione, dalla lunghezza del frammento amplificato si può dedurre quante ripetizioni esso contenga, e quindi di quale variante si tratti.
Ciò che si confronta tra due campioni, sono le bande visibili su un gel e corrispondenti al frammento di restrizione marcato con una sonda radioattiva o luminescente.

Molte persone, specialmente in Europa, considerano gli OGM un potenziale pericolo per l'ambiente e per la salute, sebbene esistano ormai migliaia di studi sulla loro sicurezza e non siano emersi dati significativi da un punto di vista scientifico.
Il primo OGM fu ottenuto nel 1973 da Stanley Cohen e Herbert Boyer (inserimento in E.coli del gene per la resistenza all'antibiotico canamicina prelevato da Staphylococcus aureus).
L'anno dopo la comunità scientifica si autoimpose una moratoria internazionale sull'uso della tecnica del DNA ricombinante. Questo permise di valutare lo stato della nuova tecnologia ed i possibili rischi, attraverso un approccio precauzionale. La conferenza che raccolse i risultati ottenuti si tenne ad Asilomar in California e concluse che gli esperimenti sul DNA ricombinante potessero procedere a patto che rispettassero severe linee guida, poi redatte dal National Institute of Health (NIH) ed accettate dalla comunità scientifica.
Queste linee guida sono tuttora la base che ispira tutte le ricerche di laboratorio che riguardano esperimenti di trasformazione genica e le normative che presiedono all'uso commerciale ed al rilascio ambientali di tali organismi nell'ottica di consentire l'utilizzo solo di varietà e animali che siano stati riconosciuti sicuri per l'ambiente e per il consumo umano e animale.
Ad oltre 30 anni dalla Conferenza di Asilomar la tecnica del DNA ricombinante ha mostrato più benefici che rischi. Ad oggi infatti non è noto alcun problema specifico legato ad essa.
Nonostante ciò in gran parte dell'opinione pubblica sono diffusi i timori che la manipolazione del genoma possa comportare delle conseguenze non previste, sia rispetto alla modificazione dell'alimento (e quindi alle conseguenze sulla salute umana) sia rispetto all'interazione con le altre specie viventi e quindi alle conseguenze sull'ambiente.
Contro la produzione e l'introduzione degli OGM viene normalmente invocato il cosiddetto principio di precauzione.
Il principio di precauzione trova la sua prima formulazione ufficiale nella "Dichiarazione di Rio", durante la Conferenza sull'Ambiente e lo Sviluppo delle Nazioni Unite del 1992, che all'articolo 15 recita:
«Ove vi siano minacce di danno serio o irreversibile, l'assenza di certezze scientifiche non deve essere usata come ragione per impedire che si adottino efficaci misure di prevenzione della degradazione ambientale»
Successivamente l'Unione Europea, nel recepire queste indicazioni nella sua normativa, ne ha allargato il campo di applicazione alla politica di tutela dei consumatori, della salute umana, animale e vegetale, ribadendo che «Il ricorso al principio di precauzione trova applicazione qualora i dati scientifici siano insufficienti, inconcludenti o incerti e la valutazione scientifica indichi che possibili effetti possano essere inaccettabili e incoerenti con l'elevato livello di protezione prescelto dall'Unione europea»
La formulazione del principio di precauzione è tuttavia talmente ambigua e generica da consentire interpretazioni diverse ed opposte. Si tratta infatti di capire cosa debba intendersi per "assenza di certezze scientifiche" e per "efficaci misure di prevenzione".
Nella sua applicazione più integralista al problema della tecnologia del DNA ricombinante, il principio di precauzione afferma che, poiché non esistono dati scientifici sufficienti ad affermare con certezza che gli OGM non sono dannosi per l'uomo e per l'ambiente, gli OGM non devono essere autorizzati. In altre parole si afferma che una mancanza di prove di dannosità non è sufficiente a garantire la non dannosità ('l'assenza di prove non è prova di assenza' disse Carl Sagan).
A ben guardare viene qui ribaltato uno dei cardini del diritto. La norma che recita "innocente fino a prova contraria" viene sostituita da "colpevole fino a prova contraria".
Il problema è che la scienza, per sua natura, non è in grado di fornire risposte certe e questa "incertezza" risulta particolarmente pesante quando si tratta di descrivere e prevedere il comportamento di sistemi altamente complessi ed interagenti come sono appunto gli ecosistemi.
In questa situazione è ovviamente difficile capire quando si possa affermare di avere una quantità di dati sufficiente per esprimere un giudizio ponderato su una specifica tecnologia. In realtà, tutti i giorni si prendono decisioni, o si scelgono opzioni, in base a una ragionevole valutazione del rapporto rischi/benefici, dando un peso e un valore ai dati a seconda delle priorità definite dalle normative esistenti. Se si dovesse prendere una decisione solo sulla base della prova assoluta di assenza di rischio, qualsiasi società si bloccherebbe nel suo sviluppo tecnologico e sociale. Non esiste infatti azione umana che non comporti, in potenza, qualche rischio. L'applicazione del principio di precauzione risulta invece ragionevole quando viene applicato al fine di escludere la presenza, per le nuove tecnologie, di problemi potenzialmente maggiori rispetto a quelli esistenti per le tecnologie o prodotti che si intendono sostituire.
È inoltre da sottolineare che non esistono tecnologie, anche semplici, che non comportino possibili effetti collaterali, per cui il rischio zero non può essere usato come parametro di valutazione in quanto impossibile da accertare.
L'assenza di "certezze scientifiche" non significa comunque che, compatibilmente con lo stato attuale delle conoscenze, non sia possibile dare delle risposte a molti dubbi e timori che accompagnano l'introduzione degli OGM. È ovvio che se le nostre conoscenze in futuro si modificheranno, potranno di conseguenza modificarsi anche le nostre valutazioni su questa tecnologia.
Tra le varie fonti di preoccupazione le più frequenti riguardano la possibilità che gli OGM
si comportino come specie invasive (superinfestanti), che si affermano nell'ecosistema a danno di altre specie e varietà,
riducano la biodiversità.
inducano resistenza agli antibiotici in microrganismi patogeni per l'uomo,
modifichino il patrimonio genetico di chi se ne alimenta
contaminino prodotti non-GM
siano pratiche contro natura
siano tossici o allergenici e quindi pericolosi per la salute
Vediamo le risposte che la scienza può dare
Le biotecnologie sono contro natura?
Dal dibattito sulle biotecnologie emerge spesso una condanna morale di questa tecnologia. La modifica diretta del DNA ha dato a molti l'impressione di violare un limite imposto dalla natura. Gli OGM sarebbero "contro natura".
In realtà, la modifica del DNA degli organismi viventi a opera dell'uomo, ha origini antiche e coincide con la nascita stessa dell'agricoltura e della domesticazione di piante e animali. L'intervento umano è stato tanto rilevante da rendere la maggior parte delle piante coltivate e degli animali completamente inadatti a vivere negli ecosistemi naturali. Alcune di queste piante sono state modificate in modo così significativo da presentare una bassissima fertilità che ne limita la dispersione nell'ambiente (le banane coltivate vengono riprodotte esclusivamente tramite talea in quanto prive di semi). Alcune specie sono state incrociate con altre molto distanti geneticamente per trasferire geni utili. La segale è stata incrociata con il frumento per ottenere il triticale, un cereale che non esiste in natura. In questo contesto, se gli OGM sono da considerare innaturali, lo sono anche l'agricoltura e l'allevamento che nei secoli hanno invaso habitat prima dominati da specie selvatiche, rimpiazzandole con pochissime specie coltivate, frequentemente importate da altri continenti. Va aggiunto inoltre che le modifiche introdotte dall'uomo nel genoma di specie utili sono state per lo più casuali e inconsapevoli, con effetti sulla pianta, sull'ambiente e sull'uomo largamente non prevedibili e non ancora studiati, ma comunque considerati "normali".
Le nuove tecnologie, mimando processi che avvengono già in natura (è possibile infatti ritrovare le tracce del trasferimento di DNA da batteri a piante e viceversa, così come in altri organismi), permettono modifiche mirate del DNA, entro certi limiti prevedibili e controllabili.
Gli alimenti GM possono modificare il DNA di chi se ne ciba?
Una persona ingerisce circa un grammo di DNA al giorno tramite l'alimentazione. A contatto con i tessuti dello stomaco il DNA viene ridotto in piccoli frammenti (in genere minori di 400 paia di basi). In alcuni esperimenti su ratto si è osservato come una piccola parte del DNA così frammentato (inferiore allo 0,1%) può essere assorbita dalle cellule dell'intestino e rimanere per qualche ora, prima di essere degradata, nel sangue o nel fegato, senza comportare conseguenze. In ogni caso il DNA transgenico non è chimicamente differente dal DNA non-transgenico. Se ne deduce che se potesse integrarsi al DNA umano, modificandolo, potrebbe farlo anche il DNA contenuto in qualsiasi altro alimento.
Gli OGM sono dannosi (tossici o allergenici) per la salute umana o animale?
Gli OGM, prima di ricevere l'autorizzazione alla coltivazione e alla commercializzazione, devono superare un elevato numero di test di sicurezza. I test richiesti partono dallo studio della nuova proteina prodotta dalla pianta transgenica. Il DNA inserito (transgene) si "esprime", infatti, tramite la produzione di una proteina, responsabile della caratteristica desiderata (ad es. resistenza agli insetti, tolleranza a un erbicida, maggior contenuto di vitamina, ecc.).
Se i test danno esito negativo, cioè se la proteina non è tossica o allergenica, si passa a valutare la "sostanziale equivalenza" della pianta transgenica nei confronti di piante analoghe non transgeniche. La sostanziale equivalenza richiede test nutrizionali condotti su animali. Se da questa analisi non emergono differenze significative il nuovo OGM viene considerato "sostanzialmente equivalente" alle varietà convenzionali. Va aggiunto anche che i prodotti autorizzati vengono monitorati per almeno 3 anni negli Stati Uniti e per tutta la durata dell'autorizzazione nell'Unione Europea, al fine di riscontrare eventuali effetti indesiderati sulla salute o sull'ambiente.
Gli OGM possono diffondere resistenze agli antibiotici rendendo più difficile la cura delle malattie?
Alcuni OGM in commercio, oltre al gene di interesse, contengono un gene che conferisce la resistenza a un antibiotico. L'uso del marcatore di resistenza è necessario per verificare che il trasferimento genico sia avvenuto correttamente. Il 90% delle varietà transgeniche autorizzate hanno il gene che conferisce resistenza alla kanamicina. Il restante 10% è resistente ad altri due antibiotici: ampicillina e igromicina. Questi tre geni di resistenza sono comunque molto diffusi tra i microrganismi presenti naturalmente nei suoli. Inoltre, kanamicina e igromicina non sono utilizzati in medicina, a causa della loro tossicità. Per l'ampicillina la situazione è diversa: questo antibiotico è ancora utilizzato, sebbene il suo impiego sia in declino a causa della diffuse resistenze naturali (più del 50% degli enterobatteri è resistente a questo antibiotico). La probabilità quindi che un agente patogeno per l'uomo acquisisca il gene di resistenza dai batteri già presenti nell'intestino o nel suolo è di gran lunga superiore alla probabilità di acquisirlo da alimenti ricavati da piante transgeniche. Anche nel caso in cui questo trasferimento dovesse avvenire, non si tratterebbe comunque di resistenze ad antibiotici utilizzati comunemente in terapia. In ogni caso, la normativa europea ha stabilito che a partire dal 2006 non saranno più autorizzati OGM che contengano geni di resistenza agli antibiotici utilizzati in terapia.
Cos'è la "contaminazione" genetica?
È diventato uso comune parlare di "contaminazione" genetica quando vengono ritrovate tracce di OGM in sementi o prodotti non-GM. Il termine è fuorviante, perché suggerisce un'intrinseca pericolosità dei prodotti GM, non tenendo conto che gli OGM non possono essere commercializzati se non sono stati riconosciuti sicuri. Al fine di evitare fraintendimenti, sarebbe quindi più appropriato parlare di "presenza accidentale" di OGM in lotti di semi non OGM o in prodotti non OGM. Si è finora riscontrato che la presenza accidentale di OGM in prodotti non OGM è inferiore allo 0,1%, percentuale molto più bassa rispetto alle soglie normalmente tollerate in agricoltura per la presenza di varietà tossiche (come la colza HEAR - 2%). Pertanto, trattandosi di organismi di cui è stata verificata la non dannosità, non dovrebbero generare alcuna problematica aggiuntiva.
Le piante GM possono diventare infestanti?
Il presupposto per la comparsa di nuove piante infestanti è che una pianta acquisisca resistenza a insetti e malattie o che si modifichi fino a presentare una serie di nuovi caratteri di invasività (ovvero la capacità di diffondersi autonomamente anche fuori dal campo coltivato)
per mutazione spontanea o per ibridazione con altre piante selvatiche o coltivate.
Gli OGM, da quanto emerso dagli studi fino ad oggi pubblicati, non sono di per sé più infestanti delle colture convenzionali. Le piante coltivate infatti necessitano per sopravvivere di cure costanti (devono essere seminate, protette dalle malattie e dagli agenti avversi) e non disperdono il seme quando mature, come invece accade per le piante selvatiche ed infestanti.
È inoltre provato che quando vengono disperse nell'ambiente naturale tendono a scomparire in 2-3 generazioni (come dimostrato per mais, colza, patata e bietola. Gli ibridi ottenuti dall'incrocio tra una pianta selvatica (infestante o meno) e una pianta coltivata sono spesso poco vitali e possiedono una bassa fertilità. Nei casi in cui gli ibridi siano fertili e acquisiscano resistenze a malattie o ad altre avversità ambientali, essi potrebbero acquisire una maggiore invasività. Il rischio connesso è però il medesimo sia per le piante GM, sia per le piante non-GM. Un esempio spesso citato riguarda la resistenza agli erbicidi. L'eventuale ibridazione tra varietà resistenti (coltivate) e non resistenti (selvatiche o coltivate) potrebbe portare, infatti, alla creazione di piante infestanti resistenti all'erbicida, costringendo l'agricoltore a usare nuovi prodotti per il loro controllo.
Quale impatto hanno gli OGM sulla biodiversità?
L'impatto degli OGM sulla biodiversità è un tema complesso. Qualunque tipo di intervento umano o anche semplici eventi naturali hanno un impatto sulla biodiversità.
Da quando l'agricoltura esiste (circa 12-13.000 anni) l'uomo ha condotto scelte o selezioni tra i genotipi delle specie da lui ritenute interessanti. Il problema della riduzione della biodiversità non è quindi nuovo. La ricerca di piante ad alta produttività, per esempio, ha ridotto radicalmente il numero di specie utilizzate a scopo alimentare. Attualmente 20 specie vegetali forniscono il 90% del cibo umano e quattro di esse arrivano da sole al 50% (frumento, mais, riso e patata). Questo processo non viene necessariamente amplificato dagli OGM.
L'ecosistema agricolo è stato inoltre profondamente modificato dall'introduzione di coltivazioni esotiche. Colture originariamente tipiche dell'America, come mais, patata e pomodoro, o dell'Asia, come soia, riso e kiwi, sono diffuse anche nell'ambiente europeo. Inoltre, con l'introduzione di specie in territori diversi da quelli nativi è stata spesso introdotta anche la flora selvatica affine a tale specie, immettendo così nell'ambiente anche le potenziali infestanti (e spesso anche i relativi parassiti). La coltivazione della soia, ad esempio, richiede dei Rizobi, batteri del terreno necessari al suo sviluppo, ma poco ancora oggi si conosce sull'impatto, a livello di biodiversità del suolo, dello spargimento di tali batteri.
Chiedersi se gli OGM siano una minaccia per la biodiversità ha poco senso. Più corretto sarebbe infatti domandarsi se questi organismi influiscono sulla biodiversità in modo diverso rispetto a quanto accade per le colture convenzionali.
Ma valutare l'impatto sulla biodiversità dell'introduzione di una nuova varietà (GM o meno) in agricoltura è comunque estremamente difficile, trattandosi di sistemi altamente complessi.
Da una parte, ad esempio, vi è la possibilità che geni di varietà commerciali (GM o meno) possano entrare a far parte del DNA di specie sessualmente compatibili. Questo fenomeno naturale può in teoria portare ad una diminuzione di biodiversità se vengono trasferiti agli ecosistemi naturali geni in grado di aumentare la competitività di questi ibridi a scapito di specie selvatiche. Dall'altra parte dobbiamo considerare che la mancanza di scambio genico è per altri versi pericolosa per la biodiversità. In definitiva, non ci sono ragioni per ritenere che la diffusione di colture OGM debba essere considerata potenzialmente più dannosa, per la biodiversità, dell'introduzione di colture "tradizionali".
Problemi etici
Naturalmente le tecniche del DNA ricombinante hanno sollevato anche numerosi problemi etici, come ad esempio i dubbi sulla liceità della manipolazione dei geni umani e della loro introduzione in altri organismi e/o dell'introduzione di geni estranei in cellule e organismi umani (es. per terapie geniche). Ovviamente su questi aspetti la scienza non ha e non può avere risposte.
 |
| Appunti su: ingegneria genetica, lievito ingegnerizzato per produrre vitamine contaminati prodotti tossici, plasmide ricombinante, i plasmidi, riassunto sull ingegneria genetica nel diritto, |
|
| Appunti Biologia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Geografia |  |