 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2395 | Gradito: |
Leggi anche appunti:Idrolisi acida di un catione metallicoIdrolisi acida di un catione metallico I cationi dei metalli (in modo particolare Strategia di bilanciamento delle reazioni redox in forma molecolareStrategia di bilanciamento delle reazioni redox in forma molecolare Prima Il gatto di Schrödinger ed il principio di sovrapposizione degli statiIl gatto di Schrödinger ed il principio di sovrapposizione degli stati In |
 |
 |
Il legame covalente si forma tra atomi che presentano alta affinità elettronica e quindi tipicamente tra atomi non metallici.
Se il legame unisce atomi di un medesimo elemento, il legame si definisce covalente puro o covalente omeopolare.
Se il legame unisce atomi di elementi diversi, il legame si definisce covalente polare o covalente eteropolare.
La natura del legame covalente venne suggerita per la prima volta da G. Lewis, dell'università della California nel 1916.
Lewis attribuì l'inerzia chimica dei gas nobili al fatto di possedere 8 elettroni superficiali e avanzò quindi l'ipotesi che gli elementi che non presentavano la stessa configurazione elettronica esterna, tendessero a raggiungerla mediante la condivisione dei loro elettroni superficiali spaiati, al fine di raggiungere in tal modo una configurazione più stabile (regola dell'ottetto).
Prendiamo ad esempio due atomi di cloro, rappresentandoli mediante le loro strutture di Lewis. Essi hanno entrambi una configurazione 3s2 3p5, con un elettrone spaiato sull'ultimo orbitale p ed una forte tendenza ad acquistare un ulteriore elettrone (elevata affinità elettronica) per raggiungere la configurazione stabile del gas nobile successivo ( l'argon).
Possiamo pensare che entrambi i nuclei attirino fortemente l'elettrone spaiato dell'altro atomo senza peraltro riuscire a strapparlo.
Il risultato di questa intensa attrazione incrociata è che i due elettroni spaiati vengono alla fine condivisi da entrambi gli atomi ed il doppietto elettronico funge da legame, finendo per appartenere ad entrambi gli atomi.
I due atomi di Cloro "condividono" una coppia di elettroni e tale "condivisione" costituisce il legame covalente. In questo modo ora i due elettroni non appartengono più all'uno o all'altro atomo, ma ruotano entrambi intorno all'intera struttura molecolare biatomica.
Si dice che i due elettroni sono stati messi in comune o in compartecipazione.
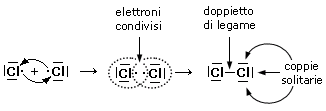
Ciascun nucleo 'vede' ora intorno a sè i 6 elettroni non condivisi più i 2 elettroni condivisi per un totale di 8 elettroni. La condivisione di una coppia di elettroni permette a ciascun atomo di Cloro di raggiungere la configurazione stabile dell'ottetto.
Il legame che si forma per condivisione di una coppia di elettroni è detto legame covalente semplice o singolo e può essere rappresentato mediante una barretta che unisce i due simboli chimici. Gli atomi che formano la molecola di Cl2 sono quindi tenuti insieme da un legame covalente semplice
Cl - Cl
Le coppie di elettroni superficiali che non vengono condivise sono dette coppie (o doppietti) di non-legame o coppie solitarie (Lone Pairs).
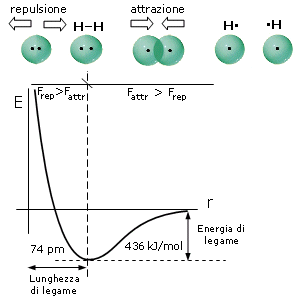
Come abbiamo già detto, durante il processo di formazione del legame si esercitano tra i due atomi sia forze attrattive (elettroni-nuclei) che forze repulsive (tra i nuclei, ma soprattutto tra i gusci elettronici). Le forze attrattive prevalgono a distanze maggiori, consentendo in questo modo ai due atomi di avvicinarsi e legarsi, mentre le forze repulsive diventano importanti e significative a corto raggio. L'energia potenziale del sistema (convenzionalmente posta uguale a zero quando i due atomi si trovano idealmente a distanza infinita) diminuisce man mano che le forze attrattive costringono i due atomi ad avvicinarsi.
Via via che i due atomi si avvicinano sia le forze attrattive che quelle repulsive diventano progressivamente più intense. Tuttavia, poiché le forze repulsive aumentano più rapidamente di quelle attrattive, si arriverà ad una distanza critica 8distanza di legame) in corrispondenza della quale le due forze risulteranno perfettamente uguali, l'energia potenziale raggiungerà il suo valore minimo ed il sistema sarà in equilibrio. Ogni ulteriore avvicinamento degli atomi causerà un aumento delle forze repulsive maggiore di quelle attrattive con conseguente tendenza del sistema a ritornare alla distanza di equilibrio.
Si tenga presente che la pendenza della curva dell'energia potenziale, rappresenta la forza netta (attrattiva + repulsiva) che agisce sugli atomi.
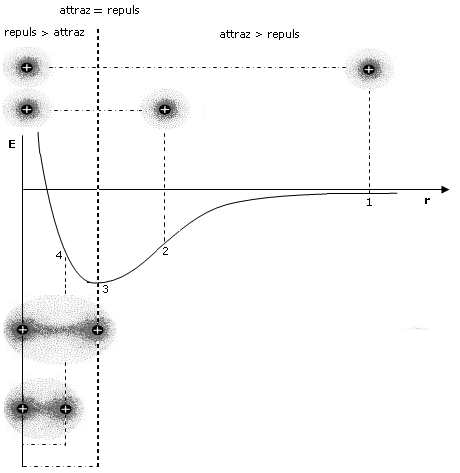
A grandi distanze (punto 1 del grafico) la curva dell'energia potenziale presenta piccole pendenze positive che corrispondono a deboli forze nette attrattive. Via via che gli atomi si avvicinano la pendenza della curva aumenta fino a raggiungere un valore massimo (punto 2 del grafico) in corrispondenza del quale le forze repulsive iniziano a crescere più rapidamente di quelle attrattive e la forza netta di attrazione inizia a diminuire. Alla distanza di legame (punto 3 del grafico) l'energia potenziale raggiunge il suo valore minimo e la forza netta è pari a zero (pendenza nulla e forze attrattive pari a quelle repulsive). A distanze inferiori (punto 4 del grafico) la curva dell'energia potenziale presenta pendenze negative crescenti che corrispondono ad intense forze repulsive nette.
Si può dunque dimostrare che, quando due atomi si avvicinano in risposta all'attrazione che ciascun nucleo esercita sull'elettrone spaiato dell'altro atomo, esiste una distanza critica in corrispondenza della quale la forza di attrazione viene esattamente bilanciata dalla repulsione che si produce tra i gusci elettronici negativi. Per distanze inferiori prevale la repulsione, per distanze maggiori prevale l'attrazione. Un modello semplice ed intuitivo, che descrive il fenomeno, rappresenta il legame come una molla che unisce i due atomi. Se si cerca di separarli la molla li richiama, se si cerca di avvicinarli troppo la molla li respinge, alla distanza di legame la molla non è in tensione.
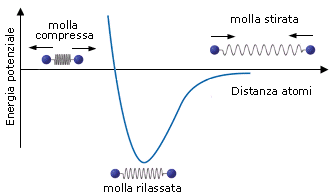
In corrispondenza della distanza di equilibrio viene quindi resa minima l'energia potenziale del sistema. Tale distanza corrisponde alla lunghezza di legame, parametro solitamente misurato in Ǻngström (1Ǻ = 10-10 m) o in picometri (1 pm = 10-12 m).
L'energia di legame, misurata in Kcal/mol (o in kJ/mol), è l'energia che si libera quando due atomi allo stato gassoso passano da distanza infinita alla distanza di legame ed ovviamente coincide con l'energia che è necessario fornire al sistema (allo stato gassoso) per rompere il legame, portando i due atomi a distanza infinita.
X-X(g) + Eleg (kcal/mol) → X.(g) + X.(g)
L'energia di legame è una misura della "forza" di un legame chimico (maggiore è l'energia di legame, più "forte" è un legame) e per questo motivo viene a volte impropriamente detta forza di legame.
Si consideri ad esempio la formazione del legame covalente in una molecola di H2.
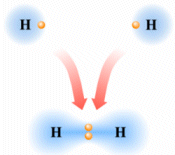
Due atomi di idrogeno condividono il loro unico elettrone per raggiungere la configurazione stabile dell'Elio.
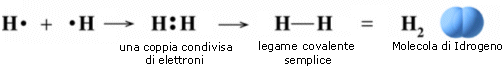
Nello schema successivo è rappresentato l'andamento dell'energia potenziale durante la formazione del legame.
|
Energia E (in kJ/mol) e Lunghezza L (in pm) di legame |
||||||||||||||||||
|
|
E |
L |
|
|
E |
L |
|
|
E |
L |
|
|
E |
L |
|
|
E |
L |
|
H-H |
|
|
N-Cl |
|
|
C-Pb |
|
|
Ge-Ge |
|
|
S-S (S8) |
|
|
||||
|
H-B |
|
|
P-P |
|
|
C-N |
|
|
Ge-N |
|
|
S=S |
|
|
||||
|
H-C |
|
|
P-O |
|
|
C=N |
|
|
Ge-F |
|
|
S-F |
|
|
||||
|
H-Si |
|
|
P=O |
|
|
C≡N |
|
|
Ge-Cl |
|
|
S-Cl |
|
|
||||
|
H-Ge |
|
|
P=S |
|
|
C-P |
|
|
Ge-Br |
|
|
Se-Se |
|
|
||||
|
H-Sn |
|
|
P-F |
|
|
C-O |
|
|
Ge-I |
|
|
Se=Se |
|
|
||||
|
H-N |
|
|
P-Cl |
|
|
C=O |
|
|
Sn-F |
|
|
F-F |
|
|
||||
|
H-P |
|
|
P-Br |
|
|
C≡O |
|
|
Sn-Cl |
|
|
Cl-Cl |
|
|
||||
|
H-As |
|
|
P-I |
|
|
C-B |
|
|
Sn-Br |
|
|
Br-Br |
|
|
||||
|
H-O |
|
|
As-As |
|
|
C-S |
|
|
Sn-I |
|
|
I-I |
|
|
||||
|
H-S |
|
|
As-O |
|
|
C=S |
|
|
Pb-F |
|
|
At-At |
|
|
||||
|
H-Se |
|
|
As-F |
|
|
C-F |
|
|
Pb-Cl |
|
|
I-O |
|
|
||||
|
H-Te |
|
|
As-Cl |
|
|
C-Cl |
|
|
Pb-Br |
|
|
I-F |
|
|
||||
|
H-F |
|
|
As-Br |
|
|
C-Br |
|
|
Pb-I |
|
|
I-Cl |
|
|
||||
|
H-Cl |
|
|
As-I |
|
|
C-I |
|
|
B-B |
|
|
I-Br |
|
|
||||
|
H-Br |
|
|
Sb-Sb |
|
|
Si-Si |
|
|
B-O |
|
|
Xe-O |
|
|
||||
|
H-I |
|
|
Sb-F |
|
|
Si-N |
|
|
B-F |
|
|
Xe-F |
|
|
||||
|
N-N |
|
|
C-C |
|
|
Si-O |
|
|
B-Cl |
|
|
|
|
|
||||
|
N=N |
|
|
C=C |
|
|
Si-S |
|
|
B-Br |
|
|
|
|
|
||||
|
N≡N |
|
|
C≡C |
|
|
Si-F |
|
|
O-O |
|
|
|
|
|
||||
|
N-O |
|
|
C-Si |
|
|
Si-Cl |
|
|
O=O |
|
|
|
|
|
||||
|
N=O |
|
|
C-Ge |
|
|
Si-Br |
|
|
O-F |
|
|
|
|
|
||||
|
N-F |
|
|
C-Sn |
|
|
Si-I |
|
|
S=O |
|
|
|
|
|
||||
Nella formazione di un legame covalente possono essere condivise anche più di una coppia di elettroni. E' il caso ad esempio delle molecole dell'ossigeno e dell'azoto.
L'ossigeno presenta 6 elettroni nell'ultimo livello con una configurazione elettronica superficiale 2s2 2p4, con due elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di ossigeno condivide dunque 2 elettroni. Ciascun atomo di ossigeno ora 'vede' intorno a sè 8 elettroni nel suo livello energetico più superficiale.
![]()
La molecola di O2 è quindi tenuta insieme da un legame covalente doppio. che può essere rappresentato con due trattini posti tra i simboli chimici dei due atomi (O = O)
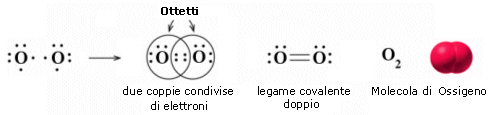
Un legame doppio è più corto e più forte di un legame semplice.
Nel caso dell'azoto la configurazione elettronica superficiale è del tipo 2s2 2p3, con tre elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di Azoto deve dunque condividere 3 elettroni
![]()
Il legame che si forma e che tiene uniti gli atomi di Azoto in N2 è un legame covalente triplo che può essere rappresentato con tre trattini posti tra i simboli chimici dei due atomi (N N).
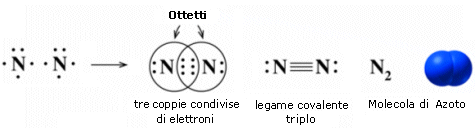
Un legame triplo è più corto e più forte di un legame doppio.
Riassumendo
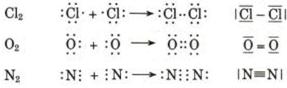
Il numero di doppietti elettronici condivisi che tiene uniti due atomi è detto ordine di legame. Un legame singolo presenta ordine = 1, un legame doppio ordine = 2, un legame triplo ordine = 3.
La lunghezza del legame decresce all'aumentare dell'ordine di legame (un legame doppio è più corto di uno semplice ed uno triplo è più corto di uno doppio).
L'energia di legame aumenta all'aumentare dell'ordine di legame (un legame doppio è più forte di un legame semplice ed un legame triplo è più forte di un legame doppio).
Mentre i legami semplici permettono la libera rotazione degli atomi intorno all'asse di legame, i legami doppi e tripli non permettono rotazioni.
 |
| Appunti su: Teoria di lewis e puntini, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |