 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 10879 | Gradito: |
Leggi anche appunti:GlicolisiGLICOLISI La Glicolisi ( o ciclo degli esosi in quanto si IdrogenoIDROGENO Chimica 2 Idrogeno L'idrogeno era conosciuto sotto il Sintesi di CoCl2(N,N'-C12H6N2O2)Sintesi di CoCl2(N,N'-C12H6N2O2) Partendo dai risultati ottenuti per il complesso |
 |
 |
G.Lewis introdusse il concetto di attività nel 1907 per descrivere quelle concentrazioni attive, o efficaci, che compaiono nelle relazioni di equilibrio al posto delle concentrazioni vere e proprie.
Abbiamo visto che la legge di Guldberg-Waage descrive un generico equilibrio del tipo
aA + bB ![]() cC + dD
cC + dD
attraverso la seguente relazione di equilibrio
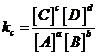
dove kc è detta costante di equilibrio stechiometrica (o analitica), essendo il suo valore correlato alle concentrazioni di equilibrio.
Si osserva tuttavia che tale relazione è valida solo per basse concentrazioni, inferiori a 10-3 M. Per concentrazioni più elevate è necessario tener conto del fatto che le specie chimiche "manifestano" la loro presenza in misura diversa rispetto alla loro concentrazione effettiva e la costante di equilibrio deve essere calcolata rispetto a questa "attività" reale delle specie chimiche.
Il concetto di attività viene dunque inteso come la concentrazione con la quale le specie chimiche prendono effettivamente parte ad un processo.
L'attività a della specie x è correlabile alla sua concentrazione reale C tramite la relazione
ax = x Cx
o
= x [x]
(le parentesi quadre denotano le concentrazioni, mentre le graffe denotano le attività) dove (o f) è detto coefficiente di attività e la concentrazione reale C è espressa come molalità (anche se spesso, soprattutto per soluzioni diluite, viene approssimata tramite la molarità).
Il coefficiente di attività può assumere tutti i valori compresi tra zero ed uno. Per concentrazioni inferiori a 10-3 M esso tende a 1. Per concentrazioni superiori a 10-3 M tende a zero quanto più la soluzione è concentrata. Esso può dunque essere considerato una misura della non idealità del sistema in esame.
Le relazioni di equilibrio devono essere espresse rispetto all'attività delle specie chimiche e la relativa costante è detta costante di equilibrio termodinamica kT (o costante di attività)
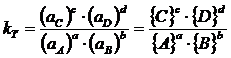
La costante termodinamica può essere messa in relazione alla costante analitica kc attraverso i coefficienti di attività
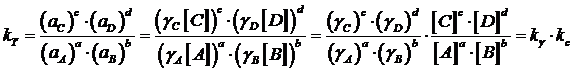
![]()
dove si osserva che, essendo kT costante, k e kc risultano inversamente proporzionali.
Inoltre, per soluzioni molto diluite k tende ad uno e dunque kT = kc e sarà quindi possibile usare le concentrazioni al posto delle attività senza commettere gravi errori.
Nelle soluzioni acquose in cui sono presenti elettroliti le attività differiscono dalle rispettive concentrazioni soprattutto a causa delle interazioni elettriche tra gli ioni presenti in soluzione e tra gli ioni ed il solvente.
Essendo gli ioni specie chimiche elettricamente cariche, in soluzione si verificano interazioni elettrostatiche e accade quindi che una certa quantità di ioni resti schermata elettricamente dal solvente e non possa prendere parte al processo chimico in oggetto.
Le deviazioni dalla idealità che sono state riscontrate dopo varie prove sperimentali hanno permesso di dimostrare che l'effetto di schermatura che si osserva è in funzione della carica e della concentrazione delle varie specie ioniche presenti in soluzione, in quanto le specie neutre inducono variazioni minime.
Quando una soluzione è diluita (concentrazione < 10-3 M) gli ioni si trovano in pratica tutti allo stato completamente solvatato e ad una distanza tale che le interazioni elettrostatiche risultano trascurabili. Aumentando la concentrazione aumenta sia il numero di ioni sia il numero di cariche elettrostatiche e di conseguenza le interazioni sono più forti.
Tali interazioni portano ad un comportamento non ideale della soluzione, per cui la concentrazione attiva o efficace (attività) risulta diversa rispetto alla concentrazione reale.
Per stimare gli effetti delle cariche elettriche presenti in soluzione è stato introdotto il concetto di forza ionica I (o ). La forza ionica è definita come
![]()
dove mi è la concentrazione molale (approssimata con la molarità, per soluzioni diluite) e zi il valore assoluto della carica dello ione i-esimo. Confermando quanto ottenuto dai dati sperimentali si osserva che gli effetti della forza ionica sono indipendenti dal tipo di elettrolita in soluzione, ma dipendono solo dalla sua carica e dalla sua concentrazione.
Calcoliamo ad esempio la forza ionica di una soluzione 0,1 molale di Al2(SO4)3. Poiché un sale è un elettrolita forte esso sarà completamente dissociato
Al2(SO4)3 → 2Al3+ + 3SO42-
E le concentrazioni degli ioni in soluzione saranno
[Al3+] = 0,2 m
[SO42-] = 0,3 m
I = 0.5([Al3+] x (zAl)2 + [SO42-] x (zSO4)2) = 0,5(0,2x32 + 0,3x22)= 1,5 m
Il calcolo della forza ionica per un elettrolita forte può essere notevolmente semplificato notando che essa risulta sempre essere un multiplo intero della concentrazione iniziale in funzione della stechiometria dell'elettrolita stesso.
|
Elettrolita |
ioni |
concentrazione |
forza ionica |
|
|
AB |
A+ |
B- |
m |
1m |
|
AB |
A2+ |
B2- |
m |
4m |
|
AB |
A3+ |
B3- |
m |
9m |
|
A2B |
A+ |
B2- |
m |
3m |
|
A3B |
A+ |
B3- |
m |
6m |
|
A4B |
A+ |
B4- |
m |
10m |
|
A2B |
A2- |
B4- |
m |
12m |
|
A2B3 |
A3+ |
B2- |
m |
15m |
Ad esempio, la forza ionica di una soluzione 0,3 m di BeSO4 → Be2+ + SO42- è pari a 0,3 x 4 = 1,2 m
La forza ionica viene utilizzata per stimare il valore del coefficiente di attività di una specie chimica in soluzione.
Tra le relazioni più usate per tale stima vi è l'equazione di Debye-Hückel. Per un elettrolita binario essa vale
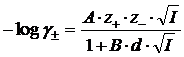
dove:
γ± = coefficiente di attività medio dell'elettrolita binario
z+ e z- = carica, in valore assoluto, rispettivamente del catione e dell'anione
d = valore medio del diametro, espresso in Ångstrom, degli ioni solvatati dall'acqua
I = forza ionica della soluzione
A e B = costanti empiriche funzioni della temperatura e del solvente,
con A = 1.824928x106 1/2(IT)-3/2 e B = 50.3 (IT)-1/2
Dove I è la costante dielettrica dell'acqua e la densità (comunemente pari ad 1). Ma per semplicità i coefficienti A e B vengono spesso stimato attraverso polinomiali quadratiche che interpolano i dati reali del tipo
A = 0.4908 + 6.2627x10-4 t + 4.7031x10-6 t2
B = 0.3246 + 1.4883x10-4 t + 2.4284x10-7 t2
Con t temperatura in Celsius
A 25 °C per l'acqua tali coefficienti valgono A = 0,509 e B = 0,328.
Per il prodotto d·B sono stati proposti valori compresi tra 1 e 1.6, ma comunemente viene accettato il valore 1.5 per tutte le temperature e per qualsiasi tipo di soluzione.
Per uno ione di carica z l'equazione di Debye-Hückel vale
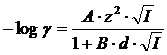
Come andamento generale i coefficienti di attività decrescono all'aumentare della forza ionica I fino ad un minimo nella regione tra I = 0.3 e I = 0.7. In corrispondenza di valori superiori di forza ionica i coefficienti di attività tornano a crescere e l'equazione di Debye-Hückel non è in grado di prevederne l'andamento. In definitiva, l'equazione di Debye-Hückel fornisce risultati accettabili per valori di forza ionica inferiori a 0,1.
Per concentrazioni superiori si usa in genere l'equazione di Davies, una estensione empirica dell'equazione di Debye-Hückel Per un elettrolita binario l'equazione di Davies vale
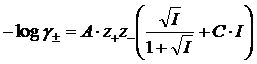
mentre, per uno ione di carica z vale
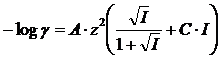
Al coefficiente C vengono assegnati valori compresi nell'intervallo -0,1/-0,5 (i valori più utilizzati sono C = -0,2 e C = -0,3).
Si noti come il termine C·I si annulli per I che va a zero, per cui l'equazione di Davies si riduce all'equazione di Debye-Hückel per bassi valori di forza ionica.
Per un elettrolita indissociato si ha
![]()
ma spesso agli elettroliti indissociati si assegna = 1
Esempio 1 (effetto della forza ionica sul pH di un acido forte)
Calcoliamo il pH di una soluzione 0,1 M di HCl.
L'acido cloridrico è un acido forte, completamente dissociato secondo la reazione
HCl → H+ + Cl-
le concentrazioni degli ioni in soluzione saranno dunque
[H+] = 0,1 M
[Cl-] = 0,1 M
Se utilizzassimo la concentrazione degli ioni H+ per calcolare il pH otterremo un valore pari a pH = -log[H+] = -log 0.1 = 1. Ma in realtà il pH è uguale al logaritmo decimale negativo dell'attività degli ioni idrogeno.
![]()
Calcoliamo allora
I = 0.5([H+]·(zH)2 + [Cl-]·(zCl)2) = 0,5(0,1· 12 + 0,1· 12)= 0,1 M
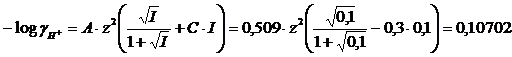
![]()
![]()
![]()
Osserviamo come la soluzione risulti meno acida di quanto ci si aspetterebbe effettuando il calcolo del pH usando le concentrazioni. L'elevata forza ionica della soluzione riduce infatti l'attività delle specie chimiche in soluzione. Osserviamo ora come in una soluzione diluita di HCl gli effetti della forza ionica sul pH possano considerarsi trascurabili.
Calcoliamo ad esempio il pH di una soluzione 10-4 M di HCl. Le concentrazioni degli ioni in soluzione saranno dunque
[H+] = 10-4 M
[Cl-] = 10-4 M
se utilizzassimo la concentrazione degli ioni H+ per calcolare il pH otterremo un valore pari a pH = -log[H+] = -log 10-4 = 4.
Ma poichè il pH è uguale al logaritmo decimale negativo dell'attività degli ioni H+, calcoliamo allora
I = 0.5([H+] · (zH)2 + [Cl-] · (zCl)2) = 0,5(10-4 · 12 + 10-4 · 12)= 10-4M
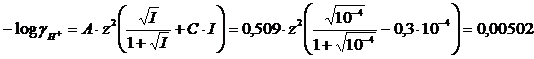
![]()
![]()
![]()
Come si può osservare in questo caso, con una soluzione diluita (M = 10-4), la forza ionica è bassa, il coefficiente di attività molto vicino all'unità ed il calcolo del pH può esser eseguito utilizzando le concentrazioni al posto delle attività ottenendo valori accettabili.
Esempio 2 (effetto della forza ionica sul pH di un acido debole)
Calcoliamo il pH di una soluzione C=10-1 M di acido tricloroacetico Cl3CCOOH ka=0.1995 (pka=0.7)
L'acido tricloroacetico è un acido debole, parzialmente dissociato secondo la reazione
Cl3CCOOH ![]() H+ + Cl3CCOO-
H+ + Cl3CCOO-
Calcoliamo il pH senza tener conto della forza ionica o meglio, ponendo = 1 e considerando quindi le concentrazioni uguali alle attività. Per calcolare la concentrazione degli ioni H+ scegliamo la formula risolutiva semplificata usando il seguente diagramma (già definito in precedenza)
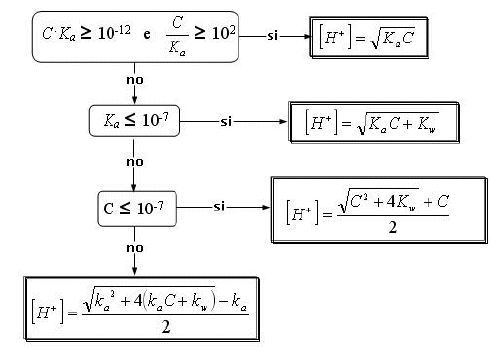
usiamo dunque l'ultima formula risolutiva
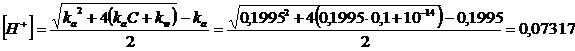
pH = -log[H+] = -log 0,07317 = 1.136
Proviamo ora a tener conto della forza ionica e calcoliamo l'attività degli ioni H+,
Il calcolo della forza ionica per un elettrolita debole deve ovviamente tener conto delle concentrazioni di equilibrio e deve essere fatta con metodo iterativo per approssimazioni successive (infatti la forza ionica dipende dalle concentrazioni, le quali dipendono dai coefficienti di attività, i quali, a loro volta, dipendono dalla forza ionica). Usiamo qiudi le concentrazioni trovate in precedenza (con = 1) per calcolare la forza ionica e ricalcoliamo . Utilizziamo il nuovo valore di per ricalcolare le concentrazioni di equilibrio, procedendo finchè il valore di non si stabilizza.
Iterazione 1
Dal calcolo precedente risulta che in soluzione sono presenti le seguenti concentrazioni
[H+] = 0.07317 M
[Cl3CCOO-] = 0.07317 M
[Cl3CCOOH] = 0,1 - 0.07317 = 0.02683 M
e dunque la forza ionica sarà
I = 0.5( [anione] ·(zanione)2 + [H+]· (zH)2) = 0,5(0.07317·12+ 0.07317·12)= 0.07317
Mentre i nuovi coefficienti di attività
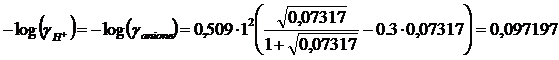
![]()
per semplicità poniamo = 1 il coefficiente di attività dell'acido indissociato.
Ricalcoliamo le concentrazioni di equilibrio utilizzando i nuovi valori di ed indicando con x la concentrazione di ioni H+ all'equilibrio
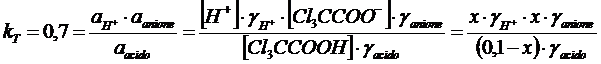
tenendo conto che ![]() e
e ![]() otteniamo la seguente equazione
otteniamo la seguente equazione
![]()
![]()
che risolta fornisce
x = [H+] = [Cl3CCOO-] = 0.07967 M
utilizziamo ora queste nuove concentrazioni per ricalcolare forza ionica e nuovamente i coefficienti di attività.
Iterazione 2
I = 0.5( [anione]·(zanione)2 + [H+]· (zH)2) = 0,5(0.07967 ·12+ 0.07967·12)= 0.07967
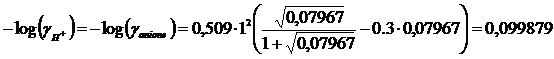
![]()
Utilizziamo l'equazione di secondo grado per ricalcolare le concentrazioni di equilibrio utilizzando i nuovi valori di
![]()
![]()
che risolta fornisce
x = [H+] = [Cl3CCOO-] = 0.07983 M
Ripetiamo il procedimento, ricalcolando I e
Iterazione 3
I = 0.5( [anione]·(zanione)2 + [H+]· zH)2) = 0,5(0.07983·12+ 0.07983·12)= 0.07983
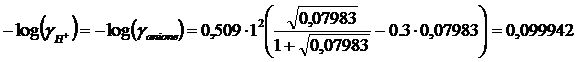
![]()
ricalcoliamo le concentrazioni di equilibrio utilizzando i nuovi valori di
![]()
![]()
che risolta fornisce
x = [H+] = [Cl3CCOO-] = 0.07984 M
ricalcoliamo I e
Iterazione 4
I = 0.5( [anione]·(zanione)2 + [H+]·(zH)2) = 0,5(0.07984·12+ 0.07984·12)= 0.07984
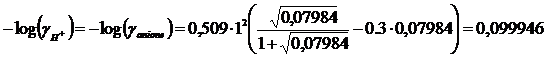
![]()
il valore di risulta uguale a quello calcolato in precedenza. Dunque, la concentrazione degli ioni H+ è pari a [H+] = 0.07984 M ed il coefficiente di attività dello ione idrogeno è
![]()
Se ne deduce che la sua attività è
![]()
e dunque il pH sarà
![]()
Si noti che il valore della costante di equilibrio analitica (calcolata usando le concentrazioni e non le attività) è
![]()
ed il relativo pK = -log 0.3162 = 5. Tale pK è spesso definito pka' apparente.
È semplice verificare che, per un acido debole monoprotico HA, tra il pk termodinamico e quello apparente esiste la seguente relazione
![]()
![]()
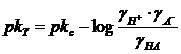
essendo poi
![]()
e
![]()
![]()
ed essendo infine
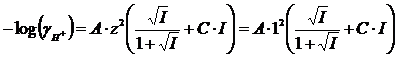
si avrà
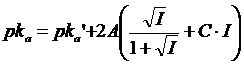
dove
pKa = pk termodinamico
pKa' = pk analitico (o apparente)
Nel caso di acidi deboli poliprotici vengono modificati anche i pk apparenti delle dissociazioni successive alla prima.
In generale se consideriamo una dissociazione successiva alla prima di un generico acido debole poliprotico avente carica, in valore assoluto, pari a z
HnAz- ![]() H+ + Hn-1A(z+1)-
H+ + Hn-1A(z+1)-
La sua k vale
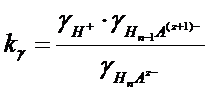
e, passando ai logaritmi
![]()
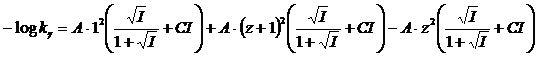
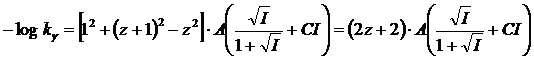
in definitiva
per la costante di seconda dissociazione acida, con l'acido che presenta z = 1 (ad esempio HA-) si avrà
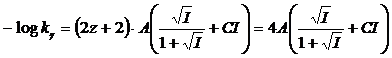
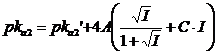
per la costante di terza dissociazione acida, con l'acido che presenta z = 2 (ad esempio HA2-) si avrà
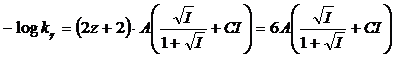
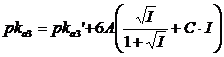
per la costante di quarta dissociazione acida, con l'acido che presenta z = 3 (ad esempio HA3-) si avrà
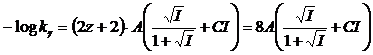
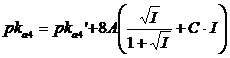
Se quindi indichiamo con pK la differenza tra il pK termodinamico ed il pk analitico per l'equilibrio di prima dissociazione
![]()
si avrà che i pk analitici delle eventuali successive dissociazioni potranno essere calcolati come
![]()
![]()
![]()
Ad esempio in una soluzione 0,1 M di acido pirofosforico (pka1 = 1,52; pka2 = 2,36; pka3 = 6,60; pka4 = 9,25) in cui la forza ionica risulti essere pari a I = 0,06425.
Per il pka di prima dissociazione si avrà
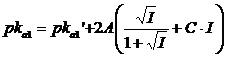
e dunque
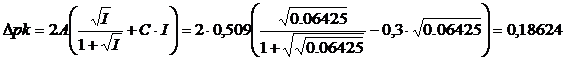
i pk apparenti varranno
![]()
![]()
![]()
![]()
Esempio 3 (effetto della forza ionica su di un tampone)
Calcoliamo il pH di una soluzione tampone 0,05 M in NaH2PO4 e 0,05 M in Na2HPO4 sapendo che la costante di seconda dissociazione acida dell'acido fosforico vale 6,31 10-8 pka2=7,2
Il tampone è costituito da una miscela equimolare dell'acido debole H2PO4- (pka2=7,2) e della sua base coniugata HPO42-. Se applichiamo le relazione di Henderson-Hasselbach senza tener conto della forza ionica della soluzione (e quindi assumendo unitari i coefficienti di attività) otterremo un pH = pka.
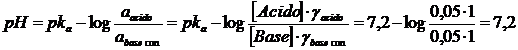
Calcoliamo ora la forza ionica della soluzione
NaH2PO4 è un elettrolita di tipo A+ B- e dunque la sua forza ionica è uguale alla sua concentrazione: I = 0,05
Na2HPO4 4 è un elettrolita di tipo A+ B2- e dunque la sua forza ionica è uguale a tre volte la sua concentrazione: I = 0,15
La forza ionica complessiva della soluzione sarà dunque pari a I = 0,2
Calcoliamo i coefficienti di attività dei due anioni
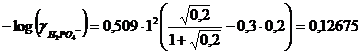
![]()
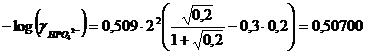
![]()
e ricalcoliamo il pH
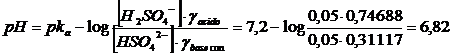
Si noti come, in generale, sia possibile inglobare i coefficienti di attività nel pka ottenendo un pka' apparente. Per un generico tampone in cui la forma acida presenta in valore assoluto carica pari a z e la sua base coniugata carica z+1
HnAz- / Hn-1A(z+1)-
la relazione di Henderson-Hasselbach diventa
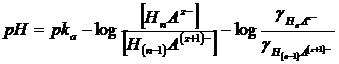
ed essendo
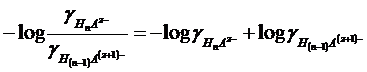
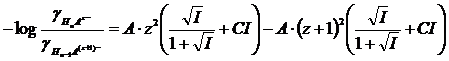
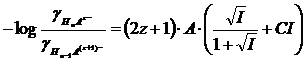
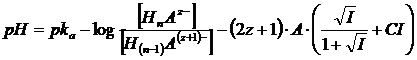
ponendo infine
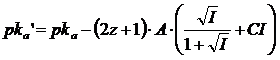
si ottiene il pka' apparente da usare insieme alle concentrazioni
In definitiva, per un generico acido tetraprotico H4A con il quale sia possibile costruire 4 tipi di tamponi ( 1) H4A/H3A-; 2) H3A-/H2A2-; 3) H2A2-/HA3-; 4) HA3-/A4-) si avranno le seguenti equazioni di Henderson-Hasselbach
z = 0 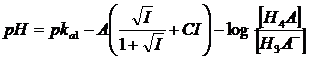
z = 1 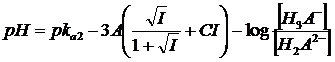
z = 2 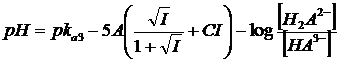
z = 3 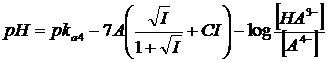
Si consideri ad esempio un tampone costituito da HPO42-/PO43- (Pka3=12,66) avente una forza ionica I=0,4. Poiché la specie acida (l'anione idrogenofosfato HPO42-) ha carica z = 2, potremo scrivere
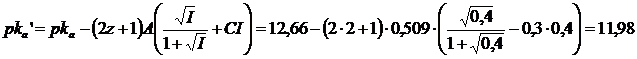
ed usare la seguente relazione modificata di Henderson-Hasselbach per il calcolo del pH
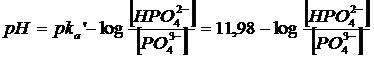
Esempio 4 (effetto della forza ionica sulla solubilità)
Calcoliamo la solubilità S del fluoruro di Litio LiF (kps = 1,7 10-3)
Essendo la kps una costante di equilibrio essa è funzione delle attività e non delle concentrazioni
![]()
Calcoliamo la solubilità del fluoruro di Litio senza tener conto della forza ionica e dunque assumendo come unitari i coefficienti di attività.
Posto pari ad x la concentrazione del fluoruro di Litio che si scioglie nella soluzione satura (x = S) e che si dissocia in x mol/L di Li+ ed x mol/L di F-, avremo
![]()
![]()
Calcoliamo ora la solubilità del fluoruro di Litio tenendo conto della forza ionica. Come nel caso dell'acido debole è necessario eseguire il calcolo con un metodo iterativo per approssimazioni successive.
Iterazione 1
Usiamo le concentrazioni calcolate in precedenza con = 1 per calcolare la forza ionica e ricalcolare i coefficienti di attività
Con una concentrazione di LiF in soluzione pari a 4,123 10-2 M avremo una forza ionica pari a I = 4,123 10-2 M (il fluoruro di Litio è un elettrolita del tipo A+ B- in cui la forza ionica risulta uguale alla concentrazione).
Calcoliamo i coefficienti di attività
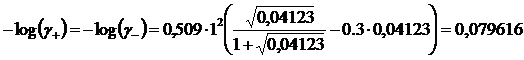
![]()
Usiamo ora i coefficienti calcolati per ricalcolare le concentrazioni di equilibrio
![]()
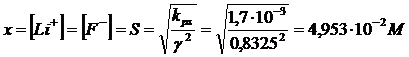
Con una concentrazione di LiF in soluzione pari a 4,953 10-2 M avremo una forza ionica pari a I = 4,953 10-2 M
Ricalcoliamo i coefficienti di attività in funzione del nuovo valore di I
Iterazione 2
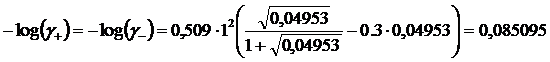
![]()
Ripetiamo il calcolo usando i nuovi valori di
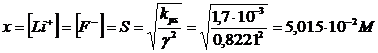
Con una concentrazione di LiF in soluzione pari a 5,015 10-2 M avremo una forza ionica pari a I = 5,015 10-2 M
Ricalcoliamo i coefficienti di attività in funzione del nuovo valore di I
Iterazione 3
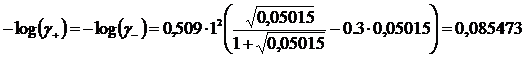
![]()
Ripetiamo il calcolo usando i nuovi valori di
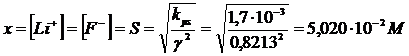
Con una concentrazione di LiF in soluzione pari a 5,020 10-2 M avremo una forza ionica pari a I = 5,020 10-2 M
Ricalcoliamo i coefficienti di attività in funzione del nuovo valore di I
Iterazione 4
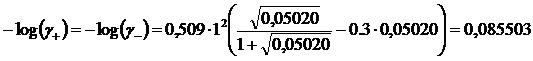
![]()
il valore dei coefficienti si è stabilizzato a = 0,8213 e dunque le concentrazioni degli ioni in soluzione e la solubilità del fluoruro di Litio sono pari a 0,0502 M
In generale, introducendo un elettrolita forte in una soluzione satura di un sale poco solubile, la solubilità del sale aumenta. Infatti, se la forza ionica di una soluzione satura viene aumentata per mezzo di un'aggiunta di elettroliti forti, i coefficienti di attività degli ioni prodotti per dissociazione dell'analita diminuiscono, e quindi l'attività degli ioni stessi diminuisce. La soluzione non è più satura e quindi si osserva una ulteriore dissoluzione del soluto, con conseguente aumento della solubilità (effetto sale).
 |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |