 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2825 | Gradito: |
Leggi anche appunti:Redox con più di due elementi che variano il noxRedox con più di due elementi che variano il nox In reazioni redox complesse Equazione di NernstEquazione di Nernst L'equazione di Nernst permette di calcolare il potenziale MolecolaMOLECOLA Chimica L'ipotesi dell'esistenza di molecole formate da |
 |
 |
Un'altra applicazione si ha nel calcolo delle costanti di equilibrio
Il valore di DG° di una reazione chimica deve essere infatti in relazione allo stato di equilibrio che il sistema può raggiungere. In particolare in chimica le condizioni di equilibrio di un sistema vengono descritte tramite opportune costanti di equilibrio (kc, kp, ka, kb, kps, kw etc). Deve allora esistere una relazione che colleghi il DG° di una reazione chimica alla relativa costante di equilibrio K.
Il DG° di una sostanza è calcolato in condizioni standard (25°C, pressione parziale di 1 atm, concentrazione 1M). Si può dimostrare che il DG in condizioni diverse da quelle standard varia con la concentrazione (o la pressione parziale per le sostanze gassose). Per una generica sostanza A la relazione è la seguente
![]()
Per una generica reazione del tipo
aA + bB
![]() cC + dD
cC + dD
La variazione di Energia libera in condizioni non standard per l'intera reazione vale
![]()
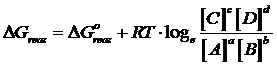
E' facile verificare che, se la reazione era spontanea e quindi con un DG° negativo, man mano che i reagenti si trasformano nei prodotti di reazione il rapporto delle loro concentrazioni aumenta fino al punto in cui il DG della reazione non si azzera.
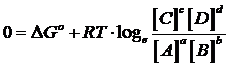
In queste condizioni ( DG = 0) il sistema non presenta alcuna tendenza ad evolvere nè verso i reagenti, nè verso i prodotti di reazione. Il sistema ha raggiunto l'equilibrio ed il rapporto delle concentrazioni di equilibrio è proprio la costante di equilibrio K della reazione.
Potremo allora scrivere, per lo stato di equilibrio
![]()
che rappresenta la relazione cercata tra DG° e K (costante di equilibrio termodinamica adimensionale). Tale relazione può essere ottenuta per qualsiasi costante di equilibrio.
Si tenga presente che la costante di equilibrio viene oggi più correttamente definita in termini di variazione di energia libera del sistema reagente e non in termini cinetici (eguagliando la velocità della reazione diretta alla velocità della reazione inversa).
Esempio 1
Calcoliamo ad esempio il prodotto di solubilità kps dello ioduro di argento AgI, sapendo che i DG° di formazione delle specie chimiche interessate all'equilibrio sono
DG° AgI(s) = - 66,19 kJ/mol
DG° Ag+(aq) = +77,11 kJ/mol
DG° I-(aq) = - 51,57 kJ/mol
AgI(s) ![]() Ag+(aq) + I-(aq)
Ag+(aq) + I-(aq)
DG° = S DG°prodotti) - S DG°reagenti) = [(+ 77,11) + (- 51,57)] - (- 66,19) = + 91,73 kJ
Calcoliamo ora la kps
![]()
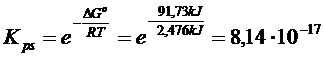
Calcoli analoghi possono essere fatti per tutte le altre costanti di equilibrio. A titolo di esempio calcoliamo la tensione di vapore dell'acqua a 25°C e la kb dell'ammoniaca.
Esempio 2
Calcolare la costante di equilibrio kp dell'equilibrio di evaporazione dell'acqua
H2O(l) ![]() H2O(g)
H2O(g)
sapendo che il DG° dell'acqua liquida e del vapor d'acqua valgono rispettivamente -237,13 kJ/mol e -228,57 kJ/mol.
DG° = S DG°prodotti) - S DG°reagenti) = (-228,57) - (- 237,13) = + 8,56 kJ
Calcoliamo ora la kp
![]()
![]()
Poiché la concentrazione dell'acqua liquida viene considerata costante, la kp di tale trasformazione coincide con la pressione parziale della fase gassosa e quindi con la tensione di vapor d'acqua a 25°C.
Esempio 3
Calcoliamo la kappa basica kb dell'ammoniaca NH3, sapendo che i DG° di formazione delle specie chimiche interessate all'equilibrio sono
DG° NH3(aq) = - 26,5 kJ/mol
DG° H2O(l) = - 237,13 kJ/mol
DG° NH4+(aq) = - 79,31 kJ/mol
DG° OH- (aq) = - 157,24 kJ/mol
NH3(aq) + H2O(l) ![]() NH4+(aq) + OH-(aq)
NH4+(aq) + OH-(aq)
DG° = S DG°prodotti) - S DG°reagenti) = [(- 79,31) + (- 157,24)] - [(- 26,5) + (- 237,13)] = +27,08 kJ
Calcoliamo ora la kb Calcoliamo ora la kb
![]()
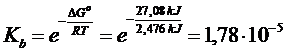
![]()
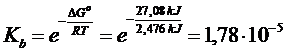
Esempio 4
Calcoliamo la costante di equilibrio Kp (a 298 K) per la reazione di sintesi dell'ammoniaca NH3, a partire dai suoi elementi sapendo che il DG° di formazione dell'ammoniaca gassosa è pari a - 16,45 kJ/mol
Scriviamo la reazione bilanciata
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Ricordando che il DG° di formazione degli elementi puri è pari a zero, possiamo calcolare il DG° della reazione
DG° = S DG°prodotti) - S DG°reagenti) = [(- 16,45)·2] - [(0) + (0)·3] = -32,90 kJ
Calcoliamo ora la kp
![]()
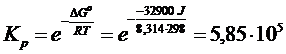
Esempio 5
L'energia libera di Gibbs standard di formazione di NH3(g) a 298K è ΔG°f = - 16,45 kJ mol-1. Calcolare l'energia libera di Gibbs della reazione di formazione di NH3(g) quando la pressione parziale di N2, H2 e NH3 sono 3,0 bar, 1,0 bar e 4,0 bar, rispettivamente.
Scriviamo la reazione bilanciata di sintesi dell'ammoniaca
N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
Il ΔG° di formazione per due moli di ammoniaca è -16.45 x 2 = -32,90 kJ. La variazione di energia libera in condizioni diverse da quelle standard è
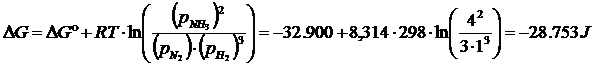
e quindi, per una mole di ammoniaca, avremo ΔGf = - 28.753 : 2 = - 14.376 J mol-1.
 |
| Appunti su: calcolo della costante di equilibrio chimica conoscendo l27energia libera, energia libera e gratis, energia libera e costante di equilibrio, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |