Cariche
formali
Per
l'attribuzione delle cariche formali si procede come segue. Si immagina di
suddividere i doppietti di legame in parti uguali, assegnando un elettrone di
ogni coppia a ciascuno dei due atomi:
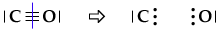
Si confronta
poi la configurazione elettronica così ottenuta con quella naturale
dell'atomo. Nel nostro caso, il carbonio verrebbe ad avere 5 elettroni nello
strato di valenza, uno in più rispetto alla configurazione normale. È
come se avesse acquistato un elettrone e gli assegneremo pertanto una carica negativa.
Analogamente, l'ossigeno verrebbe ad avere 5 elettroni, uno in meno
rispetto alla configurazione normale. È come se avesse perso un elettrone e gli
assegneremo pertanto una carica positiva.
Una molecola
molto simile al monossido di carbonio è quella del monossido d'azoto, NO.
L'azoto ha 5 elettroni di valenza, l'ossigeno 6; il numero totale degli
elettroni nella molecola è pertanto dispari e un elettrone resterà
inevitabilmente spaiato. Molecole, atomi o ioni di questo tipo, che
contengono cioè elettroni spaiati, presentano proprietà paramagnetiche,
ovvero si orientano in un campo magnetico. La molecola di NO può essere
costruita a partire dai simboli elettronici come segue:

Come si
vede, solo l'ossigeno completa l'ottetto.
In
alternativa, come abbiamo fatto per il monossido di carbonio, potremmo
utilizzare un doppietto libero dell'ossigeno per formare un ulteriore legame,
scrivendo:
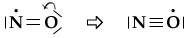
In tal caso
tuttavia, l'ossigeno si trova circondato da nove elettroni e la formula non
è accettabile, in quanto nell'ipotesi di Lewis la regola dell'ottetto
deve essere considerata fortemente restrittiva per gli elementi del 2°
periodo. A causa dell'elettrone 'dispari', in nessuna delle
due strutture è possibile soddisfare la regola dell'ottetto per entrambi gli
atomi.




![]()
![]()
![]()