 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3028 | Gradito: |
Leggi anche appunti:Il petrolioIl petrolio COMPOSIZIONE CHIMICA E FISICA Il petrolio è una miscela di Costante di equilibrio (Kc Kp Kn Kχ)Costante di equilibrio (Kc Kp Kn Kχ) La relazione di equilibrio viene Lavoro eseguito da una pilaLavoro eseguito da una pila Ricordando che la differenza di potenziale elettrico |
 |
 |
Antiossidanti
Gli antiossidanti servono per ritardare la reazione di autossidazione di materiali organici. La reazione di autossidazione è una reazione radicalica a catena che coinvolge ossigeno molecolare. Tale reazione provoca la degradazione di proprietà meccaniche, estetiche o elettriche di polimeri; perdita di profumo e sviluppo di rancidità nei cibi; aumento di viscosità, acidità e formazione di prodotti insolubili nei lubrificanti. Il bisogno di antiossidanti dipende dalla composizione chimica del substrato e dalle condizioni di esposizione. La stabilizzazione di polimeri come gomma naturale o oli poliinsaturi richiede alte concentrazioni di antioosidanti, mentre polimeri saturi hanno maggiore stabilità e richiedono concentrazioni più basse di stabilizzanti. A livello biologico, la reazione di autossidazione può determinare danni cellulari a livello della membrana e del DNA.
La Reazione di Autoossidazione
La reazione di autoossidazione è una reazione radicalica a catena, che può essere a volte autocatalitica. Le reazioni a catena, frequenti nella chimica dei radicali, sono costituite da 3 stadi. Nel primo stadio, detto di iniziazione, viene formata una specie radicalica In., chiamata chain carrier (trasportatore di catena).
Iniziatore In. (chain carrier) Iniziazione
Nel secondo stadio, detto di propagazione, il chain carrier reagisce con il substrato S attraverso un ciclo catalitico, a sua volta costituito da uno o più stadi. Al termine del ciclo catalitico la molecola del chain carrier viene ripristinata, potendo coì iniziare un nuovo ciclo.
S + In. P1. P1. P2. P2. P + In. Propagazione
Nel terzo stadio, detto di terminazione, si ha la scomparsa del chain carrier ("morte") attraverso reazioni parassite radicale/radicale (in genere, dimerizzazione o accoppiamento)
2 In. In-In (Dimerizzazione) In. + R. In-R (Accoppiamento) Terminazione
Se la velocità dello stadio di terminazione (VT) è maggiore della velocità di iniziazione (VI), la reazione a catena si spegne. Solitamente, nelle prime fasi di una reazione a catena VI > VT, per cui la concentrazione del chain carrier cresce nel tempo. Con l'aumentare della concentrazione, aumentano anche le reazioni parassite che portano alla morte del chain carrier; si osserva che nelle fasi intermedie della reazione VT = VI , quindi la concentrazione del chain carrier rimane costante. Nelle fasi finali della reazione diventa VT > VI: la concentrazione del chain carrier tende rapidamente a zero e la reazione si spegne.
La velocità di scomparsa del substrato S, VS, è data da
VS = kP [S][Chain carrier]
Dove kP è la costante cinetica dello stadio di propagazione e [S] la concentrazione del substrato. Nelle fasi in cui VT = VI si ha [chain carrier] = costante, per cui
VS = k' [S]

La velocità di scomparsa di S segue una
semplice legge del 1° ordine.
In una reazione a catena autocatalitica la reazione del chain carrier con il substrato conduce alla formazione dei prodotti di reazione e di due molecole di chain carrier, la cui concentrazione non rimane costante, ma cresce progressivamente nel tempo fino alla fine della reazione. Il progressivo aumento della concentrazione del chain carrier determina un progressivo aumento della velocità di reazione.
Analizziamo i 3 stadi di una reazione a catena di autossidazione.
Iniziazione
a) Scissione termica o fotochimica di perossidi XO-OX. I perossidi sono usati come iniziatori nelle rezioni di polimerizzazione e si trovano sempre in tracce inglobati nel polimero. Per effetto della luce o del calore il perossido decompone fornendo alcossi radicali che, a causa della grande energia del legame XO-H (X = alchile), sono ottimi idrogeno estrattori.
XO. + R-H XOH + R.
b) Estrazione di idrogeno da parte del diossigeno. Questa reazione avviene in condizioni termiche a temperature > 100 °C [con substrati particolarmente reattivi (molecole che contengono H allilici o benzilici) anche a temperature minori]. Opera principalmente con oli da frittura o oli lubrificanti.
R-H + .O-O. R. + HO-O. (idroperossil radicale)
c)
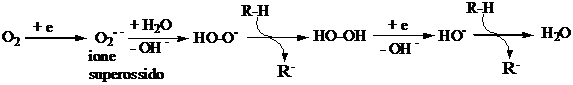
Estrazione di idrogeno da parte di
idrossi radicali. Questo processo opera principalmente in vivo con substrati biologici. Gli idrossi radicali sono prodotti
in situ durante il metabolismo di
trasformazione di ossigeno in acqua.
d) Formazione di radicali per esposizione di materiali organici alla luce solare (fotolisi)
![]()
Propagazione
Qualsiasi sia la strada con cui il radicale R. (chain carrier) viene generato, questo viene intrappolato dall'ossigeno con formazione di un perossil radicale, ROO.. La reazione è molto veloce: lo stadio lento è determinato dalla velocità di diffusione del radicale nel mezzo (rate diffusion controlled). Il perossil radicale può evolvere in due modi:
a) formazione di ossi radicali RO. attraverso un meccanismo di dimerizzazione/frammentazione
2 RO-O. RO-OO-OR 2 RO. + O2
Gli alcossi radicali estraggono idrogeno dal substrato, rigenerando radicali R., che iniziano una nuova catena
RO. + R-H ROH + R.
b) estrazione di idrogeno dal substrato R-H con formazione di un idroperossido e di un radicale R., che inizia una nuova catena.
RO-O. + R-H RO-OH + R.
L'idroperossido può frammentare, generando un idrossi e un alcossi radicale, che a loro volta estraggono idrogteno dal substrato R-H, generando altri 2 radicali R.. In questo caso, da un iniziale radicale R. se ne formano 3: la reazione è autocatalitica.
La reazione di estrazione di idrogeno non è la sola esibita dagli alcossi radicali. Particolarmente importante è la reazione di b-frammentazione, che porta alla formazione di un composto carbonilico (aldeide o chetone) e di un nuovo radicale R'..
R'-C(R"R"')O. R' + R"R"'C=O
Terminazione
Si ha terminazione quando il radicale R. si spegne senza poter iniziare una nuova catena. La terminazione ha luogo attraverso due meccanismi principali:
A) Reazione radicale/radicale
a) dimerizzazione R. + R. R-R
Questa reazione diventa importante quando la concentrazione di ossigeno è bassa, ad esempio in polimeri plastici di alto spessore. Tuttavia anche questa reazione è indesiderabile, perché porta a "cross linking", con conseguente indurimento del polimero.
b) accoppiamento R. + R'. R-R'
B) Riduzione per estrazione di idrogeno da una molecola A-H, con formazione di un radicale stabile A. incapace di proseguire la catena.
R. + A-H R-H + A.
ROO. + A-H ROOH + A.
La reazione di b-scissione degli alcossi radicali.
Gli alcossi radicali sottostanno a due principali reazioni: a) estrazione di idrogeno, governata dalla grande forza del legame AlchileO-H; b) b-scissione, governata dalla grande forza del legame p C=O.
La b-scissione conduce a rottura della molecola, con formazione di un nuovo radicale propagatore e di un derivato carbonilico (aldeide o chetone). Questo processo è responsabile della degradazione di catene alifatiche, con perdita delle caratteristiche del materiale.
Degradazione di materiali polimerici


In campo industriale sono particolarmente sensibili alla degradazione ossidativa materiali polimerici quali polipropilene o polistirene, elastomeri (polibutadiene) o oli lubrificanti. La regiochimica dell''estrazione di idrogeno è governata dalla stabilità del radicale che si forma, quindi avviene sul carbonio terziario (polietilene, oli lubrificanti), sul carbonio benzilico (polistirene) o sul carbonio allilico (polibutadiene). Il radicale è poi bloccato dall'ossigeno, con formazione di un perossil radicale, quindi dell'alcossi radicale responsabile dellòa frammentazione della catena.
Irrancidimento di oli e grassi
Gli oli e i grassi sono esteri della glicerina (propantriolo). I corrispondenti acidi, detti "acidi grassi", sono caratterizzati dalla presenza di uno o più doppi legami CC (grassi monoinsaturi e poliinsaturi). La presenza di idrogeni allilici rende i grassi insaturi particolarmente sensibili all'ossidazione. Gli alcossi radicali che si generano frammentano, con un mecanismo identico a quello visto sopra per la degradazione dei polimeri, portando alla formazione di aldeidi insature, che conferiscono al cibo il caratteristico gusto di "rancido". Il fenomeno è più rilevante negli oli, più ricchi di acidi grassi insaturi rispetto ai grassi
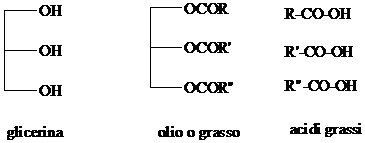
Gli acidi grassi più diffusi sono:

Danneggiamenti biologici
A livello biologico si possono avere danneggiamenti dovuti ad autoossidazione a livello della membrana cellulare e del DNA.
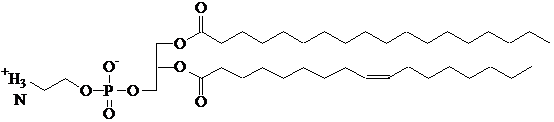
La membrana cellulare è costituito da un doppio strato lipidico. I lipidi di membrana sono fosfogliceridi (fosfolipidi), costituiti da glicerina esterificata con due molecole di acido grasso (palmitico, stearico e oleico) e da una molecola di acido fosforico, a sua volta esterificato su un OH da una molecola di alcol a basso peso molecolare. L'ossidazione, che avviene principalmente a carico della posizione allilica dell'acido oleico, porta a danneggiamento della membrana.
A livello di DNA il danneggiamento è determinato principalmente da estrazione di idrogeno da una delle 5 posizioni dell'unità zuccherina (deossiribosio), in particolare dalla posizione C5'. Il radicale generato può ripararsi per estrazione idi idrogeno dal glutatione, un antiossidante tiolico presente in alte concentrazioni nella cellula, o re intrappolato dall'ossigeno, con conseguente rottura del filamento e morte della cellula.

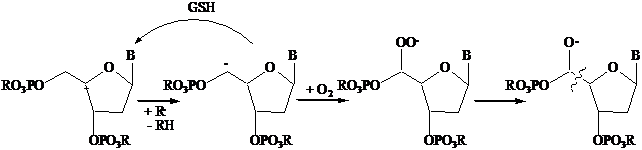
Antiossidanti
Per inibire (o almeno ritardare) la reazione di autoossidazione è necessario bloccare i radicali che agiscono come chain carrier. Quindi, qualsiasi sostanza che sia in grado di funzionare come trappola radicalica (radical scavenger) è potenzialmente un antiossidante.
I radical scavengers utilizzati come antiossidanti, naturali o artificiali, si dividono in due categorie:
Antiossidanti idrogeno donatori (fenoli, ammine, tioli)
Antiossidanti radicalici (TEMPO)
Oltre agli antiossidanti che agiscono come trappole, trovano utilizzo gli antiossidanti riducenti (solfuri, fosfine) che agiscono sui composti perossidici, precursori radicalici.
Antiossidanti Idrogeno Donatori
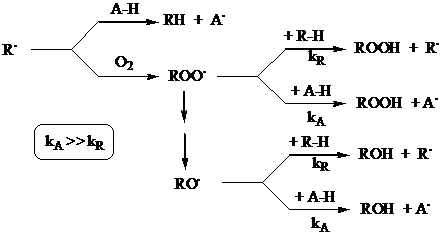
Bloccano la catena per idrogeno
donazione verso i radicali che agiscono come chain carrier. I nuovi radicali
che si formano si spengono senza poter estrarre idrogeno da altre molecole.
Gli antiossidanti idrogeno donatori appartengono a 3 famiglie:
a) Fenoli. b) Ammine aromatiche secondarie. c) Tioli.
a) Fenoli
Appartengono a questa famiglia molti antiossidanti naturali, contenuti nella frutta, verdura e vino, [derivati dell'acido gallico, contenuti specialmente nel vino rosso, l'a-tocoferolo (Vitamina E), i derivati della catechina], nonché alcuni importanti antiossidanti artificiali, come il BHT (2,6-di-tert-butil-4-metilfenolo). Si può far rientrare in questa famiglia anche l'acido ascorbico (Vitamina C), anche se non è propriamente un fenolo.
I fenoli sono buoni idrogeno donatori, a causa della debole forza del legame O-H. L'ossi radicale che si forma, delocalizzato sul nucleo benzenico, si spegne per accoppiamento in para o, se è presente una seconda funzione OH, per ulteriore idrogeno donazione. A titolo esemplificativo sono mostrati i meccansimi di ossidazione della quercetina, un antiossidante appartenente alla famiglia delle catechine contenuto in molte verdure (cipolla, cavolo), e del BHT, un antiossidante molto usato nell'industria alimentare. Si noti come una molecola di antiossidante blocca due specie radicaliche R., inibendo così la propagazione di due catene.
Gli antiossidanti fenolici sono molto utilizzati nell'industria alimentare e, benchè meno efficaci dei derivati amminici, anche nell'industria dei polimeri, poichè i corrispondenti derivati ossidati non sono colorati, quindi non alterano le caratteristiche del materiale. Sono aggiunti ai polimeri termoplastici in concentrazione 0.01-0.02%, agli elastomeri in concentrazione 0.5-2%.

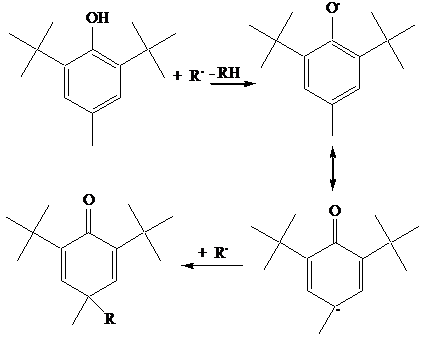

b) Ammine aromatiche
Sono derivati della defenilammina, della para-fenilendiammina e della diidrochinolina. Questi ultimi sono molto usati come a.o. nel mangime per animali. Sono molto più efficaci degli a.o. fenolici, perché l'amminil radicale aromatico è molto stabile, quindi l'estrazione di idrogeno dall'ammina è un processo molto veloce. Tuttavia i prodotti di ossidazione sono colorati, e questa è una caratteristica negativa per i materiali.
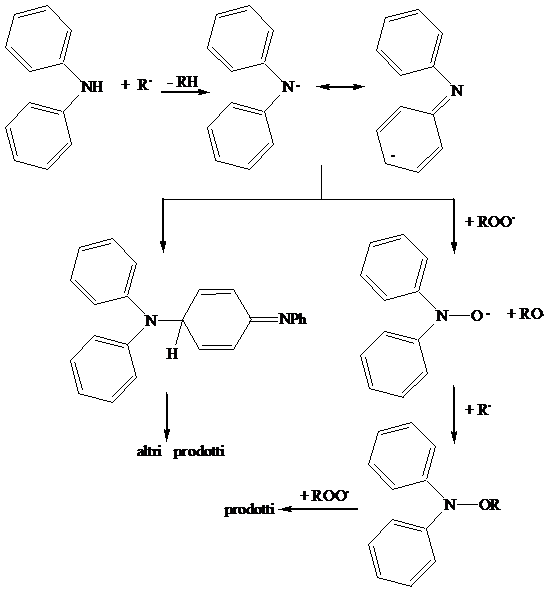

c) Tioli
![]()
In genere, i tioli sono
ottimi idrogeno donatori; i tiil radicali risultanti dimerizzano sa disolòfuro.
Il glutatione (GSH) è uno dei principali a.o. naturali, contenuto a livello
cellulare in concentrazione millimolare.

Ammine stericamente impedite (HALS, Hindered Amines Light Stabilizers)
La più nota è la tetrametilpiperidina che, per effetto della luce, reagisce con l'ossigeno formando un radicale nitrossido stabile, noto come TEMPO (tetramethylpiperidyloxide). Il TEMPO funziona come efficace trappola verso qualsiasi tipo di radicale.

Antiossidanti riducenti
L'autoossidazione produce sempre idroperossidi (ROOH) che, a loro volta, generano radicali che innescano altre catene auto-ossidative (autocatalisi). L'aggiunta di sostanze riducenti, come solfuri (R'2S) o fosfine (R'3P) determina la distruzione riduttiva dei perossidi.
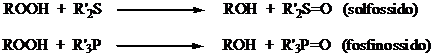
Questi antiossidanti si usano spesse volte in aggiunta a a.o. idrogeno donatori. Si ottiene un effetto sinergico che aumenta grandemente l'efficacia degli a.o.
 |
| Appunti su: acido idrossi oleico prodotti, trappola radicalica, antiossidanti artificiali studentiit, hals chimica antiossidanti, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |