 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2775 | Gradito: |
Leggi anche appunti:Reazioni di ossidoriduzioneReazioni di ossidoriduzione Ossidazione - Un elemento chimico si ossida quando, La legge di BoyleLa legge di Boyle I parametri per definire lo stato di un gas sono: pressione, Pesi atomici e molecolari relativi: l'unitÓ di massa atomicaPesi atomici e molecolari relativi: l'unitÓ di massa atomica Se infatti volumi uguali |
 |
 |
Nel 1923 il chimico danese Johannes Br°nsted e l'inglese Thomas Lowry, indipendentemente l'uno dall'altro, proposero una definizione pi¨ generale di acidi e basi.
Secondo la teoria di Br nsted e Lowry una reazione acido-base consiste dunque nel trasferimento di un protone da un acido ad una base.
![]()
H-A + :B → :A- + H-B+
acido base
E' evidente che la definizione di "acido" data da Arrhenius coincide con quella di Br nsted-Lowry. Tutti gli acidi di Arrhenius sono quindi anche acidi di Br nsted e viceversa.
La definizione di base di Br nsted Ŕ invece pi¨ estensiva. La teoria di Br°nsted e Lowry permette di descrivere come basiche sia la basi di Arrhenius sia sostanze che non possono essere classificate tali dalla teoria di Arrhenius.
Le basi di Arrhenius, come gli idrossidi metallici (BOH), sono anche basi di Br nsted. Pi¨ precisamente la base di Br nsted Ŕ costituita non dall'idrossido metallico, ma dall'anione idrossido (OH-) che si genera in soluzione acquosa dalla dissociazione dell'idrossido. E' infatti l'anione idrossido che acquista uno ione H+.
HCl + OH» → Cl- + H2O
acido base
Ma sostanze come l'ammoniaca e gli ossidi metallici, non classificabili come basi da Arrhenius, sono basi di Br nsted. Le seguenti reazioni sono reazioni acido/base secondo Br nsted.
NH3 + H2O → NH4+ + OH»
ammoniaca acqua Ione ione (base) (acido) ammonio idrossido
H2O + O2- → 2OH»
Acqua ione ossido ione idrossido
(acido) (base)
L'ammoniaca e lo ione ossido sono basi di Br°nsted essendo in grado di acquistare protoni, ma non sono classificabili come basi di Arrhenius.
Inoltre, la teoria di Br nsted-Lowry non considera l'acqua come un composto neutro, ma come un composto anfotero: un acido (in grado di cedere protoni) o una base (in grado di acquistare protoni) a seconda della reazione a cui partecipa.
Nella reazione di dissociazione dell'acido cloridrico, l'acido di Br nsted (HCl) cede un protone all'acqua (base di Br nsted)
HCl + H2O → H3O+ + Cl»
acido base
Nella reazione dell'ammoniaca in acqua, L'acido di Br nsted (H2O) cede un protone all'ammoniaca (base di Br nsted)
NH3 + H2O → NH4+ + OH-
base acido
La teoria di Br nsted-Lowry considera le reazioni come equilibri dinamici fra prodotti e reagenti, introducendo i concetti di coppie coniugate acido/base.
Ogni acido di Br nsted, cedendo uno ione H+, genera una specie chimica che pu˛ rilegarsi ad esso, secondo il concetto dell'equilibrio chimico e quindi della reversibilitÓ delle reazioni. La specie generata Ŕ detta base coniugata dell'acido.
Ogni base di Br nsted, acquistando uno ione H+, genera una specie chimica che pu˛ rilasciarlo, secondo il concetto dell'equilibrio chimico e quindi della reversibilitÓ delle reazioni. La specie generata Ŕ detta acido coniugato della base.
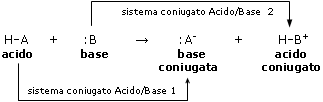
Nella reazione precedente sono presenti le due coppie acido/base
HA/A- e HB+/B
L'acqua che, come abbiamo detto, viene vista come un composto anfotero, potendo sia cedere che acquistare ioni H+, presenta due coppie coniugate acido/base
H3O+ / H2O H2O / OH
acido base acido base
Ovviamente se un acido Ŕ forte, con una elevata tendenza a cedere ioni H+, la sua base coniugata sarÓ debole, manifestando una scarsa tendenza ad acquistare ioni H+ (e viceversa). Vedremo che la forza di un acido o di una base pu˛ essere misurata e risulta inversamente proporzionale alla forza della specie chimica ad essa coniugata.
Nella teoria di Br°nsted-Lowry la forza di un acido o di una base non Ŕ misurabile in assoluto, ma sempre in relazione alla forza di un altro acido o base ed in relazione al solvente in cui avviene la reazione. Viene in tal modo introdotto il concetto di forza relativa di acidi e basi.
In soluzione acquosa, ad esempio, la forza di un acido o di una base viene misurata proprio in relazione alla forza dell'acqua, cioŔ alla tendenza che l'acqua manifesta a cedere ed acquistare ioni H+.
L'acqua si dissocia debolmente in ioni H+ e ioni OH» secondo il seguente equilibro (autoprotolisi)
H2O + H2O ![]() OH» + H3O+
OH» + H3O+
acido base base acido
coniugata coniugato
La reazione pu˛ essere interpretata come una reazione acido-base di Br°nsted, in cui la prima molecola d'acqua (che si comporta da acido) cede uno ione H+ alla seconda molecola d'acqua (che si comporta da base). Lo ione ossidrile (OH») sarÓ allora la base coniugata dell'acido H2O, mentre lo ione idronio (H3O+) sarÓ l'acido coniugato della base H2O.
A 25░C la costante di questo equilibrio vale
![]()
Il valore estremamente piccolo di questa costante ci permette di affermare che l'equilibrio Ŕ praticamente tutto spostato verso sinistra e che l'acqua si dissocia in misura trascurabile. La concentrazione di acqua che non si Ŕ dissociata all'equilibrio Ŕ pertanto praticamente uguale alla concentrazione (costante) dell'acqua pura indissociata (55,55 mol/l). Moltiplicando entrambi i membri dell precedente relazione per la concentrazione dell'acqua pura si ottiene un valore che misura la tendenza di una molecola d'acqua a perdere uno ione H+ e quindi una misura della sua aciditÓ. Tale valore Ŕ detto ka (kappa acida). Il logaritmo naturale negativo della ka Ŕ detto pka = - ln (ka).
![]()
pka = 15,74
Naturalmente lo stesso ragionamento pu˛ essere fatto anche per misurare la tendenza dell'altra molecola d'acqua ad acquistare ioni H+. In tal modo si misura la basicitÓ dell'acqua. Tale valore Ŕ detto kb (kappa basica). Il logaritmo naturale negativo della kb Ŕ detto pkb = - ln (kb).
![]()
pkb = 15,74
Nel caso dell'acqua Ŕ utile introdurre anche un'ulteriore costante correlata al suo equilibrio di dissociazione, detta prodotto ionico dell'acqua (kw), che si ottiene moltiplicando ulteriormente entrambi i membri per la concentrazione dell'acqua pura.
![]()
pkw = 14
Definiamo ora la forza di un acido HA, misurando la sua tendenza a cedere ioni H+ all'acqua (forza dell'acido relativa all'acqua: coppia acido/base = H3O+/H2O).
HA + H2O ![]() A» + H3O+
A» + H3O+
acido base
La costante di equilibrio sarÓ
![]()
Ed analogamente a quanto abbiamo fatto per misurare l'aciditÓ dell'acqua, definiamo anche per esso la ka, inglobando la concentrazione dell'acqua nella costante di equilibrio
![]()
Ovviamente tanto pi¨ elevato sarÓ il valore della ka (e tanto pi¨ piccolo il pka), tanto pi¨ l'equilibrio sarÓ spostato verso destra, tanto maggiore sarÓ la tendenza dell'acido a donare ioni H+ all'acqua e tanto pi¨ elevata sarÓ la sua forza.
Definiamo ora la basicitÓ della sua base coniugata (A-), misurando la sua tendenza ad acquistare ioni H+ dall'acqua (forza della base coniugata relativa all'acqua: coppia acido/base = H2O/OH-).
A» + H2O ![]() HA + OH»
HA + OH»
base acido
La costante di equilibrio sarÓ
![]()
Ed analogamente a quanto abbiamo fatto in precedenza, definiamo anche per esso la kb, inglobando la concentrazione dell'acqua nella costante di equilibrio
![]()
Moltiplicando ora numeratore e denominatore per la concentrazione degli ioni idronio, otteniamo, la relazione esistente tra la kappa acida di un acido e la kappa basica della sua base coniugata.
![]()
Dunque per un acido e la sua base coniugata vale la relazione
kw = 10-14 = ka Ě kb.
E, passando ai logaritmi vale
pKa(AH) + pKb(A ) = pKW =14
Le rispettive costanti di dissociazione acida e basica sono dunque inversamente proporzionali. Pi¨ forte Ŕ un acido e pi¨ debole Ŕ la sua base coniugata. Inoltre, dato il pKa di un acido, risulta automaticamente definito il pKb della sua base coniugata.
Ovviamente la medesima dimostrazione pu˛ essere fatta per una base ed il suo acido coniugato.
Tornando all'equilibrio di dissociazione dell'acqua e ricordando che per l'acqua ka = kb = 15,74 potremo affermare che la base coniugata OH» avrÓ un pkb = 14 - 15,74 = -1,74, uguale al pka dell'acido coniugato H3O+.
Si pu˛ inoltre verificare come, in un equilibrio di Br°nsted, i valori delle costanti di dissociazione delle due coppie acido/base, siano correlate alla costante complessiva dell'equilibrio.
Consideriamo ad esempio un generico acido HA che reagisca con una generica base B secondo il seguente equilibrio
HA + B ![]() A- + BH+
A- + BH+
acido base baseC acidoC
(Ka)ááááááááááá (Kb) (Kbc) (Kac)
la sua costante di equilibrio vale
![]()
moltiplicando ora numeratore e denominatore per il prodotto ionico dell'acqua [H3O+][OH-] si ottiene
![]()
La costante di equilibrio Ŕ dunque direttamente proporzionale al prodotto della costante di dissociazione acida e della costante di dissociazione basica dei reagenti. Questo significa che, se i reagenti sono un acido ed una base forti (costanti di dissociazione elevate), la costante di equilibrio Ŕ elevata e la reazione Ŕ spostata verso destra (verso i prodotti). Se invece i reagenti sono un acido ed una base deboli la costante Ŕ piccola e l'equilibrio Ŕ spostato verso sinistra (verso i reagenti).
Ricordando poi che l'acido coniugato della base che reagisce ha una kappa acida (Kac) pari a Kw/kb, la costante di equilibrio pu˛ essere anche calcolata come il rapporto tra la ka dell'acido che reagisce e la ka dell'acido che si forma (Kc= ka/Kac). E, passando ai logaritmi
pK = pka - pkac
Possiamo dunque affermare che la direzione dell'equilibrio di una reazione di Br°nsted sarÓ dettata dalle forze relative degli acidi e delle basi delle due coppie coniugate e sarÓ sempre favorito l'accumulo dell'acido e della base pi¨ debole.
In una reazione di Br°nsted vale il principio che un acido pi¨ forte reagisce con una base pi¨ forte per dare un acido pi¨ debole ed una base pi¨ debole. L'equilibrio della reazione Ŕ sempre spostato dalla parte delle specie pi¨ deboli.
Se ad esempio vogliamo prevedere l'efficienza della reazione di trasformazione dell'acido acetico CH3COOH nella sua base coniugata, l'anione acetato CH3COO», da parte dello ione idrossido, secondo la reazione
CH3COOH + OH» ![]() CH3COO» + H2O
CH3COO» + H2O
sarÓ sufficiente confrontare l'aciditÓ del acido acetico (pka = 4,74) con quella dell'acqua (pka = 15,74) acido coniugato della base OH-. La differenza dei due valori di pk Ŕ uguale a pk = 4,74 - 15,74 = -11. Un pk basso corrisponde ad una costante di equilibrio elevata, pari a 1Ě1011. L'equilibrio Ŕ dunque completamente spostato verso destra. Trattando l'acido acetico con lo ione idrossido Ŕ quindi possibile ottenere l'anione acetato in maniera quantitativa.
La teoria di Br nsted e Lowry descrive come reazioni acido-base reazioni che sono classificate in modo diverso nella teoria di Arrhenius. Abbiamo giÓ detto che la reazione di dissociazione dell'acqua pu˛ essere descritta come una reazione acido-base.
Una reazione di dissociazione acida secondo Arrhenius, diventa una reazione acido-base secondo Br nsted. L'acido di Br nsted (HNO3) cede un protone all'acqua (base di Br nsted)
HNO3 + H2O → H3O+ + NO3-
acido base
Una reazione di idrolisi salina secondo Arrhenius, diventa una reazione acido/base secondo Br nsted. Si veda ad esempio la seguente reazione di idrolisi basica dell'ipoclorito di sodio. in cui l'acido di Br nsted (H2O) cede un protone all'anione ipoclorito ClO» (base di Br nsted).
H2O + ClO- → OH- + HClO
acido base
Cosý la costante di idrolisi kh = kw/ka non Ŕ altro che la kb della base coniugata (anione ipoclorito) dell'acido debole (acido ipocloroso) che forma il sale.
Anche il calcolo del pH in una soluzione tampone pu˛ essere fatto in termini di coppia coniugata acido/base. Ad una soluzione tampone formata da un acido debole HA e da un suo sale A-, si applica la relazione di Henderson-Hasselbach
![]() o
o ![]()
ottenuta dalla relazione di equilibrio dell'acido debole
![]()
Ma A- non Ŕ altro che la base coniugata dell'acido HA e la relazione di Henderson-Hasselbach diventa
![]()
La relazione di Henderson Hasselbach, in questa sua forma pi¨ generale, pu˛ essere applicata a qualsiasi sistema tampone, anche quelli formati da una base debole con un suo sale.
Si prenda ad esempio un tampone formato da ammoniaca (NH3) e cloruro di ammonio (NH4Cl)
NH3 + H2O ![]() NH4+ + OH-
NH4+ + OH-
NH4Cl → NH4+ + Cl-
Dalla relazione di equilibrio dell'ammoniaca (equilibrio completamente spostato verso sinistra per la presenza del suo sale di ammonio), si ricava l'equazione di Henderson-Hasselbach per il calcolo del pOH
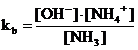
da cui
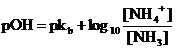
Ma lo ione ammonio NH4+ non Ŕ altro che l'acido coniugato della base debole NH3 e per la coppia coniugata acido/base vale la relazione
![]()
che, sostituita nella relazione di equilibrio dell'ammoniaca, fornisce
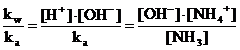
e quindi
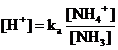
la quale ci permette infine di calcolare la relazione di Henderson-Hasselbach
![]()
In definitiva tutti i sistemi tampone sono costituiti da una coppia coniugata acido-base e la relazione di Henderson-Hasselbach pu˛ sempre essere utilizzata nella sua forma generale
![]()
La teoria di Br nsted e Lowry risulta pi¨ generale rispetto a quella di Arrehnius anche perchÚ pu˛ essere applicata a soluzioni non acquose.
Ad esempio, in soluzione ammoniacale, lo ione ammonio (acido di Br nsted) pu˛ donare un protone allo ione ioduro (base di Br nsted) per dare ammoniaca e acido iodidrico
NH4+(am) + I-(am) → NH3 (l) + HI (am)
Le reazioni di neutralizzazione in solventi non acquosi procedono come nell'acqua. In ammoniaca, ad esempio, il protone solvatato (corrispondente acquoso dello ione idronio H3O+) Ŕ lo ione ammonio NH4+, mentre il corrispondente dello ione idrossido Ŕ l'anione NH2-.
Tutte le reazioni di neutralizzazione in soluzione ammoniacale possono essere pertanto ricondotte alla reazione
NH4+(am) + NH2-(am) → 2NH3 (l)
La teoria di Br nsted-Lowry rimane valida anche per reazioni che decorrono in fase gassosa, in assenza di un solvente.
Ad esempio, l'acido cloridrico gassoso (acido di Br nsted) pu˛ donare protoni all'ammoniaca gassosa (base di Br nsted) per dare una nube di particelle solide di cloruro di ammonio.
HCl (g) + NH3 (g) → NH4Cl (s)
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicaacidi-e-basi-secondo-brnsted43php, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |