 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2455 | Gradito: |
Leggi anche appunti:La struttura della materia: atomi ed elementiLa struttura della materia: atomi ed elementi Le prime ipotesi sulla struttura Il Processo DryIl Processo Dry Il primo processo di realizzazione della doppia giunzione Nomenclatura composti inorganiciNomenclatura composti inorganici Tabella con i primi 100 elementi chimici (Z |
 |
 |
Il numero dei sottolivelli prodotto dall'introduzione delle orbite ellittiche non era comunque ancora sufficiente a giustificare tutta la ricchezza della struttura fine dello spettro.
Fin dal 1896 era noto che quando una sorgente luminosa viene sottoposta ad un campo magnetico, le righe spettrali vengono ulteriormente scomposte in diverse componenti (effetto Zeeman
Il fenomeno può essere spiegato osservando che un'orbita elettronica si comporta come una spira percorsa da corrente elettrica e, come previsto da Ampere nel 1820, produce un momento magnetico che dipende dal suo momento angolare.
Poiché il momento angolare è quantizzato anche il momento magnetico lo è.
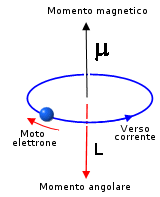
Si dimostra che il momento magnetico è sempre multiplo di una quantità minima detta magnetone di Bohr (b)[1]
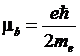
Ora è possibile dimostrare che una stessa orbita sottoposta ad un campo magnetico esterno può orientare il suo vettore momento magnetico solo in alcune direzioni, diversificando il suo contenuto energetico e dando perciò luogo ad ulteriori sottolivelli. Il numero delle direzioni consentite viene espresso dal cosiddetto numero quantico magnetico m che può assumere solo i valori interi compresi tra -l e + l.
-l m +l
In effetti tali sottolivelli vengono solamente resi più evidenti dall'effetto Zeeman. Essi esistono normalmente nell'atomo poiché le orbite elettroniche sono sottoposte al campo magnetico prodotto dal nucleo carico positivamente.
se l = 0 (orbita circolare s) m = 0
ciò significa che sottoposta ad un campo magnetico esterno un'orbita circolare dà luogo ad un'unica orientazione. Avremo perciò una sola orbita circolare di tipo s.
se l = 1 (orbita ellittica di tipo p) m può assumere i valori +1 0 -1
ciò significa che tale orbita può orientarsi in tre modi diversi producendo tre sottolivelli a differente energia. Avremo perciò 3 orbite di tipo p, indicate ciascuna con un diverso valore di m.
se l = 2 (orbita ellittica di tipo d) m può assumere i valori +2 +1 0 -1 -2
ciò significa che questo tipo di orbita ellittica può orientarsi in 5 modi differenti producendo quindi 5 sottolivelli a differente energia. Avremo perciò 5 orbite di tipo d, indicate ciascuna con un diverso valore di m.
se l = 3 (orbita ellittica di tipo f) m può assumere i valori +3 +2 +1 0 -1 -2 -3 ( ciò significa che questo tipo di orbita può orientarsi in 7 modi diversi, producendo 7 sottolivelli a differente energia. Avremo perciò 7 orbite di tipo f, indicate ciascuna con un diverso valore di m.
In pratica il valore del numero quantico magnetico determina il numero di orbite di una certa forma presenti in ciascun livello energetico principale.
Spesso il magnetone di Bohr viene misurato utilizzando
il sistema cgs elettromagnetico. In tal caso, per convertire la carica
dell'elettrone, espressa in unità elettrostatiche (1 ues = statC = 1franklin),
nelle corrispondenti unità elettromagnetiche (abcoulomb), è necessario
dividerla per c, velocità della luce (1 abC = 10 C = c statC, con c = 3 1010
cm/s)) . La relazione diventa ![]() . Il
magnetone di Bohr vale nel sistema SI
9,2740155.10-24 J T-1, nel sistema cgsem
9,2740155.10-21 erg G-1 e nel sistema cgses 2,7802799.10-10
erg statT-1.
. Il
magnetone di Bohr vale nel sistema SI
9,2740155.10-24 J T-1, nel sistema cgsem
9,2740155.10-21 erg G-1 e nel sistema cgses 2,7802799.10-10
erg statT-1.
 |
| Appunti su: effetto zeeman e numero quantico magnetico, |
|
| Appunti Biologia |  |
| Tesine Geografia |  |
| Lezioni Ingegneria tecnico |  |