 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 6081 | Gradito: |
Leggi anche appunti:Processi di recupero o rimozione CromoProcessi di recupero o rimozione Cromo 1.1 La concia al cromo La Legge di stevinoLEGGE DI STEVINO OBIETTIVO: dimostrare che la pressione nei MonosaccaridiMonosaccaridi Pur senza essere il capostipite, il glucosio è il monosaccaride |
 |
 |
Se anche le molecole perfettamente apolari come O2 e Cl2 sono in grado di liquefare e solidificare a temperature superiori allo zero assoluto, evidentemente devono esistere anche per tali sostanze delle forze intermolecolari, seppur molto deboli, in grado di vincere l'agitazione termica.
Si ritiene che tali forze, dette forze di London o forze di dispersione, siano dovute a fluttuazioni temporanee e casuali nella distribuzione di densità degli orbitali. In una molecola apolare la nuvola elettronica è "in media" distribuita in modo omogeneo, ma in un determinato istante questo può non essere vero e gli elettroni possono casualmente e temporaneamente essere addensati a formare un dipolo istantaneo (o dipolo momentaneo o dipolo temporaneo).

Piccole fluttuazioni nella distribuzione delle nuvole elettroniche dovrebbero essere dunque in grado di produrre momentanee polarità anche nelle molecole apolari capaci di indurre nelle molecole adiacenti polarità di segno contrario (dipolo indotto), creando in definitiva le condizioni per un'attrazione reciproca. London coniò il termine "effetto di dispersione" poiché le fluttuazioni casuali degli elettroni da cui dipendono le forze di London sono analoghe a quelle che nei modelli quantomeccanici descrivono i fenomeni di dispersione (diffusione) della luce.
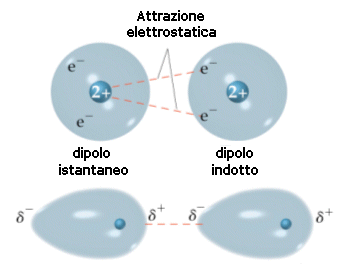
Se si considera la media nel tempo, la nuvola elettronica di un atomo è perfettamente simmetrica, ma in un dato istante può addensarsi maggiormente da un lato ed in un istante immediatamente successivo può spostarsi all'altra estremità. Ciò determina la comparsa di un momento di dipolo elettrico istantaneo variabile nel tempo e mediamente nullo. Ciascun dipolo istantaneo genera un campo elettrico che polarizza le particelle circostanti, creando dei "dipoli indotti" variabili continuamente. Tra il dipolo "induttore" e il dipolo "indotto" nascono così forze di attrazione.
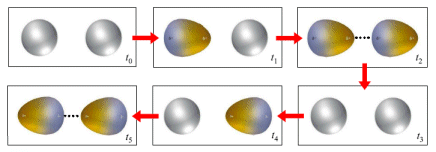
L'intensità delle forze di London dipende ovviamente solo dalla polarizzabilità delle molecole. Molecole più grandi e massicce (con elettroni superficiali meno legati) risentono in misura maggiore delle forze di London. Ad esempio, a temperatura ambiente, mentre F2 e Cl2 sono gassosi, Br2 è liquido e I2 è solido.

Per due molecole apolari aventi polarizzazione 1ed2 a distanza r l'energia di London è
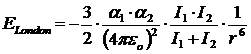
dove
I = hn è l'energia di ionizzazione
con
h = costante di Planck = 6.626 10-34 J s
n = frequenza principale di assorbimento della molecola
Per due molecole identiche la relazione diventa
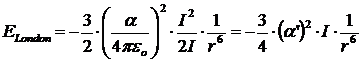
Nel caso di due molecole di metano, ad esempio, con α' = 2.6·10-30 m3 e I = 7 eV (= 1,12·10-18 J) l'energia di dispersione alla distanza di 0.3 nm (= 3·10-10 m) è di
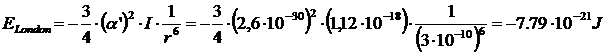
L'energia di London per una mole si ottiene moltiplicando il risultato precedente per il numero di Avogadro N= 6.022 1023 mol-1.
- 7,79·10-21 x 6.022·1023 = - 4690 J mol-1 = - 4,69 kJ mol-1
Le forze di London sono universali, essendo presenti anche in tutti i tipi di atomi e molecole e, nella maggior parte dei casi, costituiscono la componente prevalente delle forze di van der Waals anche in molecole polari. Affinché le interazioni dipolo-dipolo (forze di Keesom) inizino ad essere significative prevalenti rispetto alle forze di London è infatti necessario che le molecole siano di piccole dimensioni (poco polarizzabili) ed abbiano un momento di dipolo superiore ad 1 D (esempi tipici sono l'acqua e l'ammoniaca). Le forze di induzione (forze di Debye) risultano invece per lo più trascurabili.
|
|
(10-30 C m) |
m3) |
En Ionizz. (eV) |
Keesom (orientazione) kJ mol-1 |
Debye (induzione) kJ mol-1 |
London (dispersione) kJ mol-1 |
|
Ar |
|
|
|
|
|
|
|
CO |
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
HBr |
|
|
|
|
|
|
|
HI |
|
|
|
|
|
|
|
NH3 |
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
Valori calcolati a 25°C per una distanza intermolecolare di 0,3 nm (3 Å) |
||||||
 |
|
| Appunti Geografia |  |
| Tesine Biologia |  |
| Lezioni Ingegneria tecnico |  |