 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3448 | Gradito: |
Leggi anche appunti:La struttura interna dell'atomoLa struttura interna dell'atomo I primi indizi sull'esistenza di una struttura La materia intorno a noiLA MATERIA INTORNO A NOI 1. GLI STATI FISICI DELLA MATERIA E' materia Equilibri chimici omogenei ed eterogeneiEquilibri chimici omogenei ed eterogenei Si parla di equilibri in fase omogenea |
 |
 |
Le molecole polari, o dipoli permanenti (molecole dotate di un momento di dipolo ), esercitano naturalmente una reciproca attrazione elettrostatica. Quando le molecole dipolari si avvicinano tendono infatti a disporsi con i poli di carica opposta l'uno di fronte all'altro, al fine di rendere minima l'energia potenziale del sistema (configurazione di maggior stabilità). In tal modo si verifica un'attrazione elettrostatica tra i poli opposti, detta interazione dipolo-dipolo.
Le forze di Keesom agiscono dunque tramite un effetto di orientazione.
Le interazioni dipolo-dipolo non sono molto efficienti finché le molecole si trovano allo stato aeriforme poiché le distanze intermolecolari sono troppo elevate. Finché la temperatura è sufficientemente elevata e/o la pressione bassa, l'energia cinetica media dei dipoli è in grado di vincere tali interazioni, mantenendo la sostanza allo stato aeriforme. Ma all'abbassarsi della temperatura e/o all'aumentare della pressione, le distanze intermolecolari diminuiscono e l'energia cinetica media delle molecole finisce per diventare minore delle interazioni dipolari. In queste condizioni tali forze sono in grado di mantenere adese le molecole favorendo il passaggio ad una fase condensata (liquida o solida). Inizialmente si ha il passaggio allo stato liquido e, se la temperatura scende ulteriormente (o la pressione aumenta), le forze di Keesom sono in grado di bloccare le molecole in posizioni di equilibrio all'interno di un reticolato solido.

Interazioni dipolo-dipolo tra molecole polari allo stato solido
Le interazioni dipolo-dipolo sono ovviamente tanto più intense quanto maggiore è il momento di dipolo ed iniziano a diventare importanti per valori di superiori ad 1 D. La loro intensità decresce all'aumentare della temperatura, poiché una maggior agitazione termica interferisce con l'allineamento dei dipoli.
Per due dipoli liberi di ruotare (liquido o aeriforme) di momento 1ed2 a distanza r l'energia di Keesom è
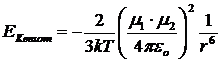
con
k = costante di Boltzmann = 1,38 10-23 J K-1
εo = costante delettrica del vuoto = 8,854 10-12 C2 m-2 N-1
T = temperatura assoluta
Ad esempio, a 25°C l'energia di interazione per una coppia di molecole con μ = 1 D (= 3,336 10-30 C m) alla distanza di 0.3 nm (= 3 10-10 m) è di
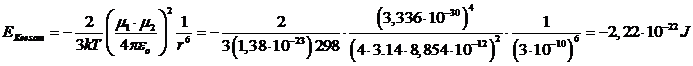
L'energia di Keesom per una mole si ottiene moltiplicando il risultato precedente per il numero di Avogadro N = 6.022 1023 mol-1.
- 2,22 10-22 x 6.022 1023 = - 1340 J mol-1 = - 1,34 kJ mol-1
Per due dipoli stazionari (all'interno di un solido) l'energia di Keesom risulta inversamente proporzionale alla terza potenza della distanza r e dipende dall'orientazione reciproca (angoli θ e φ).
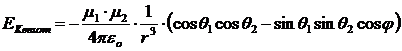
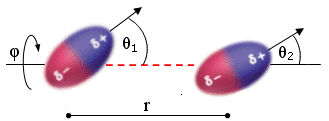
Quando il dipolo è costituito da un atomo di idrogeno legato con legame covalente fortemente polare ad un elemento molto elettronegativo (F, O, N), il legame dipolo-dipolo è particolarmente intenso e viene chiamato legame a idrogeno (o ponte idrogeno). I legami a idrogeno presentano energie tipiche superiori (20 - 50 kJmol-1) rispetto ai normali legami dipolo-dipolo.
Il legame a idrogeno viene rappresentato con una breve linea tratteggiata che unisce l'idrogeno di una molecola con l'elemento elettronegativo di un'altra.
Tipici composti in grado di dare intensi legami a idrogeno sono l'acido fluoridrico HF, l'acqua H2O e l'ammoniaca NH3.
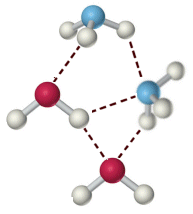
Legami a idrogeno tra molecole d'acqua e ammoniaca
L'esistenza di tale legame aumenta notevolmente la coesione interna tra le molecole, al punto da riflettersi in modo evidente su alcune proprietà fisiche delle sostanze interessate.
Ad esempio tutti i composti le cui molecole sono interessate dai legami a idrogeno presentano temperature di ebollizione e capacità termiche particolarmente elevate.
Se infatti forniamo calore ad una sostanza produciamo un aumento della sua energia cinetica media (½mv²).
E' allora evidente che a parità di calore fornito l'aumento di velocità sarà minore per le molecole più massicce. Poiché inoltre una sostanza è in grado di passare allo stato di vapore quando le sue molecole sono sufficientemente veloci, dobbiamo attenderci che la temperatura di ebollizione di un composto sia tanto maggiore quanto maggiore è il suo peso molecolare.
Tale previsione è verificabile osservando ad esempio i composti dell'idrogeno con gli elementi del VII gruppo A, dove il punto di ebollizione diminuisce costantemente al diminuire del peso molecolare, con la notevole eccezione dell'acido fluoridrico.
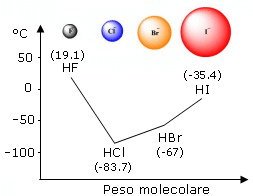
In questo caso infatti, nonostante il basso peso molecolare, la temperatura di ebollizione risulta particolarmente elevata in quanto per poter passare allo stato di vapore le molecole devono possedere un'energia cinetica molto elevata per rompere i legami a idrogeno che le tengono adese.
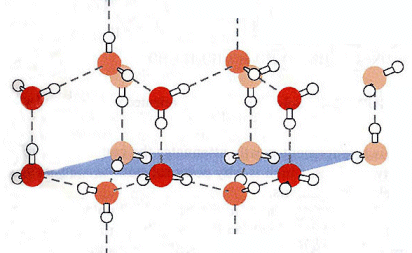
La presenza del legame a idrogeno spiega anche perchè il ghiaccio sia meno denso dell'acqua. Infatti quando l'acqua si solidifica i legami a idrogeno tendono a bloccare le molecole in una struttura esagonale ordinata che risulta meno densa della struttura disordinata caratteristica dell'acqua liquida.
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicaforze-di-keesom-o-interazioni-64php, forze di keesom, acqua keesom, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |