 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 3262 | Gradito: |
Leggi anche appunti:Diffusione ed entropiaDiffusione ed entropia La diffusione è dunque un movimento spontaneo delle Calcolo delle concentrazioni delle specie chimiche di un tampone a pH notoCalcolo delle concentrazioni delle specie chimiche di un tampone a pH noto Consideriamo Caratterizzazione dell'Attacco in KOHCaratterizzazione dell'Attacco in KOH In questo lavoro di tesi è stato |
 |
 |
Le forze di Debye si originano tra molecole polari e molecole apolari. Per comprendere tali interazioni è necessario esaminare ciò che accade ad una molecola (o un atomo) apolare quando viene posta in un campo elettrico E.
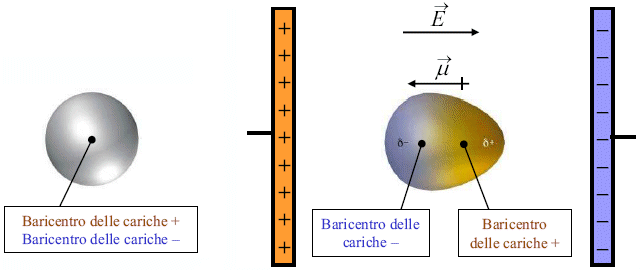
a) molecola non polarizzata b) Polarizzazione in un campo elettrico E
La nuvola elettronica della molecola viene deformata ed attratta dal polo positivo. Il campo elettrico induce dunque una separazione di carica con formazione di un dipolo indotto. L'intensità del momento di dipolo indotto è direttamente proporzionale all'intensità E del campo elettrico applicato.
= E
La costante di proporzionalità è detta polarizzabilità. Il valore della polarizzabilità è caratteristico per ciascun atomo o molecola ed è una misura della facilità con cui la nuvola elettronica può essere deformata (polarizzata) da un campo elettrico.
L'unità di misura della polarizzabilità nel Sistema Internazionale è C·m2·V-1.
Spesso invece della polarizzabilità si usa il volume di polarizzabilità α', definito da:
![]()
dove εo è la costante dielettrica del vuoto.
ha le dimensioni di un volume. L'unità di misura utilizzata nella pratica comune per esprimere il suo valore è il cm3 o Å3.
La polarizzabilità dipende dalla forza con cui gli elettroni esterni sono vincolati al nucleo (minore è l'energia di ionizzazione, maggiore è la polarizzabilità). In altre parole, la nuvola elettronica è tanto più facilmente polarizzabile quanto minore è la forza di attrazione che il nucleo esercita su di essa. La polarizzabilità aumenta all'aumentare della massa e delle dimensioni della molecola.
Quando una molecola polare si avvicina ad una non polare induce in quest'ultima un dipolo eletrico di minore intensità (effetto di induzione) che perdura fintanto che le due molecole restano vicine. Si genera così un'attrazione dipolo permanente-dipolo indotto . L'intensità è proporzionale al momento del dipolo permanente che induce la polarizzazione e alla polarizzabilità della seconda molecola.
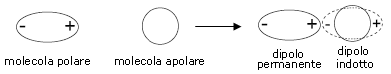
catione
Per un dipolo di momento ed una molecola apolare di polarizzazione a distanza r l'energia di Debye è
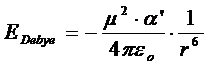
con εo = costante delettrica del vuoto = 8,854 10-12 C2 m-2 N-1
Ad esempio, a 25°C l'energia di interazione per un dipolo (ad esempio HCl) con μ = 1 D (= 3,336 10-30 C m) ed una molecola apolare (ad esempio il benzene) con polarizzazione ' = 10-23 cm3 (= 10-29 m3) alla distanza di 0.3 nm (= 3 10-10 m) è di
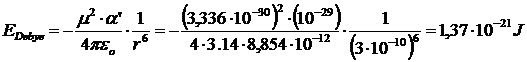
L'energia di Debye per una mole si ottiene moltiplicando il risultato precedente per il numero di Avogadro N= 6.022 1023 mol-1.
- 1,37 10-21 x 6.022 1023 = - 820 J mol-1 = - 0,82 kJ mol-1
 |
| Appunti su: polarizzazione per deformazione, https:wwwappuntimaniacomscientifichechimicaforze-di-debye-o-interazioni-d14php, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |