 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2450 | Gradito: |
Leggi anche appunti:Equilibrio di solubilità, idrolisi e pHEquilibrio di solubilità, idrolisi e pH Il calcolo della solubilità di un La legge di proustLA LEGGE DI PROUST Materiale: bunsen - polvere di rame (Cu) - ossigeno (O) Reazioni di secondo ordine (cinetiche di secondo ordine)Reazioni di secondo ordine (cinetiche di secondo ordine) Presentano una cinetica |
 |
 |
Ossidi e anidridi reagiscono con l'acqua per dare due importanti classi di composti ternari, gli idrossidi e gli acidi ossigenati o ossiacidi, i quali oltre a contenere ossigeno contengono evidentemente anche idrogeno.
Gli acidi sono sostanze che, sciolte in acqua, tendono a dissociarsi in un anione e in uno o più ioni H
Gli idrossidi sono sostanze a carattere basico che, sciolte in acqua, tendono a dissociarsi in un catione e in uno o più anioni ossidrile OH
Un composto ternario che contenga idrogeno e ossigeno viene convenzionalmente scritto in modo diverso a seconda che presenti un carattere acido o basico.
Se si tratta di un acido vengono messi in evidenza gli atomi di idrogeno, scrivendo per primo l'idrogeno seguito dal simbolo chimico del non metallo X ed infine dall'ossigeno.
ACIDO HnXmOl
se si tratta di un idrossido vengono messi in evidenza i gruppi ossidrili, scrivendo per primo il simbolo dell'elemento metallico Y seguito da tanti gruppi ossidrili racchiusi tra parentesi tonde, quanti ne richiede il numero di ossidazione 'n' del metallo.
IDROSSIDO Y(OH)n
Alcuni composti possono comportarsi come acido o come base, a seconda delle condizioni di reazione. Sono detti composti anfoteri e la loro formula chimica può essere scritta come quella di un acido o come quella di un idrossido in realazione alla particolare comportamento che presentano in una data reazione.
Gli acidi si formano sommando una o più molecole d'acqua ad un'anidride
Anidride + acqua = Acido
Il carattere acido di queste sostanze, cioè la loro tendenza a liberare ioni H+, è legato alla presenza nella molecola di un non metallo, un elemento elettronegativo che attirando gli elettroni di legame li allontana dagli atomi di idrogeno. Sugli atomi di idrogeno si forma una parziale, ma intensa carica positiva che ne facilita la liberazione come ioni H+, una volta in acqua.
Il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine 'acido' al termine 'anidride'
Per costruire un acido è sufficiente sommare all'anidride 2 atomi di idrogeno e 1 di ossigeno per ogni molecola d'acqua che viene aggiunta.
Ad esempio dall'anidride carbonica si ottiene l'acido carbonico
CO2 + H2O → H2CO3
mentre dall'anidride nitrica si ottiene l'acido nitrico
N2O5 + H2O → H2N2O6 → 2HNO3
Forza di un acido
Un acido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in anioni e ioni H+, si dice debole quando è poco dissociato. La forza di un acido si può prevedere in linea di massima, osservando il numero di atomi di idrogeno e di ossigeno presenti nella sua molecola. Un acido può ritenersi forte quando la differenza tra il numero di atomi di ossigeno ed il numero di atomi di idrogeno è uguale o maggiore di due, debole in caso contrario. Così mentre l'acido carbonico è debole, l'acido nitrico è forte.
Dissociazione di un acido
Un acido con un solo atomo di idrogeno è detto monoprotico, con due biprotico etc.
Una acido monoprotico come l'acido nitrico si dissocia in acqua
HNO3 → H+ + NO3-
un acido poliprotico presenta invece tante dissociazioni quanti sono gli atomi di idrogeno contenuti nella sua molecola. L'acido carbonico ad esempio può dare due dissociazioni
H2CO3 → H+ + HCO3-
HCO3- → H+ + CO32-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
H2CO3 → 2H+ + CO32-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo, tenendo presente che non tutte le reazioni che scriveremo tra anidride e acqua possono effettivamente avvenire. Esse ci servono unicamente per ottenere la formula corretta dei diversi acidi. Si tenga inoltre presente che non tutte le anidridi e non tutti gli acidi che scriveremo sono stati effettivamente isolati. Alcuni sono solo teorici e ci servono per poter poi costruire correttamente le formule dei composti salini che da essi derivano.
|
VII gruppo A |
Il Cloro con i numeri di ossidazione +1, +3, +5 e +7 forma i seguenti acidi
Cl2O + H2O → H2Cl2O2 → 2HClO acido ipocloroso (esiste solo in soluzione)
Cl2O3 + H2O → H2Cl2O4 → 2HClO2 acido cloroso (esiste solo in soluzione)
Cl2O5 + H2O → H2Cl2O6 → 2HClO3 acido clorico (esiste solo in soluzione)
Cl2O7 + H2O → H2Cl2O8 → 2HClO4 acido perclorico
Il Bromo con i numeri di ossidazione +1 e +5 forma i seguenti acidi
Br2O + H2O → H2Br2O2 → 2HBrO acido ipobromoso
Br2O5 + H2O → H2Br2O6 → 2HBrO3 acido bromico
Lo Iodio con i numeri di ossidazione +1, +5 e +7 forma i seguenti acidi
I2O + H2O → H2I2O2 → 2HIO acido ipoiodoso (teorico, esistono i suoi sali)
I2O5 + H2O → H2I2O6 → 2HIO3 acido iodico
I2O7 + H2O → H2I2O8 → 2HIO4 acido periodico
|
VI gruppo A |
Lo zolfo con i numeri di ossidazione +4 e +6 forma i seguenti acidi
SO2 + H2O → H2SO3 acido solforoso (esiste solo in soluzione)
SO3 + H2O → H2SO4 acido solforico
Altri acidi dello zolfo
a partire dal protossido di zolfo con numero di ossidazione +2 si ottengono 2 diversi acidi
SO + H2O → H2SO2 acido solfossilico (teorico, esistono i suoi sali)
2SO + H2O → H2S2O3 acido tiosolforico (teorico, esistono i suoi sali chiamati erroneamente iposolfiti). Il nome rimanda al fatto che la sua struttura chimica è analoga a quella dell'acido solforico, dove un atomo di ossigeno è stato sostituito da uno di zolfo (il radicale S2- si indica con il suffisso tio-).
A partire dal sesquiossido di zolfo con nox +3 si ottiene
S2O3 +H2O → H2S2O4 acido iposolforoso (o idrosolforoso) (esiste solo in soluzione)
Per reazione tra due molecole di acido solforoso, con perdita di una molecola d'acqua si ottiene
2H2SO3 → H2S2O5 +H2O acido pirosolforoso (teorico, esistono solo i suoi sali)
Per reazione tra due molecole di acido solforico, con perdita di una molecola d'acqua si ottiene
2H2SO4 → H2S2O7 +H2O acido pirosolforico o disolforico
Lo zolfo presenta inoltre, con nox +6, due perossidi tipo acqua ossigenata, che sarebbe opportuno chiamare peranidridi, S2O7 e SO4, le cui formule di struttura potrebbero essere
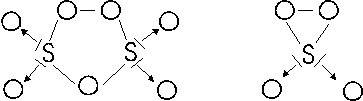
tali composti possono dare due peracidi o perossiacidi (acidi in cui è presente il gruppo O O
S2O7 + H2O → H2S2O8 acido dipersolforico
SO4 + H2O → H2SO5 acido monopersolforico
Lo zolfo è infine in grado di dare legami S S simili a quelli dell'ossigeno nei perossidi, formando quindi dei persolfuri. Tale caratteristica è ancora più spiccata nello zolfo in quanto esso è in grado di dare anche catene formate da più atomi. Sono noti due persolfuri d'idrogeno: analogo all'acqua ossigenata esiste H S S H e anche H S S S H i due composti sono noti rispettivamente come:
H2S2 disolfuro d'idrogeno H2S3 trisolfuro d'idrogeno
Sfruttando lo stesso tipo di legame tra atomi zolfo si forma anche una famiglia di acidi politionici, di formula generale H2SxO6, dove x = 2, 3, 4, 5,.. con formula di struttura
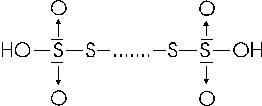
essi vengono denominati acido ditionico, tritionico, tetrationico etc.
Il Selenio con numeri di ossidazione +4 e +6 forma i seguenti acidi
SeO2 + H2O → H2SeO3 Acido selenioso
SeO3 + H2O → H2SeO4 Acido selenico
|
V gruppo A |
L'Azoto con i numeri di ossidazione +3 e +5 produce i seguenti acidi
N2O3 + H2O → H2N2O4 → 2HNO2 acido nitroso
N2O5 + H2O → H2N2O6 → 2HNO3 acido nitrico
Altri acidi dell'azoto
Facendo reagire l'acido nitrico con l'acqua ossigenata si ottiene un peracido o perossiacido (contenente il gruppo O O ), detto acido pernitrico, dove l'azoto presenta nox +5
HNO3 + H2O2 T HNO4 + H2O
con formula di struttura 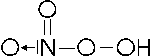
Facendo reagire l'anidride nitrosa con l'acido solforico si ottiene l'acido nitrosil-solforico (il suffisso nitrosil- indica la presenza del gruppo nitrosile NO)
N2O3 + 2H2SO4 T 2NOHSO4 + H2O
L'acido nitrosil-solforico può essere pensato come prodotto dalla disidratazione (perdita di acqua) tra una molecola di acido solforico ed una di acido nitroso
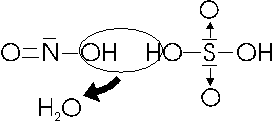
Il Fosforo con i numeri di ossidazione +3 e + 5 forma una serie di acidi che presentano diversi gradi di idratazione.
In particolare quando un'anidride si lega con una sola molecola d'acqua l'acido che ne deriva viene indicato facendone precedere il nome dal suffisso meta-.
Quando viene legata una seconda molecola d'acqua al meta-acido si forma un acido il cui nome viene preceduto dal prefisso orto-.
P2O3 + H2O → H2P2O4 → 2HPO2 acido metafosforoso
HPO2 + H2O → H3PO3 acido ortofosforoso
P2O5 + H2O → H2P2O6 → 2HPO3 acido metafosforico
HPO3 + H2O → H3PO4 acido ortofosforico
L'acido ortofosforoso, pur avendo 3 idrogeni, è biprotico, ne dissocia cioè solo due. Per questo motivo si ritiene che un idrogeno sia legato direttamente all'atomo di fosforo, piuttosto che ad un ossigeno.
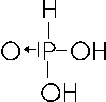
Con il numero di ossidazione +5 il fosforo forma anche l'acido pirofosforico (o difosforico) il quale si forma per disidratazione (perdita di una molecola d'acqua) da due molecole di acido ortofosforico.
Per trovarne la formula in maniera più rapida e veloce è sufficiente aggiungere due molecole d'acqua all'anidride fosforica
P2O5 + 2H2O → H4P2O7 acido pirofosforico
Altri acidi del fosforo
Con il nox +5 il fosforo forma due peracidi o perossiacidi in cui è presente il gruppo O O
H3PO5, acido monoperfosforico e H4P2O8, acido diperfosforico, con formule di struttura
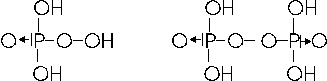
Il tetrossido di fosforo P2O4, analogo all'ipoazotide, dove il fosforo presenta nox +4, sciolto in acqua forma una miscela di acido fosforoso e fosforico. Esiste comunque un acido in cui il fosforo presenta nox +4 e di cui il tetrossido rappresenta l'anidride teorica. E' l'acido ipofosforico H4P2O6, la cui formula può essere ottenuta aggiungendo due molecole d'acqua al tetrossido.
Esiste infine anche un acido ipofosforoso H3PO2, in cui il fosforo presenta nox +1. Corrisponde ad un protossido di fosforo P2O, non conosciuto.
L'Arsenico con i numeri di ossidazione +3 e +5 produce i seguenti acidi
As2O3 + H2O → 2HAsO2
HAsO2 + H2O → H3AsO3 acido ortoarsenioso (esiste solo in soluzione)
As2O5 + H2O → 2HAsO3
HAsO3 + H2O → H3AsO4 acido ortoarsenico
L'acido ortoarsenioso è un composto anfotero. In soluzioni basiche si comporta come un acido, mentre in soluzioni acide si comporta come una base, dissociandosi in ioni OH- e cationi As3+. In tal caso esso va scritto come un idrossido arsenioso
As(OH)3 → As3+ + 3OH-
Esiste infine, analogamente a quanto visto per il fosforo, un acido piroarsenico, ottenibile per disidratazione di due molecole di acido ortoarsenico. La sua formula può essere determinata più facilmente sommando due molecole d'acqua all'anidride arsenica
As2O5 + 2H2O → H4As2O7 acido piroarsenico
|
IV gruppo A |
Il Carbonio con il numero di ossidazione +4 forma l'acido carbonico
CO2 + H2O → H2CO3 acido carbonico (esiste solo in soluzione)
E' noto anche un peracido, l'acido percarbonico, H2C2O6 dalla formula di struttura
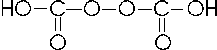
Il Silicio con numero di ossidazione +4 forma due acidi
SiO2 + H2O → H2SiO3 acido metasilicico
H2SiO3 + H2O → H4SiO4 acido ortosilicico
L'acido silicico dà poi per disidratazione una serie di acidi polisilicici, rappresentabili dalla formula generale (mH4SiO4 nH2O). Il primo termine della serie è l'acido ortodisilicico o pirosilicico
2H4SiO4 → H6Si2O7 + H2O acido pirosilicico
|
III gruppo A |
Il Boro con nox +3 forma l'acido borico ed un peracido, l'acido perborico
B2O3 + H2O → 2HBO2 acido metaborico
HBO2 + H2O → H3BO3 acido ortoborico
l'acido perborico (o perossiborico) HBO3, ha formula di struttura
![]()
Scaldando l'acido ortoborico si ottiene infine per disidratazione un poliacido
4H3BO3 → H2B4O7 + 4H2O acido tetraborico
PRINCIPALI ACIDI DEI GRUPPI B
|
VI gruppo B |
Il Cromo (nox +2, +3, +6) forma composti acidi con il numero di ossidazione più elevato
CrO3 + H2O → H2CrO4 acido cromico (esiste solo in soluzione)
Trattando le soluzioni di acido cromico con acqua ossigenata si ottengono diversi tipi di peracidi, acidi percromici e i relativi sali (i percromati).
Esiste infine una serie di sali che derivano da acidi policromici (teorici), il primo termine della serie è l'acido bicromico
2H2CrO4 → H2Cr2O7 + H2O acido bicromico (teorico, esistono i suoi sali)
|
VII gruppo B |
Il Manganese (nox +2, +3, +4, +6, +7) forma composti acidi con i due numeri di ossidazione più elevati
Con il nox + 6 forma un acido manganico (teorico), la cui formula è ottenibile da un'anidride manganica MnO3, altrettanto teorica.
MnO3 + H2O → H2MnO4 acido manganico (teorico, esistono i suoi sali)
Mn2O7 + H2O → H2Mn2O8 T2HMnO4 acido permanganico
Gli idrossidi si formano sommando una o più molecole d'acqua ad un ossido
Ossido + acqua = Idrossido
Il carattere basico di queste sostanze, cioè la loro tendenza a liberare ioni OH-, è legato alla presenza nella molecola di un metallo, che rende polare il legame con i gruppi ossidrilici. Sull'atomo di ossigeno dell'ossidrile si intensifica in tal modo la parziale carica negativa, mentre sul metallo si forma una parziale carica positiva che ne facilita la liberazione come catione, una volta in acqua, e la separazione dei gruppi OH-.
Il nome degli idrossidi si ottiene da quello dell'ossido corrispondente, sostituendo il termine 'idrossido' al termine 'ossido'
Per costruire un idrossido è sufficiente far seguire al metallo tanti gruppi ossidrili quanti ne richiede il numero di ossidazione del metallo.
Ad esempio dall'ossido di potassio si ottiene l'idrossido di potassio
K2O + H2O → 2KOH
mentre dall'ossido di rame si ottiene l'idrossido di rame
CuO + H2O → Cu(OH)2
Forza di un idrossido
Un idrossido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in cationi e ioni OH-, si dice debole quando è poco dissociato. La forza di un idrossido si può prevedere in linea di massima, osservando se il metallo appartenga o meno ad uno dei primi gruppi chimici. In linea di massima un idrossido è forte quando il metallo che lo forma è un metallo alcalino o alcalino-terroso. Così mentre l'idrossido di rame è debole, l'idrossido di potassio è forte.
Dissociazione di un idrossido
Un idrossido con un solo gruppo ossidrile è detto monoprotico, con due biprotico etc.
Un idrossido monoprotico come l'idrossido di potassio si dissocia in acqua
KOH → K+ + OH-
un idrossido poliprotico presenta invece tante dissociazioni quanti sono i gruppi ossidrile contenuti nella sua molecola. L'idrossido di rame può dare due dissociazioni
Cu(OH)2 → CuOH+ + OH-
CuOH- → Cu2+ + OH-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
Cu(OH)2 → Cu2+ + 2OH-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo
|
I gruppo A |
I metalli alcalini hanno tutti nox +1 e quindi formano idrossidi del tipo LiOH, NaOH, KOH etc
|
II gruppo A |
I ma talli alcalino-terrosi hanno tutti nox +2 e formano quindi idrossidi del tipo Be(OH)2, Mg(OH)2 etc
|
III gruppo A |
I metalli del terzo gruppo A presentano tutti nox +3 e formano quindi idrossidi del tipo Al(OH)3 etc
L'idrossido di alluminio è in realtà un composto anfotero.
In soluzione acida si comporta infatti come una base, mentre in soluzione basica si comporta come un acido (acido alluminico)
H3AlO3 → AlO33- + 3H+
|
IV gruppo A |
I metalli del quarto gruppo formano idrossidi con nox +2 e +4
Lo stagno con nox +2 forma l'idrossido stannoso Sn(OH)2, avente carattere anfotero (acido stannoso, H2SnO2). Con nox +4 forma invece un composto a carattere acido
SnO2 + H2O → H2SnO3 acido stannico
Il Piombo, con nox +2 forma l'idrossido piomboso Pb(OH)2, a carattere anfotero (acido piomboso H2PbO2). Con nox +4 forma l'idrossido piombico Pb(OH)4, anch'esso anfotero (acido piombico H4PbO4).
 |
| Appunti su: reazione tra idrossido e ossiacido, idrossidi e ossiacidi, idrossidi di composti forma teorica, lo stagno ha ossiacidi, idrossido piC3B9 ossiacido, |
|
| Appunti Geografia |  |
| Tesine Ingegneria tecnico |  |
| Lezioni Biologia |  |