 |
|
| Appunti scientifiche |
|
 |
|
| Appunti scientifiche |
|
| Visite: 2668 | Gradito: |
Leggi anche appunti:Gli atomiGLI ATOMI In un atomo, dentro al centro c'è il nucleo atomico, formato Natura ondulatoria della materia: interpretazione probabilisticaNatura ondulatoria della materia: interpretazione probabilistica La descrizione MeiosiMeiosi La meiosi è il processo di divisione mediante il quale una cellula |
 |
 |
Poiché, come abbiamo visto, il potenziale di una cella elettrochimica è legato alle concentrazioni delle specie coinvolte nelle reazioni agli elettrodi; è evidente che la misura del potenziale di una pila (misura potenziometrica), attraverso l'utilizzo di opportuni elettrodi, può essere utilizzata per la determinazione delle concentrazioni delle specie in soluzione. Questo approccio è particolarmente utile quando si tratta di determinare concentrazioni particolarmente basse, come nel caso della misura del pH o della solubilità di sali poco solubili, in quanto la risposta dei potenziali della cella alle variazioni di concentrazione è estremamente sensibile.
La potenziometria è dunque una pratica analitica che si basa sulla misura della differenza di potenziale di una cella galvanica in condizione di assenza di corrente al fine di determinare concentrazioni incognite.
La strumentazione utilizzata in potenziometria prevede
un elettrodo di riferimento, il cui potenziale deve essere noto, costante nel tempo e indipendente dalla composizione della soluzione contenente l'analita in cui è immerso e la cui concentrazione si vuole misurare
un elettrodo di lavoro (o elettrodo indicatore), la cui risposta dipende dalla concentrazione dell'analita da testare
un dispositivo per la misura del potenziale o potenziometro
A) Piaccametro e calcolo Ka
Il piaccametro (o pH-metro) è un importante esempio di strumento potenziometrico per la determinazione della concentrazione degli ioni H+, e quindi del pH, di una soluzione. Esso si basa sulla semireazione
2H+ + 2e- → H2
in quanto il potenziale di un elettrodo basato su di essa è funzione della [H+] e quindi del pH. Come abbiamo infatti già visto, applicando l'equazione di Nernst alla coppia redox H+/H2, si ottiene
![]()
![]()
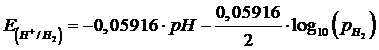
Se poi consideriamo una pressione parziale dell'Idrogeno pari ad 1 atm, essendo log 1 = 0, le relazioni tra il potenziale di cella e la [H+] e ed il pH diventano
![]() e
e ![]()
Sarà dunque sufficiente effettuare una misurazione del potenziale di una semicella ad idrogeno alla pressione di una atmosfera, collegandola ad una semicella di riferimento a potenziale noto, per calcolarne [H+] e pH incognito.
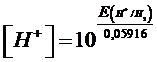 e
e 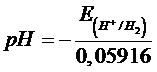
Si consideri, ad esempio, la seguente pila a concentrazione, costituita da una semicella contenente una soluzione a concentrazione incognita di ioni H+ (elettrodo di lavoro), collegata ad un elettrodo standard ad idrogeno o SHE (elettrodo di riferimento) che funge, in questo caso, da catodo e si supponga di misurare una differenza di potenziale di 0,1183 V
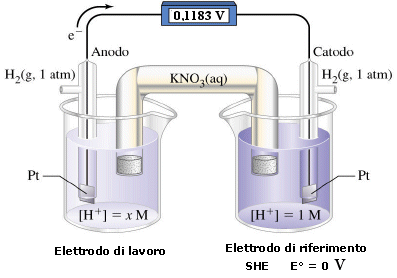
La fem così misurata è pari alla differenza tra il il potenziale noto dell'elettrodo di riferimento (Erif), che funge da catodo, ed il potenziale incognito dell'elettrodo di lavoro che contiene l'analita (Etest) e che funge da anodo
ΔE = Erif - Etest
e quindi
Etest = Erif - ΔE = 0 - 0,1183 = - 0,1183 V
Noto il potenziale della semicella da testare, possiamo calcolare la [H+] incognita
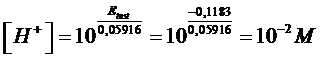
Si tenga tuttavia presente che, nella pratica, l'elettrodo ad idrogeno risulta scomodo da utilizzare per la misura del pH. Per questo motivo i piaccametri si basano su altri elettrodi di riferimento (elettrodo a vetro o "a membrana"), anche se il principio di funzionamento rimane ovviamente il medesimo.
Si tenga presente che se la semicella di lavoro da testare presenta un pH < 1 essa, avendo una concentrazione di ioni H+ superiore alla semicella di riferimento, funzionerà come catodo e presenterà un potenziale positivo, maggiore dell'elettrodo di riferimento. In tal caso, comunque raro, avremo ΔE = Etest - Erif e quindi
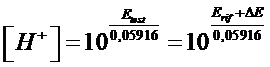
Tramite misure potenziometriche della concentrazione degli ioni H+ è inoltre possibile, nota la concentrazione dell'acido debole in soluzione, effettuare stime della costante di dissociazione acida (Ka) degli acidi deboli. Dalla relazione semplificata che permette di calcolare la [H+] in una soluzione di un acido debole di concentrazione Ca
![]()
si ricava infatti
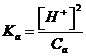
Esempio 1
La fem della pila
Pt(s)│H2(g, 1 atm)│H+ (aq, x M) || Hg2Cl2(s) | Cl- (aq, 1 M) │Hg(l)
a 25 °C è 0,6644 V. Il potenziale standard dell'elettrodo a calomelano è +0,283 V. Calcolare ill pH dell'elettrodo a concentrazione incognita
Poiché l'elettrodo di riferimento a calomelano (Hg2Cl2) si trova in condizioni standard (concentrazione 1 M e 25°C), il suo potenziale è proprio 0,238 V. La concentrazione incognita di ioni H+ nell'elettrodo indicatore (elettrodo di lavoro) è
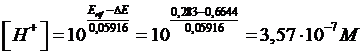
ed il pH = -log10(3,57 10-7) = 6,45
Il pH poteva essere calcolato direttamente notando che l'elettrodo indicatore è un elettrodo ad idrogeno con pressione parziale dell'idrogeno di 1 atm e con un potenziale pari a Elav = Erif - ΔE = 0,283 - 0,6644 = - 0,3814 V. In queste condizioni il potenziale della coppia redox H+/H2 è funzione del pH secondo la relazione
E(H+/H2) = -0,05916 pH
da cui
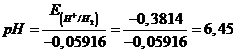
Esempio 2
La fem della pila
Pt(s)│H2(g, 1 atm)│HClO (aq , 0,1M) , H+ (aq, x M) || H+ (aq, 1 M) | H2(g, 1 atm) │Pt(s)
è pari a 0,2521 V. Calcolare la costante di dissociazione acida Ka dell'acido ipocloroso HClO 0,1 M contenuto nell'elettrodo di lavoro che funge da anodo
L'elettrodo di riferimento che funge da catodo è un elettrodo standard ad idrogeno e dunque presenta Erif = 0 V. La concentrazione degli ioni H+ nell'elettrodo che contiene l'analita è
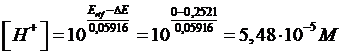
La concentrazione degli ioni H+ di una soluzione di un acido debole può essere calcolata con la seguente formula approssimata
![]()
dalla quale possiamo esplicitare la Ka dell'acido debole
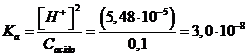
Esempio 3
Il potenziale di un elettrodo ad idrogeno (p = 1 atm) immerso in una soluzione 0,1 M di un sale alcalino di un acido debole è di -0,5249 V. Calcolare la costante Ka dell'acido
Il potenziale dell'elettrodo di lavoro, contenente la soluzione del sale alcalino, è -0,5249 V. La concentrazione di ioni H+ nella soluzione sarà quindi
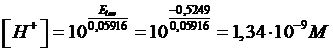
e la concentrazione degli ioni OH- sarà
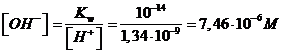
Il sale alcalino di un acido debole produce un idrolisi basica. La concentrazione degli ioni OH- in soluzione può essere stimata con la formula approssimata
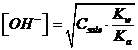
dalla quale possiamo esplicitare la Ka dell'acido debole
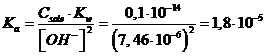
Esempio 4
Il potenziale di un elettrodo ad idrogeno (p = 1 atm) immerso in una soluzione equimolare di acido nitroso e di un suo sale alcalino è di -0,1980 V. Calcolare la costante Ka dell'acido
L'elettrodo indicatore è un elettrodo ad idrogeno con pressione parziale dell'idrogeno di 1 atm e con un potenziale pari a -0,1980 V. In queste condizioni il potenziale della coppia redox H+/H2 è funzione del pH secondo la relazione
E(H+/H2) = -0,05916 pH
da cui
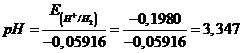
La soluzione da analizzare contiene un acido debole ed un suo sale in egual concentrazione. Si tratta dunque di una soluzione tampone il cui pH = pKa. La Ka dell'acido nitroso sarà pertanto
![]()
* * * * * * * * *
Calcolo concentrazione ioni in soluzione e Kps
Lo stesso principio, utilizzato per la determinazione della concentrazione degli ioni H+, può essere usato per determinare la concentrazione incognita di qualsiasi specie costruendo una cella voltaica in cui la specie in questione partecipa alla semireazione di un elettrodo (elettrodo di lavoro) mentre l'altro è un elettrodo di riferimento a potenziale noto.
Esempio
Calcoliamo la concentrazione di Ni2+ nella seguente cella se la sua fem a 25°C è 0,34 V sapendo che E°(Zn2+/Zn) = -0,76V e E°(Ni2+/Ni) = -0,23V
Zn(s) | Zn2+(aq, 1M) || Ni2+(aq, x M)|Ni(s)
Scriviamo l'equazione di Nerst per l'intera cella
![]()
sostituiamo i valori
![]()
esplicitiamo [Ni2+]
![]()
![]()
* * * * * * * * *
In modo analogo, la determinazione potenziometrica della concentrazione di uno ione implicato in un equilibrio di solubilità in una opportuna soluzione satura del sale poco solubile permette di risalire al prodotto di solubilità Kps.
Esempio 1
La cella a concentrazione
(-) Ca(s) | Ca2+(aq, x M, CaSO4 saturo) || Ca2+(aq, 0,1M) | Ca(s) (+)
presenta una fem = 0,0342 V. Calcolare il prodotto di solubilità Kps del solfato di calcio (si noti che, poiché cambiano le concentrazioni della specie ossidata (Ca2+) la semicella più concentrata funge da catodo)
Le reazione sono
Semicella catodica Ca2+(aq, 0,1M) + 2 e- → Ca(s)
Semicella anodica Ca(s) → Ca2+(aq, saturo) + 2 e-
Reazione complessiva Ca2+(aq, 0,1M) → Ca2+(aq, saturo)
In una pila a concentrazione il potenziale standard dell'intera cella è nullo E°cella = 0 (essendo dato dalla differenza dei potenziali standard uguali dei due elettrodi). Scriviamo l'equazione di Nernst per esprimere il potenziale in condizioni non standard dell'intera cella
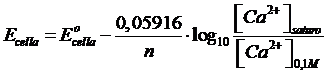
sostituiamo i valori
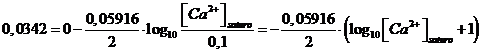
esplicitiamo la [Ca2+]saturo
![]()
Poiché infine nella soluzione satura di CaSO4 abbiamo che [Ca2+]= [SO42-], possiamo calcolare Kps
Kps = [Ba2+][ SO42-] = (7,0 10-3) (7,0 10-3) = 4,9 10-5
Esempio 2
Una cella galvanica è costituita da un elettrodo di Nichel metallico immerso in una soluzione [Ni2+] = 1 M e da un elettrodo di Alluminio metallico immerso in una soluzione [Al3+] = 1 M. Alla semicella di Alluminio viene aggiunto NaOH che causa la precipitazione di Al(OH)3(s). Quando la precipitazione termina il pH della soluzione è pari a pH = 10 ed il potenziale della cella (fem) è pari a Ecella = 1,82 V. Sapendo che E°(Ni2+/Ni) = -0,257 e E°(Al3+/Al) = -1,676, calcolare il prodotto di solubilità di Al(OH)3.
Poiché la coppia redox Al3+/Al presenta il potenziale più basso, essa funge da anodo e lo schema della cella dopo la precipitazione è
(-) Al(s) | Al3+(aq, x M, pH=10) || Ni2+(aq, 1M) | Ni(s) (+)
Le reazione sono
Semicella catodica 3Ni2+(aq) + 6 e- → 3Ni(s)
Semicella anodica 2Al(s) → 2Al3+(aq) + 6 e-
Reazione complessiva 3Ni2+(aq) + 2Al(s) → 3Ni(s) + 2Al3+(aq)
Il potenziale standard dell'intera cella è E°cella = E°cat - E°an = -0,257 -(-1,676) = 1,419 V
Scriviamo l'equazione di Nernst per esprimere il potenziale in condizioni non standard dell'intera cella
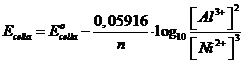
sostituiamo i valori
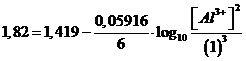
esplicitiamo la [Al3+]
![]()
Essendo poi il pH = 10, la concentrazione degli ioni H+ è [H+] = 10-10 M e [OH-] = Kw/[ H+] = 10-14/10-10 = 10-4 M
Calcoliamo il prodotto di solubilità
Kps = [Al3+][OH-]3 = (4,63 10-21) (10-4)3 = 4,63 10-33
Esempio 3
La pila Ag (s) │ AgCl (s) │ Cl- (aq, 0,1 M) , Ag+ (aq, 0,25 M) │ Ag (s) ha una fem = 0,48215 V. Calcolare il prodotto di solubilità del cloruro di Argento
L'anodo di questa pila è costituito da un elettrodo di seconda specie formato da un metallo (Ag) a contatto con un suo sale poco solubile allo stato solido (AgCl) ed immerso in una soluzione satura degli ioni del suo sale (Ag+ e Cl-). La semireazione di riduzione è
AgCl(s) + e → Ag(s) + Cl-(aq)
Normalmente tali elettrodi riportano solo la concentrazione dell'anione (in questo esempio [Cl-] = 0,1 M), ma la concentrazione del catione non può assumere un valore qualsiasi, poiché è determinata dal prodotto di solubilità del sale poco solubile (in questo esempio è Kps = [Ag+][Cl-] ). In pratica dunque, poiché le due concentrazioni sono correlate, il potenziale di questo elettrodo può essere indipendentemente calcolato rispetto alla concentrazione dell'anione usando il potenziale standard della coppia redox AgCl/Ag,Cl-
![]()
oppure può essere calcolato rispetto alla concentrazione del catione usando il potenziale standard della coppia redox Ag+/Ag
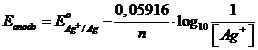
In questo modo, essendo quest'ultima la stessa coppia redox del compartimento catodico, possiamo trattare la pila come una cella a concentrazione nello ione Ag+ in cui la reazione complessiva di cella è
Ag+(0,25 M) → Ag+(saturo)
In pratica, mentre gli ioni Ag+ (0,25 M) del catodo si riducono ad argento metallico, diminuendo la loro concentrazione, l'argento metallico dell'anodo si ossida ad Ag+, andando ad aumentare la concentrazione degli ioni Ag+ nella soluzione satura (parte di questi si riassocieranno con gli ioni Cl- precipitando sotto forma di AgCl in modo da rispettarne il prodotto di solubilità). Poiché il potenziale standard di cella di una pila a concentrazione è nullo (essendo uguali i potenziali standard dell'anodo e del catodo si avrà E°pila = E°catodo - E°anodo = 0) possiamo scrivere
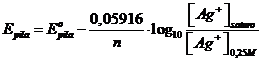
e, sostituendo opportunamente i valori, otteniamo
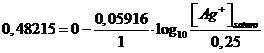
dalla quale possiamo esplicitare la concentrazione di ioni Ag+ presenti nella soluzione satura
![]()
[Ag+]saturo = 1,77 10-9 M
sapendo infine che nella soluzione satura di AgCl la concentrazione di ioni Cl- è 0,1 M, possiamo calcolare il prodotto di solubilità
Kps = [Ag+][Cl-] = 1,77 10-9 x 0,1 = 1,77 10-10
Esempio 4
Calcolare il prodotto di solubilità di AgI a 25 °C, sapendo che la fem della pila:
(-) Ag | AgI (soluz. satura) || AgCl (soluz. satura) |Ag (+)
è 0,18687 V a 25 °C e che a tale temperatura il prodotto di solubilità di AgCl è 1,77×10-10.
La pila è costituita da due semicelle contenenti un metallo, l'argento, immerso in una soluzione satura di un suo sale poco solubile, rispettivamente AgI e AgCl. In entrambe le semicelle la concentrazione degli ioni Ag+ è governata dal prodotto di solubilità del rispettivo sale. La fem di questa pila dipende dalla diversa concentrazione degli ioni Ag+ presenti nelle due semicelle (pila a concentrazione), che a sua volta dipende dal particolare valore di KPS del sale poco solubile. La coppia redox di entrambe le semicelle è dunque Ag+ /Ag ed il potenziale standard di cella E°pila = 0.
Applicando l'equazione di Nernst per esprimere il potenziale della pila a p = 1 atm e T = 298 K possiamo scrivere:
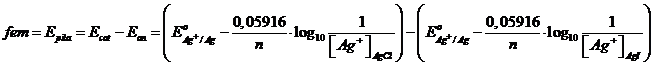
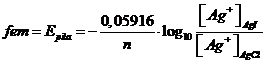
Noto il prodotto di solubilità dal Cloruro di Argento (Kps = [Ag+][Cl-] = 1,77 10-10) possiamo calcolare la concentrazione di ioni argento nella sua soluzione. Infatti, poiché in soluzione è presente solo AgCl, la concentrazione di ioni argento Ag+ deve essere uguale alla concentrazione di ioni cloruro Cl- e quindi, essendo [Ag+]=[Cl-] = x
![]()
sostituendo i valori nella relazione precedente otteniamo
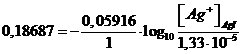
esplicitiamo la concentrazione di ioni Ag+ della soluzione satura di AgI
![]()
[Ag+]AgI = 9,23 10-9 M
essendo, anche in questo caso, la concentrazione degli ioni Ag+ uguale a quella degli ioni ioduro I-, [Ag+] = [Cl-] = 9,23 10-9 M, possiamo calcolare il prodotto di solubilità dello ioduro di argento
Kps = [Ag+][I-] = 9,23 10-9 x 9,23 10-9 =
 |
| Appunti su: https:wwwappuntimaniacomscientifichechimicaanalisi-potenziometriche83php, |
|
| Appunti Ingegneria tecnico |  |
| Tesine Biologia |  |
| Lezioni Geografia |  |