 |
|
| Appunti universita |
|
 |
|
| Appunti universita |
|
| Visite: 2531 | Gradito: |
Leggi anche appunti:Tesi - Tiroidectomia mini-invasiva video- assistita e Tiroidectomia trans-ascellare robot- assistitaIntroduzione Artrite reumatoideArtrite reumatoide Definizione. L'A.R. è una malattia infiammatoria sistemica Streptococchi, Enterococchi e PneumococcoGli Streptococchi Gli streptococchi sono batteri Gram+, sferici o ovali, con cellule |
 |
 |
Cancerogenesi
Cancerogenesi è quell'insieme di eventi che rendono possibile lo sviluppo di un tumore. Per cancerogeno s'intende tutto ciò che induce comparsa di tumore in animali da esperimento con esso trattati.
1 Cancerogenesi Chimica
I cancerogeni chimici sono attivi quando somministrati in dosi frazionate o subliminali si che è necessario intercorra un lasso di tempo affiché facciano effetto, quindi di parla di tossicità da sommazione. Ogni cancerogeno è fornito di una dose soglia, valore che indica la quantità minima da somministrare affinché si verifichi la comparsa di neoplasie. Si può parlare di accelerazione o amplificazione per tutti quei processi, quali invecchiamento, indebolimento del sistema immunitario etc., che possono favorire l'insorgere della neoplasia oltre alla presenza del cancerogeno.
La cancerogenesi è divisa in induzione e promozione.
1.1 Induzione
Durante l'inizio della fase S si possono avere molto facilmente modificazioni del DNA mediante uno spostamento fisico di basi, un'intercalazione, una reazione chimica con formazione di legami covalenti con il cancerogeno ultimo e la liberazione di radicali liberi indotta da radiazioni.
In base a questo danno la cellula diventa potenzialmente neoplastica. Il danno genomico, che avviene in maniera rapidissima, può essere eliminato mediante i meccanismi di soccorso, così come integrarsi nel genoma. A questo punto il cancerogeno può essere suddiviso in cancerogeno diretto e cancerogeno indiretto o procencerogeno; questa divisione dipende dalla necessità o meno d un agente chimico, di subire processi metabolici per essere fattore iniziante o no. Ciò dipende dalla capacità dei cancerogeni di essere elettrofilici, cioè capaci di legarsi al DNA e arrecare danno. È un processo irreversibile.
1.2 Promozione
A differenza dell'induzione, la promozione è un processo lento e reversibile. Gli agenti promuoventi non sono mutageni, e non si legano al DNA[1]; questi riducono il tempo di latenza dei cancerogeni e diminuiscono il loro valore soglia. Non si ha sviluppo del tumore se, dopo trattamento con cancerogeni, si effettua un trattamento promuovente in maniera discontinua e con lunghi intervalli. È importante notare che gli agenti promuoventi possono indurre trascrizione di protooncogéni della classe myc/fos.
Il processo di cancerogenesi è, in effetti, un processo multifasico, ove tanti eventi possono avvenire contemporaneamente e non si esauriscono con l'avvento della trasformazione neoplastica. Questa ulteriore fase, pertanto, prende il nome di progressione neoplastica ed è associata ad una crescente instabilità cromosomica con una distribuzione sempre più allargata del numero dei cromosomi nelle cellule tumorali che nelle cellule normali. Questa instabilità è, inoltre, causa di ulteriori riarrangiamenti cromosomici, capaci generare cellule sempre più indipendenti e più forti.
2 I cancerogeni chimici
I cancerogeni possono essere divisi in diverse classi specifiche:
Diretti: agiscono senza necessità di formare derivati; possono essere inattivati e tendono a reagire con composti nucleofilici extracellulari, per la loro alta elettrofilicità, come nel sangue.
Procancerogeni: sono cancerogeni alcuni loro derivati metabolici; possono essere attivati o inattivati.
Intermedi: si formano dopo trasformazione metabolica dei procancerogeni e hanno modeste potenzialità.
Terminali: derivano da quelli precedenti ed hanno maggior potere dei loro precursori.
Tutte le trasformazioni metaboliche subite dai procancerogeni avviene ad opera dei sistemi enzimatici presenti sulle membrane ergastoplasmiche, che sono quelli che sedimentano con la frazione microsomiale dopo omogeneizzazione. Per questo si parla di DMES (Drug Metabolizing Enzyme System), conosciuto anche come MFO (cytocrome p450 associated Mixed Function Oxidases); la loro attività consiste nel trasformare composti lipofilici in composti elettrofilici, cioè solubili, in modo da poter essere escreti più facilmente.
I cancerogeni chimici sono divisi nelle seguenti classi:
Idrocarburi aromatici policiclici.
Amine aromatiche.
Composti azoici.
Sostanze alchilanti.
Idrocarbuti alogenati.
Sostanze naturali.
Composti organici naturali e batterici: cloramfenicolo.
Composti inorganici: arsenico e altri minerali.
2.1 Idrocarburi aromatici policiclici
Gli Idrocarburi aromatici policiclici sono elementi costituiti soltanto da due elementi: C e H ed hanno una struttura riconducibile ad una struttura più piccola di base che è il benzene (C6H6). Possono essere omo/eterociclici e sostituiti (in genere da gruppi metilici o etilici) e non sostituiti.
Tutti gli I.A.P. derivano da una struttura di base quale l'antracene o il fenantrene.
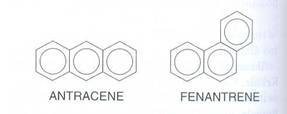
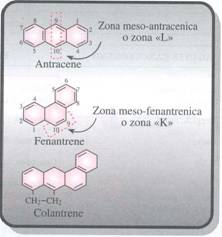
Nel benzene la distribuzione elettronica è omogenea su tutta la molecola, mentre negli I.A.P. ci sono con reattività maggiore o minore. Quelle con reattività maggiore sono dette zone K (dal tedesco Krebs che vuol dire tumore - zona mesofenantrenica), mentre quelle con reattività minore sono dette zone L (zona mesoantracenica).
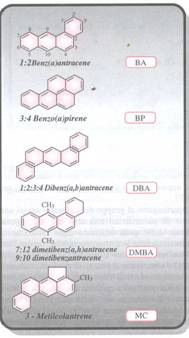
Gli I.A.P. più comuni sono:
![]() Benzo(a)ntracene
BA.
Benzo(a)ntracene
BA.
![]() Benzo(a)pirene
BP.
Benzo(a)pirene
BP.
![]() Dibenzo(a,b)antracene
DBA.
Dibenzo(a,b)antracene
DBA.
![]() Dimetibenzo(a,h)antracene
DMBA.
Dimetibenzo(a,h)antracene
DMBA.
![]() Metilcolantrene
MC.
Metilcolantrene
MC.
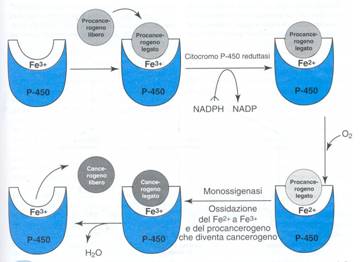
Gli I.A.P. si legano al citocromo P-450 (che lega Fe3+) e mediante una riduttasi si ha riduzione di Fe3+ a Fe2+. Il complesso può ora legare O2 in modo che, grazie ad una monoossigenasi il precancerogeno sia trasformato in cancerogeno. Si libera, poi, H2O, che determina distacco del cancerogeno.
L'ossigenazione/ossidazione dgli I.A.P. comporta la formazione di dioli, epossidi e diolo-epossidi, composti molto elettrofilici reattivi, con alto potenziale cancerogeno.
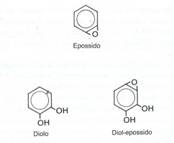
Nel corso dell'attivazione si ha la liberazione di molti radicali liberi[2], derivati dall'attività delle monoossogenasi. Questi enzimi determinano la formazione di radicali libero dell'Ossigeno detti ossigeno singlet 102 che, a sua volta, può reagire con altri I.A.P. attivandoli, instaurando una reazione a catena.
Infine gli epossidi e i loro derivati sono ulteriormente metabolizzati mediante due vie:
![]() Legame
al glutatione con formazione di
glutatione-coniugati mediante glutatione-S-trasferasi.
Legame
al glutatione con formazione di
glutatione-coniugati mediante glutatione-S-trasferasi.
![]() Ulteriore
idratazione mediante epossido-idratasi.
Ulteriore
idratazione mediante epossido-idratasi.
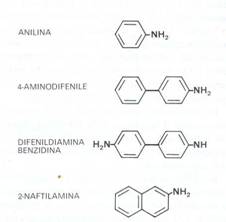
2.2 Amine aromatiche
Le amine aromatiche sono sostanze aromatiche coloranti costituite da una struttura aromatica nella quale almeno un atomo di idrogeno è sostituito dal gruppo aminico NH2. La molecola principale è la b-naftilamina, che è un procancerogeno.
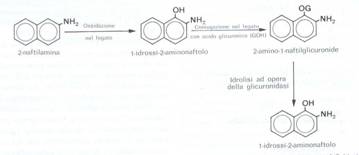
Mediante ossidazione e coniugazione nel fegato si ottiene il 2-amino-1naftilglicuronide, a sua volta scisso nel tubulo renale in 1-idrossi-2aminonaftolo. Nel trigono vescicale esercita il suo potenziale cancerogeno perché vi ristagna.
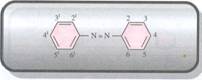
2.3 Composti azoici
Sono molecole costituite da anelli benzenici contenenti almeno un gruppo aminico, riuniti da due atomi d'azoto tra i quali è presente un doppio legame; sono cancerogeni diretti. Questi composti si legano a proteine epatiche della classe h2. Tutti questi composti sono coloranti derivanti dall'azobenzene.
Il dimetilaminobenzene (DAB) è il più importante, in quanto forma addotti molto stabili e molto velocemente col DNA.
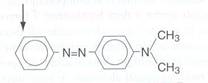
Le vitamine del gruppo B sono particolarmente importanti perché inattivano gli azocomposti.
2.4 Sostanze alchilanti
Per alchilazione s'intende una reazione chimica in cui un composto (sostanza alchilante) cede ad un altro composto uno o più gruppi alchilici (in genere metilici o etilici) che, pertanto, diventa alchilato. I gruppi alchilici hanno carica positiva e sono, dunque, elettrofilici. Si legano, pertanto, a gruppi nucleofilici, come ad esempio, il DNA.
Queste sostanze offrono, dunque, i loro gruppi alchilanti. Ne può conseguire:
Sostituzione di una base azotata.
Depurinazione.
Rottira di un filamento singolo.
Rottura di due filamenti.
Formazione di legami crociati intra/interfilamento.
Esterificazione del gruppo fosforico.
Le sostanze più comuni sono le mostarde, che sono alchilanti spontanei, tra cui la ipirite (dicloroetilsolfuro).
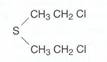
Per sostituzione dell'atomo di zolfo con un uno di azoto si ha la formazione di azoipirite.
2.4.1 Nitrosamine
Queste sostanze fanno parte di un gruppo di cancerogeni particolarmente potenti. Queste si dividono in nitrosamine (ove le due valenze dell'azoto aminico sono completate da due gruppi alchilici) , e nitrosamidi (ove le due valenze dell'azoto aminico sono completate da un gruppo alchilico ed un gruppo non alchilico).
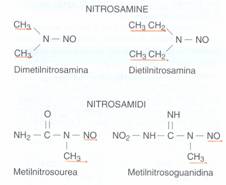
Il più importante, la dimetilnitrosamina, si può sviluppare nello stomaco per azione dei nitriti su di una amina secondaria.
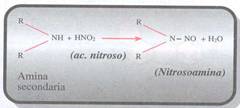
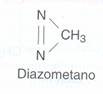
l'attivazione metabolica della dimetilnitrosamina avviene nel fegato che producono N-idrossilazine che, in seguito a dealchilazione, è trasformata in diazometano, che è il cancerogeno terminale (metilante preferibilmente a livello 0-6 della guanina).
Altre nitrosamine si originano dalla combustione del tabacco.
2.5 Idrocarburi alogenati
Si tratta di una serie di compoti largamente usati nel campo industriale: plastiche, resine, pesticidi etc. Il più comune è il dicloro-difenil-tricloroetano (DDT), agente debellante della malaria.
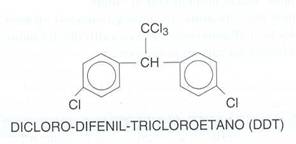
Il DDT, così come tutti gli altri I.A., è molto poco biodegradabile e si accumula nel plancton e, quindi, nel tessuto adiposo dei pesci, arrivando fino all'uomo. Un altro I.A. è la tetracloro-dibenzodiossina (TCDD), potentissimo insetticida che determina lo sviluppo di tumori epatici, polmonari e delle alte vie respiratorie.
2.6 Sostanze naturali
Le principali sostanze naturali cancerogene sono le aflatossine, in particolare le aflatossine B1 e G1, la cicasina e il safrolo.
Aflatossine: originate dalla muffa dell'aspergillus flavus, possono provocare tumori quali adenocarcinomi dello stomaco e del colon e tumori sottocutanei.
Cicasina: è contenuta nella noce Cycas, la cui farina è usata molto nell'Estremo Oriente. Determina la comparsa di tumori epatici, renali e nel tubo digerente.
Safrolo: è una sostanza contenuta nell'olio di sassafrasso, usata in laboratorio maggiormente come sostanza promuovente che come cancerogeno.
3 Cancerogenesi fisica
3.1 Radiazioni Ionizzanti
Le radiazioni elettromagnetiche ionizzanti sono i raggi X e i raggi γ, mentre quelle corpuscolate elettromagnetiche sono le particelle α, β, protoni e neutroni.
Raggi X e γ - elettromagnetiche;
Neutroni, protoni particelle α , β - corpuscolate.
L'elettrone, in questo caso, scavalca l'intera orbita e abbandona l'atomo che diventa ione. L'effetto ionizzante può essere amplificato grazie al fatto che l'elettrone, appena libero, può colpire altri elettroni e caricarli, inducendo altri episodi di ionizzazione. Dunque si parla di ionizzazione primaria e secondaria. Una volta che e- perde tutta la sua energia in più, può essere inglobato da uno ione, annullando la sua carica, o essere inglobato da un atomo neutro rendendolo negativo. Dato che il contenuto più grande di una cellula è l'acqua, un elettrone libero può indurre la formazione di radicali liberi dotati di grande attività metabolica, con la capacità di danneggiare molte molecole citoplasmatiche (tra cui il DNA).
Le radiazioni ionizzanti in alte dosi determinano la morte della cellula, comparsa d'aberrazioni cromosomiche irreparabili che determinano apoptosi. Per questo si suppone che le modificazioni e i danni siano dovuti ad un'esposizione alle radiazioni ionizzanti in dose basse in modo da cumularsi. Le cellule più colpite, dunque, sono quelle epiteliali, quelle delle mucose gastrointestinali, degli epiteli, dei tessuti germinali, del midollo e specialmente i linfociti. Osso, nervo, cartilagine e muscolo sono relativamente resistenti. In generale le radiazioni determinano abolizione delle cellule parenchimali con tessuto connettivo fibroso che possono comportare disordini delle funzionalità degli organi (es.: stenosi artero-venose), dovuto alla stimolazione della secrezione di PDGF, FGF, e TGF-β.
Nel caso del tumore, queste determinano mutazioni puntiformi e, in generale, instabilità genomica, che, al contrario delle aberrazioni giganti, sono piccole e possono perpetuarsi. Le cellule, ovviamente, sono più sensibili in fase M e S. Se i danni non sono abortivi, si può dimostrare:
Delezioni, inversioni, traslocazioni cromosomiche (centriche, pericentriche o acentriche se coinvolgono il centromero).
Formazione di cromosomi ad anello.
Legami covalenti tra DNA e proteine.
Ossidazione e degradazione delle basi azotate.
Scissione dei ponti fosfodiesterici.
Attivazione d'espressione di protooncogeni c-fos, c-jun e c-myc.
Stimolazione di secrezione di TNF.
Formazione di radicali liberi[3], specialmente raggi X e raggi γ.
Mutazione del gene p53.
Possibile accorciamento dei Telomeri.
Tutti questi meccanismi determinano uno stato di instabilità genomica indotta che, se non riparata, può essere trasmessa alle cellule figlie e può determinare trasformazione della cellula. I danni più frequenti sono quelli di natura leucemica, ad eccezione della leucemia linfatica cronica.
3.2 Radiazioni ultraviolette
Studi indicano che le radiazioni UV sono le principali responsabili di carcinomi spino e baso cellulari e, probabilmente, dei melanomi maligni cutanei. Il rischio dipende dal grado di esposizione e dalla carnagione.
Molto probabilmente le UV-B sono quelle più pericolose; la loro cancerogeneticità è legata alla capacità di formare dimeri delle basi pirimidiniche.
Gli effetti si esplicano con:
aumento della pigmentazione;
danno a cellule di Langerhans;
danno ai cheratinociti;
eritema, edema e infiammazione (dovute a rilascio di Il come IL-1, metaboliti dell'acido arachidonico).
A differenza delle radiazioni ionizzanti, che determinano attivazione di processi fibrotici, i raggi UV sono responsabili dell'attivazione di espressione dei geni dell'elastina e di metalloproteasi che riducono la concentrazione di collagene realizzando a rughe e aspetto coriaceo.
L'effetto oncogeno è, molto probabilmente, cumulativo. L'insorgenza delle neoplasie cutanee da prolungata esposizione alla luce è spesso preceduta dalla comparsa di lesioni precancerose dette cheratosi attiniche. L'esposizione ai raggi UV può determinare mutazioni a carico di p53 e/o attivazione di ras che porta all'attivazione di MAPK (mitogen-activated protein kinases, proteinchinasi attivati da mitogeni), che possono esplicare attività mitogenica; le mutazioni e i danni, possono procedere sia in senso apoptotico, sia in senso trasformante, dipendentemente dall'intensità del danno e dalla sommatoria degli effetti che tendono a bloccare o arrecare il danno.
Lo Xeroderma Pigmentosum che è caratterizzata dall'incapacità di rimuovere i dimeri della pirimidina o della timina: questi soggetti sono 2000 volte più sensibile ai raggi UV e in essi si riscontra un aumento dell'incidenza delle neoplasie cutanee.
3.3 Cancerogenesi da corpi estranei
Fattori meccanici, anche se di lieve entità, possono esercitare attività oncogena a condizione che agiscano per lungo tempo. È stato riscontrato che nei siti ove in precedenza era penetrato un corpo estraneo, come proiettili o protesi, si sviluppano neoplasie. In genere questi sono tutti materiali che sviluppano una reazione connettivale. In letteratura sono state riscontrate neoplasie, in genere sarcomi in corrispondenza delle cicatrici o delle zone di flogosi conseguenti alla presenza di uova di schistosomi o lesioni produttive tubercolari, o su vecchie ustioni.
L'asbesto è uno dei principali elementi inorganici oncogeni, responsabile di una buona parte dei CA polmonari e mesoteliomi; questi si accumula in fibre attorno al nucleo.
4 Ormoni e Tumori
4.1 Tumori delle ghiandole endocrine
Le cellule di un tumore primitivo possono o non possono continuare a produrre un ormone fisiologicamente sintetizzato in base al grado di differenziazione.
I tumori il cui sviluppo appare condizionato dalla secrezione di ormoni, sono detti ormonodipendenti. In alcuni casi l'influenza ormonale si estrinseca solo nella genesi del tumore, mentre in altri si estrinseca durante tutta la sua vita. Un tumore ormonocondizionato può conservare o perdere la sua responsività all'ormone, (ormono-responsivo/irresponsivo). In generale l'ormonoresponsività è legata alla continua espressione dei recettori per quell'ormone, ma può succedere che, nonostante questi siano presenti, possano essere assenti i meccanismi a valle di trasduzione del segnale ormonale.
Le cellule neoplastiche, inoltre, possono presentare anche recettori per altri ormoni che condizionano la loro crescita.
Tutti gli adenomi, quindi, tendono a secernere gli ormoni senza il controllo dei meccanismi di feed-back, come la regolazione dell'asse ipotalamo-ipofisario, e anche perché il numero di cellule secernenti è maggiore. Si possono, quindi, sviluppare segni clinici legati all'ipersecrezione ormonale.
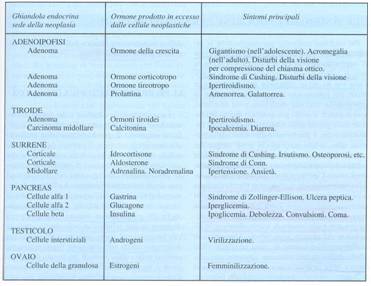
Spesso si riconosce substrato
ereditario: sindromi pluriendocrine MEN
(Multiple Endocrine Neoplasia), come
Nell'uomo i tumori delle ghiandole endocrine sono relativamente scarse nei confronti dei tumori dei tessuti che presentano recettori per gli ormoni, in primo luogo la mammella, l'endometrio e la prostata.
La ghiandola più colpita da neoplasie è la tiroide, preceduta dau un periodo di latenza più o meno breve durante il quale si innalza la concentrazione ematica dell'ormone tiroideo. Ciò avviene per aumentata sintesi di TSH.
4.1.1 CA mammella
I fattori che influenzano la comparsa del carcinoma mammario sono:
Precocità del menarca;
Ritardo della menopausa;
Gravidanze in età avanzata;
Obesità.
La maggiore durata del periodo fecondo della vita femminile si associa ad una maggiore incidenza di carcinoma della mammella. Estrogeni, progesteroni e prolattina giocano un ruolo fondamentale nella genesi del carcinoma mammario.
Gli estrogeni e i progesteroni sono i principali responsabili dell'effetto stimolatorio sulle cellule del carcinoma mammario; l'attività proliferativa è minore nel periodo pre-ovulatorio (quando è più alto l'estrogeno) in confronto al periodo post-ovulatorio, nel corso del quale si presenta un innalzamento del progesterone e l'estrogeno si abbassa progressivamente - teoria estroprogestinica.
L'obesità, se presente durante il menarca, è associata ad un minore rischio d'incidenza del carcinoma mammario, infatti la produzione di estrogeni da parte degli adipociti, dovuta alla trasformazione degli androgeni surrenalici in estrogeni, può indurre la comparsa di cicli anovulatori con conseguente riduzione degli estrogeni e del progesterone con conseguente diminuzione dell'effetto stimolatorio; al contrario, in post-menopausa, invece, l'obesità è associata alla presenza in circolo di ormoni stimolanti.
Il carcinoma mammario può essere ormone-dipendente e non.
Sul DNA esistono sequenze ERE (estrogen responsive element), cui è legato il Domain Binding Domain, un dominio cui è legato un altro dominio importante detto AF1 (Activitang Factor 1) e AF2; questi domini, soprattutto l'AF2, a riposo sono legati a dei repressori perché hanno attività deacetilasica; se presente l'estrogeno, si lega ad una acetilasi che acetilizzano l'istone di DNA interessato e si avvia la trascrizione (l'istone acetilizzato presenta un alto ingombro sterico e non può essere chiuso in cromatina).
Il carcinoma mammario presenta una elevata familiarità, specialmente se è pre-menopausa bilaterale. Esiste la possibilità di effettuare un test per controllare i fattori di trascrizione per le proteine che effettuano la riparazione del DNA, chiamati prest-cancer ½; se questi risultano mutati, si ha una alta probabilità di sviluppare un carcinoma mammario. Spesso una delle terapie migliori per il carcinoma mammario è l'eliminazione della fonte di ormoni (isterectomia). Per fare ciò, bisogna effettuare un controllo dei recettori delle cellule della mammella per gli estrogeni e per i progesteroni. Se la mammella risulta avere Status + per i recettori degli estrogeni e progesterone, esiste l'80% di probabilità che questo sia un tumore ormone-dipendente. Da notare, inoltre, è che l'estradiolo stimola la sintesi del recettore del progesterone, quindi il recettore del progesterone è estradiolo-dipendente.
Se i recettori hanno Status -, il tumore non è ormone-dipendente. Tutti i tumori ormono-dipendenti hanno prognosi favorevole se si elimina la sorgente del tumore. La cura d'elezione è l'uso di medicinali ormono-simili, in modo da inibire la funzionalità ipotalamica. Il tamoxifen è un farmaco importantissimo , in quanto blocca l'aromatasi, enzima che trasforma gli androgeni in estrogeni nella cellula della granulosa. I farmaci devono essere, inoltre, protettive nei confronti di infarto e osteoporosi.
Il CA mammario prevede la ricerca di diversi marcatori:
CEA.
TPA.
CA 13.
MCA.
CA 549 + TAG 72.
B72-73.
4.1.2 Tumore Ovarico Ormone Secernente
Solo il 5-6% dei tumori ovarici mostra attività funzionale e provoca conseguenze endocrine. Si tratta di tumori mesenchimali (della teca e della granulosa) e tumori dei cordoni sessuali derivati dalle cellule ilari (a cellue Sertoli-Leydig, androblastomi e arrenoblastomi). I tumori androgeno-secernenti ( 200 ng/dl) provocano irsutismo e virilismo, mentre quelli estrogeno-secernenti (alto estradiolo) provocano amenorrea associata a sanguinamenti uterini irregolari.
Ricerca di marcatori:
AFP.
CA 12
4.1.3 CA endometrio
Il carcinoma dell'endometrio probabilmente è giocato dall'esposizione prolungata agli estrogeni, in contemporanea diminuzione del progesterone, come avviene nella prima fase del ciclo mestruale fisiologicamente. Il rischio di questo tumore era ben otto volte più alto nelle donne che cominciarono ad usare i primi contraccettivi.
Anche il dietilstibestrolo, un estrogene sintetico, usato come antiabortivo. Questo agisce come agente iniziante nelle figlie di queste donne che, grazie all'azione promuovente degli ormoni del menarca, determinava la formazione di un adenocarcinoma a cellule chiare della vagina (originate dai dotti mulleriani).
4.1.4 CA prostata
Per studiare il CA prostatico bisogna prendere in esame la sua tipica lesione precancerosa che è l'ipertrofia prostatica. In realtà si tratta di una iperplasia dell'aliquota parenchimale della ghiandola e di una ipertrofia dell'aliquota stromale della ghiandola. In tal modo la prostata può aumentare di tre o quattro volte il suo volume. È molto diffusa negli anziani. L'ipertrofia interessa generalmente la porzione periuretrale (sensibile a androgeni ed estrogeni), mentre il CA interessa la porzione sottocapsulare (sensibile solo agli androgeni).
Il carcinoma prostatico, altro importante esempio di tumore ormono-dipendente, potrebbe essere dovuto al calo della produzione di testosterone in età senile con un relativo aumento degli estrogeni. La sintimatologia iniziale è legata a disturbi della minzione e tende a metastatizzare il tessuto osseo con conseguenze gravissime. Il trattamento è costituito da somministrazione di flutamide o ciprotene acetato che competono a livello recettoriale con gli androgeni e specificamente con il 5-diidrotestosterone[4].
Le analisi di laboratorio si basano sulla ricerca del PSA e sul PAP.
4.2 Sindromi endocrine paraneoplastiche
In questo gruppo rientrano quei tumori secernenti ormoni, e le manifestazioni disendocrine associate, con origine ectopica. Le manifestazioni sono associate, inoltre, ai segni clinici legati alla presenza di masse tumorali e le compressioni da esse causate. In genere l'asportazione della neoplasia risulta la terapia principale. La produzione ectopica degli ormoni è relativa solamente agli ormoni di natura proteica[5].
4.2.1 ACTH
Pochi sono i tumori in grado di produrre ACTH in modo da determinare la sindrome di Cushing (15%) e tra questi il microcitoma è importante.
4.2.2 Gh e GhRh
La produzione ectopica di ormone della crescita e del suo fattore di rilascio è spesso collegato al CA polmonare e dello stomaco. Dà segni tipici dell'acromegalia.
4.2.3 ADH e Ossitocina
Prodotta principalmente dal microcitoma, e in parte da altri carcinomi quali quelli prostatici ed esofagei, nel corso delle quali queste cellule possono sintetizzare anche ossitocina e neurofisine.
4.2.4 Gonadotropine
Il coriocarcinoma, la mole idatiforme e svariati tumori gonadici possono secernere gonadotropine. Spesso si riscontra un ipertiroidismo più o meno conclamato provocato dall'attività TSH-simile espletata dalla molecola gonadotropica.
4.2.5 Sostanza PTH-simile
In circa il 10% dei pazienti con tumore si sviluppa una condizione di ipercalcemia non legata a osteolisi da osteoma o metastasi ossee, bensì legata alla secrezione della sostanza PTH-simile secreta frequentemente dai CA squamocellulari, CA renali e della cistifellea.
4.2.6 Calcitonina
Questa sostanza è prodotta in genere da CA bronchiali, polmonari e della mammella. Non è attiva, quindi non si riscontra ipocalcemia; il suo dosaggio è usato come monitoraggio.
4.2.7 Somatomedine
Nei pazienti con tumori mesenchimali, come i mesoteliomi e sarcomi blastici, ed epiteliali, come gli epatomi, si riscontra una marcata ipoglicemia dovuta alla produzione di IGF-1 e IGF-2.
4.2.8 EPO e simili
Vari tumori renali ed extrarenali possono determinare la produzione di EPO e fattori di crescita emopoietici, con lieve aumento dell'ematocrito e granulocitosi ed eosinofilia, non riportabili a stati di infezioni. Sono spesso frequenti nel Morbo di Hodgkin.
5 Cancerogenesi virale
I virus oncogeni sono convenzionalmente divisi in oncogeni a DNA o a RNA. L'interazione di una singola particella virale è sufficiente per indurre trasformazione, associata alla persistenza di tutto o parte del genoma virale in quello della cellula infetta[6].
Il DNA virale integrato può indurre trasformazione mediante introduzione di un nuovo gene trasformante o, mediante l'alterta espressione di un gene preesistente.
1 Virus oncogeni a DNA
I virus a DNA modificano il loro comportamento in base allo stato di permissività cellulare. Se la cellula è permissiva, l'infezione determina replicazione virale; se la cellula non è permissiva, allora la replicazione determina trasformazione. Alcune cellule possono essere permissive per un virus e per altri no. I virus a DNA tendono a provocare la trasformazione quando non sono nei loro ospiti naturali. La trasformazione avviene per integrazione del DNA originario. Le cellule trasformate non rilasciano mai virus infettivo. La maggior parte delle cellule non permissive infettate vanno incontro alla cosiddetta trasformazione abortiva: acquisiscono i caratteri di crescita di cellule trasformate soo per poche generazioni.
1.1 Papovavirus
Di questa famiglia fanno parte i Poliomavirus e i Papillomavirus. Hanno tutti diametro compreso tra i 45 e 55 nm. Esprimono l'antigene TSTA e l'antigene S, localizzati sulla membrana, capaci di suscitare una reazione cellulomediata; altri antigeni come T ed U sono localizzati a livello nucleare.
1.1.1 Poliomavirus e SV 40
La loro scoperta è legata alle leucemie murine. Hanno spiccato tropismo per le cellule del sottocute. Il Poliomavirus e SV40 contengono proteine precoci e proteine tardive. La regione precoce è espressa nella prima fase dell'infezione, codificando per tre proteine: antigene T piccolo, intermedio e grande, necessari per la trasformazione neoplastica.
T medio di Polioma, infatti, si associa alla membrana plasmatica complessandosi con la proteina c-src.
T grande di SV40, invece, si trova nel nucleo complessandosi con i prodotti degli oncosoppressori p53 e RB.
1.1.2 Papillomavirus
Hanno spiccato tropismo per le cellule cutanee e delle membrane mucose. Il DNA dei Papillomavirus contiene molteplici ORF (sequenza continua di nucleotidi non interrotta da codoni di stop), presenti sia nelle regioni precoci sia tardive. I geni E7 e E8 hanno capacità di legame con proteine DNA-binding che legano il DNA, cui è attribuita la loro capacità trasformante, o possono complessarsi a p53.
1.2 Adenovirus
Gli Adenovirus possono causare infezioni dell'apparato respiratorio e oculari. Questi hanno forma icosaedrica e non sono forniti di involucro lipoproteico. Ogni virione ha diametro medio di 80 nm. Questi provocano infezione produttiva delle cellule umane uccidendole. Solo i geni della fase precoce sono responsabili della trasformazione. La proteina precoce E1A forma complessi con pRB, mentre la E1B con p53.
1.3 Poxvirus
I Pxvirus sono grandi, a forma di mattone, con un genoma lineare di DNA bicatenario. I più importanti sono Yaba e Shope, ma provocano tumori solo nelle scimmie. Il virus del mollusco contagioso provoca piccole neoformazioni benigne, producendo fattori di crescita simili all'EGF e al TGF.
1.4 EBV
Il virus di Epstein-Barr si presenta con un nucleo-capside icosaedrico, circondato da un envelope, che possiede diverse glicoproteine, ed ha diametro di circa 200 nm ed ha DNA a doppia elica che codifica per circa 30 polipeptidi. Penetra a livello dell'oro-faringe (Kiss Disease) e si moltiplica in vivo nelle cellule epiteliali, diffondendo ai tessuti linfoidi e linfociti. Il virus di Epstein-Barr si lega ai linfociti mediante recettori per C3d (o CD21), mediante le proteine gp250/350 dell'envelope (EBV può avere recettori specifici anche sull'epitelio della cervice uterina). Questo non provoca la lisi dei linfociti B, bensì ne determina la trasformazione in senso neoplastico immortalizzandoli. Il DNA penetra nella cellula ospite e può essere integrato in essa o esistere in forma episomica.
L'aspetto della patologia da EBV più importante è l'immortalizzazione dei linfociti B per i quali l'EBV ha un gran tropismo.
I linfomi associati sono non-Hodgkin di alto grado a piccole cellule.
Un elemento costante nel 100% di questi linfomi è la traslocazione cromosomica. In queste traslocazioni si ha espressione dell'oncogène c-myc: la rottura del cromosoma 8, infatti, determina la traslocazione del segmento 8q24 in posizioni adiacenti ai geni delle Ig nei cromosomi 14 (c. pesanti), 2 (c. leggere k) o 22 (c. leggere l); queste regolano il differenziamento dei linfociti B e sono sempre espresse. Altre mutazioni possono interessare il gene ras. La proteina di membrana LMP-1 può, inoltre, prevenire l'apoptosi delle cellule infette aumentando l'espressione di bcl-2. Il 100% dei pazienti con linfoma di Burkitt presenta un titolo anticorpale elevato per gli antigeni VCA.
Altri tumori in cui EBV è una delle principali cause sono il CNF (carcinoma di tipo indifferenziato) e il linfoma linfocitico (in caso di ospite immunocompromesso).
L'uso di pesce essiccato e salato contenente una gran quantità di nitrosamine sono altri fattori ambientali per la proliferazione di CNF, tipico della popolazione nipponica. Pazienti con CNF presentano un alto titolo di anticorpi anti-VCA e anti-EA.
Pazienti che hanno contratto l'infezione da EBV hanno un rischio più alto di tre volte di sviluppare un cancro. Antigeni virali sono stati riscontrati nella cellula di Reed-Stenberg per cui si pensa che EBV sia implicato anche nello sviluppo del linfoma di Hodgkin.
Antigeni presenti (vedi "EBV e Tumori"):
EBNA.
VCA.
EA.
LMP.
MA.
1.5 HBV
Il rischio di carcinoma epatico è associato ad uno stato di portatore cronico di epatite B, in cui è riscontrabile HbsAg nel sangue (questi pazienti durante la convalescenza non hanno sviluppato anti-Hbe, segno prognostico favorevole e indice di guarigione). I soggetti che hanno subito l'infezione da HBV hanno maggiore rischio di sviluppare epatocarcinoma (>200 volte). Non sono mai stati descritti, infatti, carcinomi epatocellulari senza la presenza di sequenze DNA virali integrate o solo episomali. La caratteristica principale del HCC è la presenza di anomalie cromosomiche in corrispondenza del sito di integrazione del DNA virale, come l'integrazione a livello del cromosoma 17p con perdita di un allele del gene oncosoppressone p53.
La proteina HBx, inoltre, è responsabile dell'alterazione della crescita delle cellule infette mediante maggiore espressione del gene di IGF-2 e per IGF-1R; questi fattori determinerebbero un tipo di stimolazione paracrina.
La capacità, inoltre, di indurre uno stato di danno e flogosi agli epatociti, è un altro fattore importante di cancerogenesi; questi, infatti, rispondono al danno con una iperplasia rigenerativa che può aumentare il numero di possibili mutazioni e instabilità cromosomica. Oltre a ciò, infine, è bene ricordare sostanze come le aflatossine.
I principali markers tumorali, di grande importanza prognostica anche nelle cirrosi ed epatici sono:
AFP.
BFP.
α2-H-globulina.
2 Virus oncogeni a RNA (Retrovirus)
I virus a RNA non prendono in considerazione lo stato di permissività delle cellule e in esse possono sia replicarsi che determinare la trasformazione; questi, dunque, possono rilasciare il virus infettivo. L'integrazione avviene dopo la copia del RNA virale in DNA, mediante la transcrittasi inversa (DNA-polimerasi RNA-dipendente).
2.1 HTVL-1
Esiste un altro sottotipo di HTLV, detto HTLV-
2.2 HIV
Il virus dell'HIV non è oncogeno, ma predispone l'organismo alle neoformazioni, data la minore sorveglianza immunitaria. I soggetti con HIV conclamato possono, infatti, avere infezioni da EBV e avere, così, linfomi, infezioni da HTVL e da HBV, sviluppando tumori epatici. In questi soggetti si riscontra, inoltre, un aumento di verruche precancerose e CA squamosi cervicali ed ano-genitali. È, inoltre, maggiore l'incidenza del sarcoma di Kaposi.
6 Difetti ereditari e cancerogenesi
Il 20% dei tumori è con etiologia endogena, di questi solo il 5% ha un substrato ereditario. Le alterazioni genomiche alla base del processo neoplastico sono presenti, oltre che nelle cellule tumorali, in tutte le cellule dell'organismo perché parte integrante del patrimonio genetico.
Bisogna ricordare, però, che queste neoplasie hanno substrato ereditario, ma non sono ereditarie.
L'aspetto ereditario dei tumori va considerato come un addizionale e preesistente fattore di rischio al fine dello sviluppo della neoplasia. Il rischio può essere considerato:
Specifico: predispone per alcune patologie ben determinate, come il Retinoblastoma, il tumore di Wilms etc.
Generico: predispone per difetti dei geni indirettamente coinvolti nella trasformazione neoplastica come i geni del sistema immunitario, del sistema metabolico cellulare che trasforma i procancerogeni in cancerogeni etc.
Le alterazioni genomiche riscontrate nei tumori sono le più svariate, come l'amplificazione genomica, attivazione d'oncogéni etc.
Tutte queste alterazioni possono essere cooperare con cancerogeni fisici, chimici e virali in modo da aumentare la probabilità di errori nel genoma. Tutti questi errori devono, poi, essere trasmesse e perpetuate nel tempo.
Nell'uomo particolare importanza è legata alle immunodeficienze su base ereditaria che predispongono ad un aumento dell'incidenza di linfomi e leucemie
6.1 Difetti di riparazione del DNA
Molti difetti possono non essere trasmessi alle cellule figlie se sono riparati prima che la cellula vada incontro al processo replicativo. L'esempio più importante di difetto di riparazione dei danni al DNA è data dallo Xeroderma Pigmentosum. Questa è una patologia caratterizzata da una marcata incidenza di tumori, quali epiteliomi, melanomi e CA squamocellulari, legati all'incapacità di riparare i danni al DNA.
Un'altra importante patologia è
Ancora vi è l'Anemia di Fanconi, caratterizzata da anemia aplastica con malformazione dei reni e degli arti superiori.
6.2 Difetti del sistema enzimatico microsomiale
Il DMES è sotto il controllo del locus Ah i cui geni presiedono all'attività del citocromo P-450[8]. Il tumore insorge in quei soggetti che hanno un aumento dell'attività enzimatica per cui i procancerogeni (I.A.P) sono trasformati molto rapidamente in cancerogeni (dioli, epossidi, diol-epossidi).
7 Principali neoplasie a base ereditaria
7.1 Retinoblastoma
Il retinoblastoma è legato a due meccanismi etiologici. La prima (60% dei casi) dipende dalla trasmissione di una mutazione che provoca insorgenza di neoplasia, generalmente bilaterale, plurifocale, entro i primi 15 mesi di vita. La seconda è legata alla comparsa di una mutazione somatica nel retinoblasto che provoca l'insorgere di una neoplasia, questa volta monofocale, entro in primi 5 anni di vita. La mutazione presente nella linea germinale si trasmette con carattere autosomico dominante. L'intervento principale è enucleazione di uno o entambi gli occhi. Spesso il tumore metastatizza provocando la comparsa di un secondo tumor, l'osteosarcoma.
Il gene coinvolto è situato sulla banda q14.2 del cromosoma 13, soprannominato RB. Questi è deleto o mutato nel retinoblastoma e perde tutte le sue proprietà legate al controllo della proliferazione.
7.2 Tumore di Wilms
Il tumore renale di Wilms insorge nella prima infanzia con comparsa entro i primi 5 anni di vita. Questi può anche insorgere, a volte, in altre sedi dell'apparato geno-urinario. È associato, spesso, ad aniridia[9] e ritardo mentale, sindrome chiamata WAGR (Wilms tumor, Aniridia, Genitourinary malformations, mental Retardation). Questa patologia presenta anomalie a carico del locus 11p13 del cromosoma 11, soprannominato WT-1
7.3 CA mammario
Il CA mammario presenta anch'esso base ereditaria. Diverse sono le alterazioni genomiche. I fattori ereditari portano alla comparsa del tumore bilateralmente entro i 40 anni di vita. L'insieme di queste alterazioni, data la frequenza del tumore, si pensa siano trasmesse per via autosomica dominante.
Il locus maggiormente interessato è il 17q21 del gene p53.
7.4 CA del colon-retto
La maggior parte dei CA del colon-retto origina da lesioni precancerose preesistenti quali polipi adenomatosi, per i quali è possibile calcolare, in base al tipo di crescita epiteliale e alle dimensioni, il rischio di trasformazione in carcinoma. La sindrome ereditaria, inoltre, detta FAP (Familiar Adenomatosis Polyposis), va aggiunta ai fattori di rischio. Questa è caratterizzata dalla delezione 5q21-22, ove sono presenti i geni APC (Adenomatosis Polyposis Coli) e MCC (Mutated Colonic Cancer), entrambi con funzione oncosoppressore; a questi si associa costantemente attivazione di protooncogeni quali c-myc e ras. Tardivamente si può riscontrare un'anomalia a carico di p53 che codifica per una proteina abnorme non attiva.
La lesione di partenza è l'iperplasia dell'epitelio colico. Il polipo adenomatoso, invece, si presenta in tre forme: adenoma villoso, adenoma tubulo-villoso e adenoma villoso; la lesione tubulare è quella a maggior rischio.
I marker più importanti sono CA 19.9 e B72-73.
7.5 Melanoma
Una varietà familiare di melanoma si presenta con un'incidenza del 10%. Sia il melanoma che il nevo displastico, sua lesione precancerosa, sono caratterizzati dall'alterazione e attivazione di un gene localizzati sul cromosoma 9p21, oncosoppressore codificante per la proteina p16, trasmesso con carattere autosomico recessivo. Il prodotto genico è la proteina p16 che si lega a cdk4 impedendole il legame alla ciclina D arrestando la cellula in fase G1.
I radicali liberi sono dannosi se formati al momento del danno al genoma, ma potenziano, invece, l'attività dei sistemi cellulari riparativi.
Il 5-diidrotestosterone deriva dal testosterone mediante l'enzima 5-a-reduttasi; la sua concentrazione aumenta tantissimo nei CA prostatici tanto che si pensa sia la causa principale di stimolazione del tumore.
In alcuni tumori, tuttavia, si può verificare l'accentuazione di alcune trasformazioni metaboliche con il risultato di un aumento delle concentrazioni di ormoni steroidei. È il caso di alcuni epatomi ove si ha un aumento della trasformazione di deidroepiandrosterone in estrone ed estradiolo.
HTLV è associato, inoltre, alla paraparesi spastica tropicale, conosciuta anche come Sindorme di Sjogren, patologia debilitante associata a demielinizzazione. Non è chiara se gli oligodendrociti o i neuroni siano infettati dal virus, ma sono attaccati da CTL specifici per la proteina HTLV-1 tax. È probabile che questo meccanismo autoimmune sia implicato, inoltre, nello sviluppo di altre patologie immunodeficienti quali polimiositi e nevriti.
 |
| Appunti su: carcinogenesi radiazioni uv, |
|
| Appunti Nutrizione |  |
| Tesine Bellezza |  |
| Lezioni Bambini |  |